不同加工环节对婴幼儿配方乳制品羰氨反应3 种指标含量的影响
2024-04-25袁懿炜1李归浦进1储小军
冯 涛,袁懿炜1,,李归浦,赵 进1,*,储小军
1 中国计量大学生命科学学院,食品营养与质量安全研究所,浙江 杭州 3100182 特色农产品品质与危害物控制技术浙江省重点实验室,浙江 杭州 3100183 贝因美(杭州)食品研究院有限公司,浙江杭州 310058
0 引言
当前,国内外研究者重视乳制品加工储藏过程中的羰氨反应,在探索羰氨反应机理及特点过程中形成相关理论体系。乳制品羰氨反应主要分3 个阶段:初级、高级和终级阶段。初级阶段主要是乳糖与赖氨酸反应生成希夫碱,经Amadori分子重排转化为乳糖基赖氨酸[1],该阶段会导致可利用赖氨酸和乳糖含量降低。高级阶段主要是Amadori化合物分解形成糠醛类化合物[2]。终级阶段较复杂且反应机制尚不清楚,主要是高级阶段的中间产物与氨基化合物反应生成晚期糖基化终末产物和类黑精化合物[3],该阶段会导致赖氨酸进一步损失。
乳制品加工储藏过程中发生羰氨反应不仅影响营养价值,同时对安全构成较大隐患。在乳制品营养性方面,许多氨基酸都易与乳糖发生羰氨反应而失去其功能,其中最易在羰氨反应中损失的是赖氨酸。研究表明,牛乳在100 ℃、110 ℃、120 ℃ 3次灭菌20 min后,乳中的赖氨酸损失为1.1%、3.6%、9.6%[4]。即使在羰氨反应初级阶段,赖氨酸与还原糖反应,产生糖基化赖氨酸如乳果糖赖氨酸,使大量赖氨酸被束缚和破坏。
在乳制品安全方面,羰氨反应产生影响人体健康的产物,主要包括糠醛类化合物(主要是糠氨酸和羟甲基糠醛)[5]和晚期糖基化终末产物(主要是羧甲基赖氨酸)。羟甲基糠醛已被证实能损害老鼠的DNA,诱发并促进大鼠结肠癌和引起中毒性肾损害[6]。欧洲食品安全委员会(EFSA)研究表明,糠醛类化合物对小鼠和大鼠具有明显致癌性,且这种致癌性可遗传。欧洲食品安全委员会推荐羟甲基糠醛最大限量为1.6 mg/人·d。Janzowski等[7]认为,摄入羟甲基糠醛 0.5~1.0 mg/kg没有健康威胁。一项旨在研究糠醛类化合物对雄鼠生殖系统影响的研究发现,糠醛类化合物对雄性生殖系统具有毒害性[8]。晚期糖基化终末产物已被证明可引起氧化性应激和毒害神经元细胞[9],降低线粒体活力,导致能量衰竭,引发炎症。
本试验以婴幼儿配方乳粉为对象,通过关键加工过程(生乳巴氏杀菌、配料乳混合、均质、浓缩、浓缩乳)中羰氨反应相关评价指标(5-羟甲基糠醛、糠氨酸、可利用赖氨酸)检测分析,为建立针对乳制品关键加工过程的羰氨反应综合控制技术,创制基于该控制技术的新一代婴幼儿配方乳粉产品并实现产业化,对乳制品品质保障、质量安全及提高国人营养与健康等具有社会和经济意义。
1 试验方法
1.1 仪器与材料
1.1.1 设备仪器
高效液相色谱(岛津);万分之一分析天平(梅特勒);电热恒温鼓风干燥箱(立德泰勀(上海)科学仪器有限公司)。
1.1.2 相关试剂
L-赖氨酸标准品(上海叶源生物);5-羟甲基糠醛标准品(上海叶源生物);糠氨酸标准品(上海叶源生物);甲醇(色谱纯,麦可林);三氟乙酸(麦可林);草酸(麦可林);亚铁氰化钾(麦可林);乙酸锌(麦可林);6 mol/L盐酸溶液;在75 mL水中加入25 mL浓盐酸,混匀;OPA衍生试剂;称取0.134 3 g邻苯二甲醛(麦可林)溶于7.5 mL甲醇溶液中,加入125 μL的β-巯基乙醇(麦可林)混合均匀,用0.4 moL硼酸钠(麦可林)缓冲溶液(0.4 moL/L,pH值=9.5)定容至25 mL,置于冰箱内4 ℃保存1 周。
1.2 试验方法
本试验按照婴幼儿乳粉生产工艺,依次采集生乳(巴氏杀菌前后)、配料乳(均质前后)、配料乳减压浓缩、浓缩等各环节乳制品样品。各环节采集样品为同一批次,保证样品选用原料奶本底一致。选取3 种产品的生产线进行样品采集。
1.2.1 样品采集方案
对3 条生产线产品的每种工艺环节均采集3 个样品,每个样品混合均匀后分成2 份,分别测定其中3 种物质的含量指标。
1.2.2 检测方法
(1) 5-羟甲基糠醛含量检测
样品前处理。液体样品:准确量取液体样品10 mL于具塞试管中,加入5 mL草酸溶液,混合均匀,沸水浴加热25 min,冷却至室温。加入3 mL亚铁氰化钾溶液和3 mL乙酸锌溶液,振摇后静置15 min,转移至50 mL容量瓶中,用甲醇定容。中速滤纸过滤,弃去初滤液,收集滤液并用0.45 μm滤膜过滤,待测。
色谱条件。ODS-C18色谱柱(250 mm × 4.6 mm,5 μm);流动相:甲醇-水(10∶90);流速:1.0 mL/min;柱温:25 ℃;进样体积:20 μL;紫外检测波长:280 nm。
(2) 糠氨酸含量检测
样品前处理。吸取10.00 mL液体样品,置于耐压瓶中,加入10.00 mL 10.6 mol/L盐酸溶液,涡旋混匀。置于干燥箱,110 ℃加热水解23 h以上。加热结束后冷却至室温,将试管从干燥箱中取出,定容至20.00 mL后用中速定量滤纸过滤。移取1.00 mL试样水解液,过0.22 μm水相滤膜,滤液供上机测定。
色谱条件。ODS-C18色谱柱(250mm×4.6 mm,5 um);流速:1.0 mL/min;柱温:25 ℃;进样体积:20 μL;紫外检测波长:280 nm;流动相:A相(0.1%三氟乙酸溶液),B相(甲醇);洗脱梯度见表1。
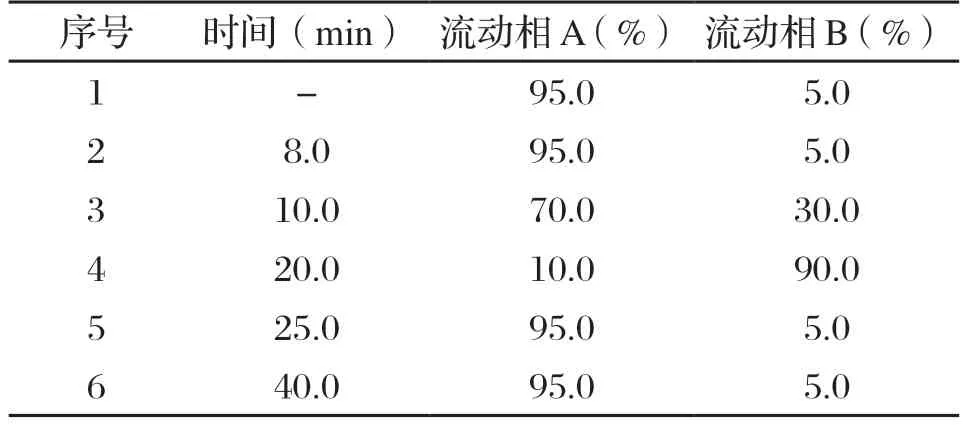
表1 洗脱梯度
(3) 可利用赖氨酸含量检测
样品前处理。同(2)中样品前处理方法。
OPA衍生化。吸取100 μL水解液和400 μL OPA溶液混合均匀后,过0.22 μm水相滤膜,滤液供上机测定。
(3)色谱条件。ODS-C18色谱柱(250mm×4.6 mm,5 μm);流动相:甲醇-乙腈-水(45∶45∶10);流速:1.0 mL/min;柱温:25 ℃;进样体积:20 μL;紫外检测波长:325 nm。
2 结果与讨论
3 条生产线每个阶段样品中的赖氨酸、5-羟甲基糠醛、糠氨酸含量的检测结果如表2所示。
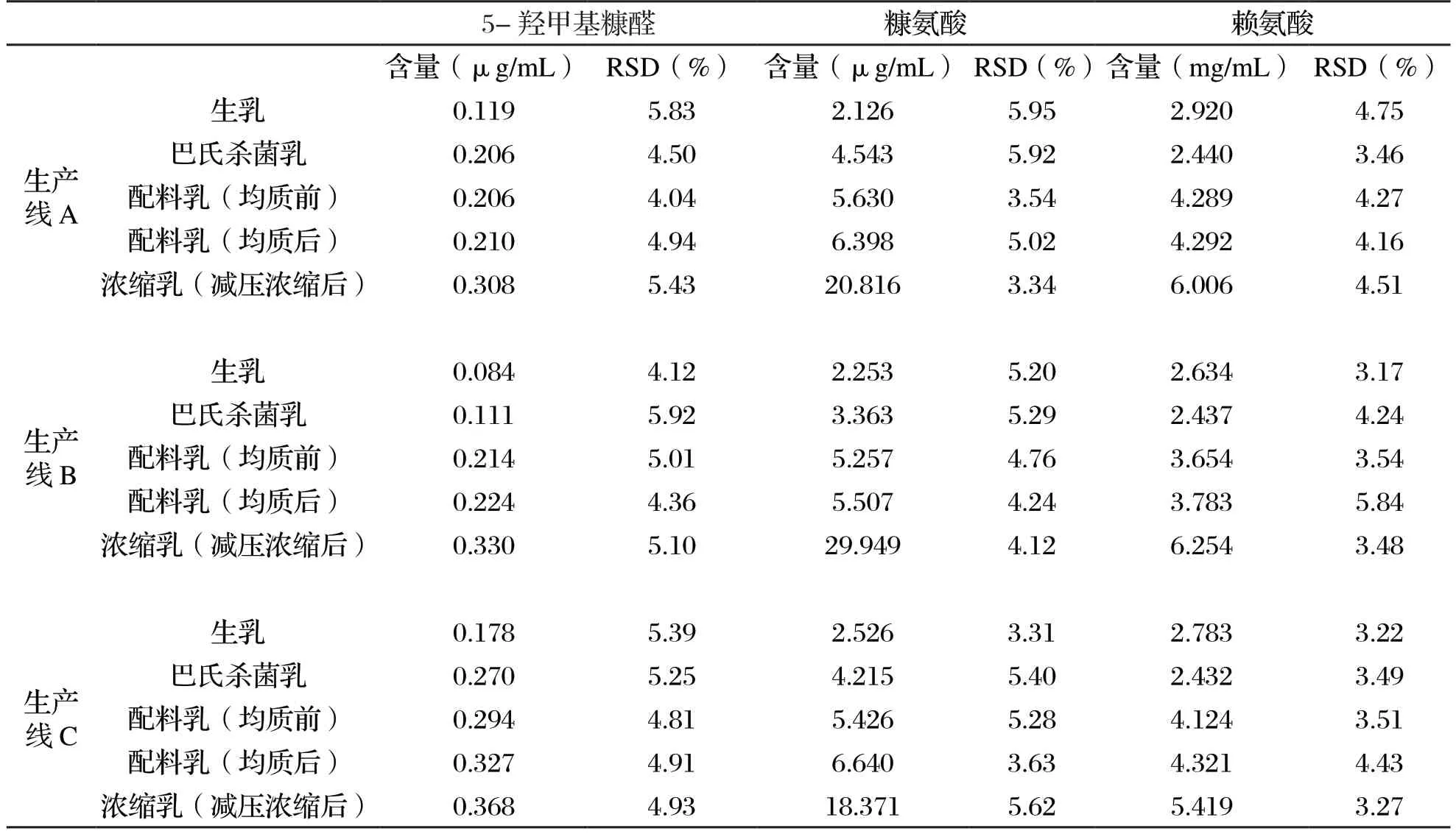
表2 样品中赖氨酸、5-羟甲基糠醛、糠氨酸含量
2.1 5-羟甲基糠醛含量变化分析
3 条生产线各工艺阶段5-羟甲基糠醛含量变化如图1所示。3 条生产线产品在巴氏杀菌前后的5-羟甲基糠醛含量上升0.027~0.092 μg/mL,均有显著性差异(P<0.05)。均质前后的配料乳的5-羟甲基糠醛含量没有显著性差异。减压浓缩后的浓缩乳较配料乳5-羟甲基糠醛含量上升0.042~0.106 μg/mL,均有显著性差异(P<0.05)。因此,巴氏杀菌以及减压浓缩阶段的加热过程促使牛乳发生羰氨反应,产生中间产物5-羟甲基糠醛。

图1 各工艺阶段5-羟甲基糠醛含量变化
2.2 糠氨酸含量变化分析
3 条生产线各工艺阶段糠氨酸含量变化如图2所示。生产线样品的糠氨酸含量变化趋势一致,在巴氏杀菌前后糠氨酸含量上升1.110~2.416 μg/mL,均有显著性差异(P<0.05)。巴氏杀菌乳添加辅料后糠氨酸含量有显著性差异(P<0.05),配料乳浓缩后糠氨酸含量上升11.731~24.442 μg/mL,有极显著差异(P<0.01)。
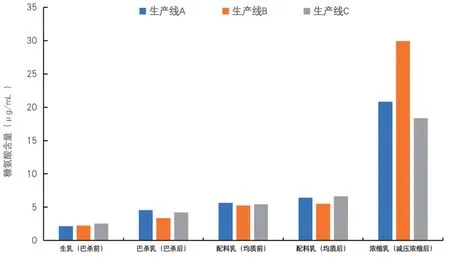
图2 各工艺阶段糠氨酸含量变化
糠氨酸含量的检测结果表明,浓缩阶段羰氨反应大量产生糠氨酸导致含量大幅度上升。巴氏杀菌前后以及配料导致的糠氨酸含量显著性变化。此外,配料阶段糠氨酸含量上升24%~56%,但由于本底中糠氨酸含量极低,所以糠氨酸含量在巴氏杀菌乳和配料乳中含量维持在低水平。影响样品中糠氨酸上升的最主要阶段为浓缩阶段。
2.3 可利用赖氨酸含量变化分析
3 条生产线各工艺阶段可利用赖氨酸含量变化如图3所示。3 条生产线样品的可利用赖氨酸含量变化趋势一致。生乳在巴氏杀菌后可利用赖氨酸含量降低7%~26%,说明巴氏杀菌阶段高温引起羰氨反应消耗赖氨酸,含量变化不显著(P>0.05)。巴氏杀菌乳配料后赖氨酸含量显著性增加(P<0.05),可能是配料中含有赖氨酸或蛋白质成分。减压浓缩后赖氨酸含量升高25%~65%,有显著性差异(P<0.05)。
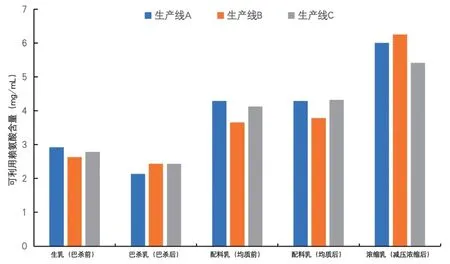
图3 各工艺阶段赖氨酸含量变化情况
3 结论
分析结果表明,3 条生产线样品由于工艺不同,3 个检测指标变化程度存在差异,但整体变化趋势一致。婴幼儿配方乳粉各关键加工过程中羰氨反应主要集中在巴氏杀菌阶段和浓缩阶段。其中巴氏杀菌阶段,生产线样品中可利用赖氨酸含量降低7%~26%,糠氨酸含量上升46%~113%,5-羟甲基糠醛含量上升32%~72%。羰氨反应消耗赖氨酸,生产5-羟甲基糠醛和糠氨酸。同时由于本底中5-羟甲基糠醛和糠氨酸含量很低,巴氏杀菌阶段生成5-羟甲基糠醛和糠氨酸总量仍在较低水平。
浓缩阶段样品脱去水分,各组分浓度上升。生产线样品中可利用赖氨酸含量上升25%~65%,糠氨酸含量上升176%~444%,5-羟甲基糠醛含量上升12%~47%。糠氨酸含量变化程度远大于可利用赖氨酸,说明除浓缩导致原糠氨酸浓度上升以外,浓缩阶段羰氨反应大量产生糠氨酸。5-羟甲基糠醛含量上升程度低于可利用赖氨酸含量变化,说明在浓缩阶段5-羟甲基糠醛继续参与反应导致含量下降。
本研究羰氨反应的原料赖氨酸、中间产物5-羟甲基糠醛以及后期产物糠氨酸,可作为评价婴幼儿配方乳粉各关键加工过程中羰氨反应程度的重要指标。同时结果表明,各关键加工过程中羰氨反应主要集中在巴氏杀菌阶段和减压浓缩阶段。可通过监控3个指标变化情况对巴氏杀菌和减压浓缩阶段的工艺参数进行调整,为婴幼儿配方乳粉加工工艺优化提供参考。
