MAPK通过调控TLR4/Myd88/NF-κB通路对妊娠期肠梗阻胃肠功能的影响
2024-04-25高飞李景李洪健
高飞 李景 李洪健
1河北医科大学第二医院普外科 (石家庄 050000);河北省第八人民医院2护理部,3普外肛肠科(石家庄 050000)
肠梗阻为肠道中肠道内容物不能正常运行、通过,不但可造成肠管本身功能、解剖结构变化,且可引发全身性生理紊乱,严重情况下可危及生命,临床多通过手术、放置支架、广谱抗生素治疗,多数患者可经上述方法治疗恢复,但其复发率较高,进而对患者生命安全构成了严重威胁[1-2]。妊娠期肠梗阻多发生于存在腹部手术史、剖宫产史人群,发病率较低,胃肠道为全身炎症反应的始动器、触发器,在肠梗阻发生后胃肠吸收、消化功能遭受破坏,易引发肠黏膜屏障损伤,进而造成了一系列生理、病理变化、甚至造成了多器官功能障碍综合征、全身炎症反应综合征,加重了妊娠期肠梗阻患者病情,故需及时诊治[3-4]。促分裂原活化蛋白激酶(MAPK)是可对多种细胞外刺激做出反应的丝氨酸/苏氨酸蛋白激酶,与癌症、自身免疫性疾病等存在密切联系。Toll 样受体4/髓样分化因子88/核转录因子-κB(Toll-like receptor 4/myeloid differentiation factor 88/nuclear transcription factor-κB,TLR4/MyD88/NF-κB)通路是与免疫性疾病、炎症性疾病存在密切联系的信号通路,对炎性因子释放具有促进作用,可引发肠黏膜细胞再灌注损伤,进而加重了肠梗阻患者病情。目前临床关于MAPK 通过调控TLR4/Myd88/NF-κB 通路对妊娠期肠梗阻胃肠功能影响的相关研究较少,基于此,本研究分析MAPK 通过调控TLR4/Myd88/NF-κB 通路对妊娠期肠梗阻胃肠功能的影响,为妊娠期肠梗阻诊断、治疗提供参考。
1 材料与方法
1.1 材料选取SPF 级Wistar 大鼠105 只,雌性、雄性分别为70、35 只,体质量220 ~ 260 g,由珠海百试通生物科技有限公司提供,动物许可证号:SYXK(粤)2020-0229,所有大鼠在无病原菌环境(室温23oC、相对湿度50%)中进行喂养,高温高压对所使用的水、食物进行杀毒,共进行5 d 适应性喂养,本研究操作均参照动物试验伦理相关要求,且研究经医院伦理委员会批准,批准号:(2019)伦审第(56)号。
主要试剂与仪器:水合氯醛(武汉荣灿生物科技有限公司),PCR 试剂盒[天根生化科技(北京)有限公司;KG204],ELISA 试剂盒(上海笃玛生物科技有限公司),LX-400 迷你离心机(江苏海门其林贝尔仪器制造有限公司),-80 ℃超低温冰箱(日本Sanyo 公司)。
1.2 方法
1.2.1 MAPK 慢病毒载体构建LPL 基因序列经GenBank 查找序列而获得,构建MAPK 沉默、过表达转染质粒,通过上海吉玛公司设计和合成,并行慢病毒滴度测定(病毒滴度为1 × 109TU/mL)。
1.2.2 分组与建模在喂养5 d 后,将所有大鼠同笼放置,第2、3 天连续进行阴道栓检查,将受孕大鼠纳入后续研究,共有33 只雌性大鼠妊娠成功,将妊娠成功的大鼠继续饲养12 d,第13 天将妊娠成功的8 只作为空白组,剩余25 只雌性大鼠参照孟莹等[5]建立肠梗阻模型,术前禁食、禁水12 h,1%水合氯醛(10 mL/kg)麻醉后,对大鼠进行固定,将腹部毛发剔除,将碘伏全面涂抹至腹部,之后采用眼科剪沿下腹正中线在大鼠下腹正中做约2 cm 的切口,以此将皮肤、浅筋膜、腹壁肌肉切开,使得腹腔暴露,使用无损伤钳将距盲肠15 cm 左右小肠及盲肠取出,取出后放置于提前采用生理盐水浸润的纱布之上,对肠道结构进行辨认,采用生理盐水自上而下进行擦拭,共5 次,期间应小心操作,保持力道均匀,避免对肠系膜血管造成损伤,体外暴露30 min 后还纳腹腔,期间保持轻柔,避免肠道扭转,采用棉签(浸有碘伏)对腹腔进行擦拭,关闭腹腔,再次采用碘伏进行擦拭,采用红外理疗灯对大鼠进行2 h 复温,以大鼠出现大便、进食量明显减少,萎靡、懒动、腹前明显较前膨隆为建模成功,最终建模成功24 只,将其分为模型组、上调组、下调组各8 只。
1.2.3 MAPK 转染上调组、下调组大鼠胃组织中分别注射10 μL MAPK 过表达慢病毒悬液、MAPK 沉默慢病毒悬液,同剂量的蒸馏水灌注于空白组、模型组大鼠胃中,24 h 后对大鼠变化进行观察。
1.3 指标检测样本采集:于MAPK 转染后,将所有大鼠麻醉后处死,获得大鼠小肠组织,经脱水、透明、石蜡包埋后制成小肠标本,-80 ℃保存。
1.3.1 一般情况观察于建模后MAPK 转染前,对空白组大鼠、建模大鼠活动度、饮食、进水、排尿情况、皮毛光泽度、精神状况进行观察记录。
1.3.2 病理学观察MAPK 转染后,取大鼠的小肠组织,经脱水、石蜡包埋等处理后,行HE 染色,光镜下观察,图片拍摄,分析病理形态变化。
1.3.3 MAPK 转染效率鉴定和TLR4、Myd88、NF-κB 表达量检测于MAPK 转染后,取出大鼠小肠组织,实时荧光定量法测定MAPK 转染效率和TLR4、Myd88 及NF-κB 的表达量,提取小肠组织总RNA,通过Takara 逆转录试剂盒逆转录小肠组织中的RNA 为cDNA,Primer 5.0 软件设计引物序列,反应体系为:1 μL cDNA 模板、3.4 μL dH2O 混合,加蒸馏水至20 μL。反应条件为:95 ℃ 2 min、95 ℃ 15 s、60 ℃ 2 min,共进行40 个循环,采用2-△△Ct方法计算出MAPK、TLR4、Myd88、NF-κB 表达量,内参基因为GAPDH。
1.3.4 检测胃肠功能指标水平MAPK 转染后,取大鼠小肠组织,加入组织蛋白抽离液(1∶10),充分碾碎,离心15 min(离心半径、转速别为3 cm、3 000 r/min),获得上清液,保存待测于-80 ℃超低温冰箱中,通过免疫放射法对各组大鼠MOT、VIP、GAS 水平进行检测。
1.3.5 检测炎性因子指标水平MAPK 转染后,取大鼠小肠组织,加入组织蛋白抽离液(1∶10),充分碾碎,离心15 min(离心半径、转速别为3 cm、3 000 r/min),获得上清液,保存待测于-80 ℃超低温冰箱中,通过酶联免疫吸附(ELISA)法对各组大鼠肿瘤坏死因子α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-4(IL-4)、白细胞介素-10(IL-10)水平进行检测。孔中加入将待测样品10 μL 与稀释液40 μL,摇晃均匀后在孔中加入100 μL 酶标试剂后封板,之后孵育60 min(37 ℃),弃去孔中液体,进行重复清洗,清洗采用Wash Sohltion,完成后加50 μL 显色剂,摇晃均匀后在37 ℃下进行显色处理15 min 后终止反应,在450 nm 波长下检测OD值,查出TNF-α、IL-6、IL-4、IL-10 水平。
1.3.6 检测TLR4/Myd88/NF-κB 信号通路蛋白相对表达量通过Western blot 对小肠组织中的TLR4、Myd88 及NF-κB 蛋白相对表达量进行检测,裂解30 min 后,取上清液,检测BCA 蛋白定性,将样品上样至凝胶上,电泳,转移至PVDF 膜上,PBS封闭,羊抗鼠TLR4、Myd88 及NF-κB 一抗采用TBST 稀释,比例为1∶2 500,4 ℃ 孵育过夜,洗膜3 次,加入羊抗鼠二抗(1∶10 000),1 h 温室孵育,做TBST 洗膜3 次,GAPDH 为内参照,定量分析TLR4、Myd88 和NF-κB 蛋白表达情况,试验重复3 次。
1.4 统计学方法采用SPSS 20.0 统计学软件进行处理。计量资料采用均数±标准差表示,多组间比较采用方差齐性检验,多个均数间的两两比较采用SNK-q检验或Bonfferonit检验,P< 0.05 为差异有统计学意义。
2 结果
2.1 一般情况观察空白组大鼠皮毛顺滑、饮食正常,无腹胀、活动度正常、精力充沛、排便无异常,建模大鼠精神萎靡、活动度减少、排便减少、毛皮欠光泽、饮食量减少。
2.2 病理学特征见图1,空白组大鼠小肠无炎症,结构排列整齐;模型组大鼠炎性细胞、淋巴细胞增多,杯状细胞减少或消失,小肠绒毛上皮结构破坏、脱落、坏死,界限不清;上调组大鼠炎性细胞、淋巴细胞增多明显,小肠绒毛上皮结构严重破坏,界限不清;下调组大鼠炎性细胞浸润减轻,但小肠绒毛上皮仍有脱落、坏死。

图1 病理特征比较(HE,×200)Fig.1 Comparison of pathological features (HE, ×200)
2.3 MAPK 转染效率鉴定与空白组比较,模型组、上调组、下调组MAPK 表达量升高(P< 0.05);与模型组比较,上调组MAPK 表达量升高,下调组MAPK 表达量下降(P< 0.05);与上调组比较,下调组MAPK 表达量下降(P< 0.05),以上差异均有统计学意义,说明转染成功。见表1。
表1 MAPK 转染效率的鉴定Tab.1 Identification of MAPK transfection efficiency ±s

表1 MAPK 转染效率的鉴定Tab.1 Identification of MAPK transfection efficiency ±s
注:与空白组相比,aP < 0.05;与模型组相比,bP < 0.05;与上调组相比,cP < 0.05
MAPK表达量1.40 ± 0.17 2.23 ± 0.35a 2.69 ± 0.39ab 1.65 ± 0.17abc 2.941 0.011组别空白组模型组上调组下调组F值P值例数8888
2.4 各组大鼠胃肠功能指标水平对比与空白组比较,模型组、上调组、下调组MOT 水平下降,VIP、GAS 水平升高;与模型组比较,上调组MOT水平下降,VIP、GAS 水平升高,下调组MOT 水平升高,VIP、GAS 水平下降;与上调组比较,下调组MOT 水平升高,VIP、GAS 水平下降,以上差异均有统计学意义(P< 0.05)。见表2。
表2 各组大鼠胃肠功能指标水平对比Tab.2 Comparison of gastrointestinal function indexes of rats in each group ±s

表2 各组大鼠胃肠功能指标水平对比Tab.2 Comparison of gastrointestinal function indexes of rats in each group ±s
注:与空白组相比,aP < 0.05;与模型组相比,bP < 0.05;与上调组相比,cP < 0.05
GAS(ng/L)40.29 ± 4.21 79.42 ± 7.36a 87.55 ± 9.01ab 50.36 ± 6.45abc 3.698 0.002组别空白组模型组上调组下调组F值P值例数8888 MOT(ng/L)100.69 ± 20.37 60.88 ± 15.73a 52.83 ± 11.39ab 76.89 ± 17.05abc 2.534 0.024 VIP(pg/L)50.29 ± 5.01 80.77 ± 10.68a 86.35 ± 11.09ab 62.85 ± 6.14abc 4.483 0.001
2.5 各组大鼠炎性因子水平对比与空白组比较,模型组、上调组、下调组TNF-α、IL-6 水平升高,IL-4、IL-10 水平下降;与模型组比较,上调组TNF-α、IL-6 水平升高,IL-4、IL-10 水平下降,下调组TNF-α、IL-6 水平下降,IL-4、IL-10 水平升高;与上调组相比,下调组TNF-α、IL-6 水平下降,IL-4、IL-10 水平升高,以上差异均有统计学意义(P<0.05)。见表3。
表3 各组大鼠炎性因子水平对比Tab.3 Comparison of inflammatory factors in each group ±s
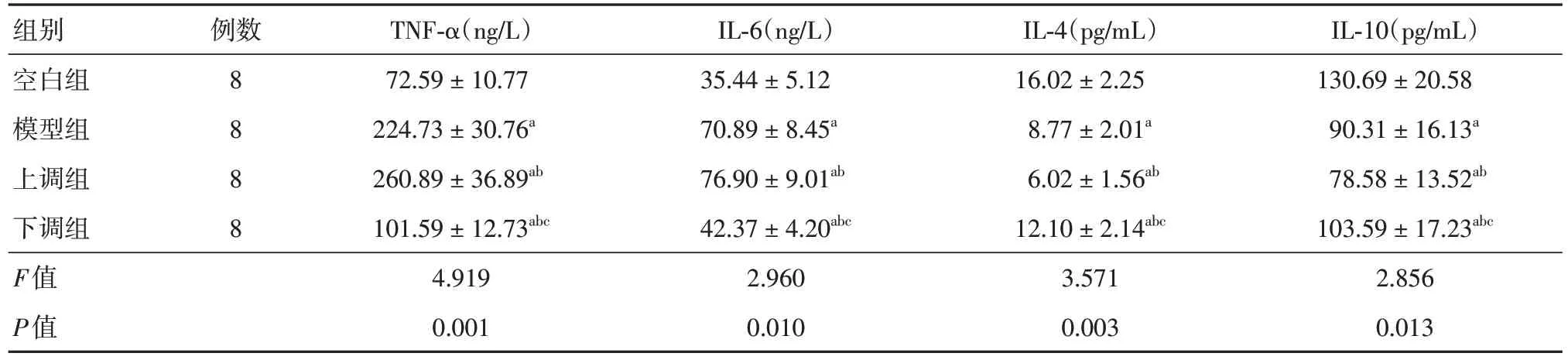
表3 各组大鼠炎性因子水平对比Tab.3 Comparison of inflammatory factors in each group ±s
注:与空白组相比,aP < 0.05;与模型组相比,bP < 0.05;与上调组相比,cP < 0.05
组别空白组模型组上调组下调组F值P值IL-10(pg/mL)130.69 ± 20.58 90.31 ± 16.13a 78.58 ± 13.52ab 103.59 ± 17.23abc 2.856 0.013例数8888 TNF-α(ng/L)72.59 ± 10.77 224.73 ± 30.76a 260.89 ± 36.89ab 101.59 ± 12.73abc 4.919 0.001 IL-6(ng/L)35.44 ± 5.12 70.89 ± 8.45a 76.90 ± 9.01ab 42.37 ± 4.20abc 2.960 0.010 IL-4(pg/mL)16.02 ± 2.25 8.77 ± 2.01a 6.02 ± 1.56ab 12.10 ± 2.14abc 3.571 0.003
2.6 各组大鼠TLR4、Myd88、NF-κB mRNA 表达量与空白组比较,模型组、上调组、下调组TLR4、Myd88、NF-κB mRNA 表达量升高;与模型组相比,上调组TLR4、Myd88、NF-κB mRNA 表达量升高,下调组TLR4、Myd88、NF-κB mRNA 表达量下降;与上调组相比,下调组TLR4、Myd88、NF-κB mRNA 表达量下降,以上差异均有统计学意义(P< 0.05)。见表4。
表4 各组大鼠TLR4、Myd88、NF-κB mRNA 表达量Tab.4 Expression levels of TLR4, Myd88 and NF-κB mRNA in rats of each group ±s

表4 各组大鼠TLR4、Myd88、NF-κB mRNA 表达量Tab.4 Expression levels of TLR4, Myd88 and NF-κB mRNA in rats of each group ±s
注:与空白组相比,aP < 0.05;与模型组相比,bP < 0.05;与上调组相比,cP < 0.05
NF-κB 1.00 ± 0.01 1.55 ± 0.17a 1.92 ± 0.19ab 1.18 ± 0.11abc 4.609 0.001组别空白组模型组上调组下调组F值P值例数8888 TLR4 1.00 ± 0.01 1.46 ± 0.12a 1.70 ± 0.15ab 1.21 ± 0.10abc 5.910 0.001 Myd88 1.00 ± 0.01 1.53 ± 0.16a 1.90 ± 0.20ab 1.20 ± 0.13abc 4.339 0.001
2.7 各组大鼠TLR4/Myd88/NF-κB 信号通路相关蛋白相对表达量与空白组比较,模型组、上调组、下调组TLR4、Myd88、NF-κB mRNA 相对表达量升高;与模型组比较,上调组TLR4、Myd88、NFκB mRNA 相对表达量升高,下调组TLR4、Myd88、NF-κB mRNA 相对表达量下降;与上调组比较,下调组TLR4、Myd88、NF-κB mRNA 相对表达量下降,以上差异均有统计学意义(P< 0.05)。见表5和图2。
表5 各组大鼠TLR4/Myd88/NF-κB 信号通路相关蛋白相对表达量Tab.5 Relative expression levels of TLR4/Myd88/NF-κB signaling pathway related proteins in rats of each group ±s

表5 各组大鼠TLR4/Myd88/NF-κB 信号通路相关蛋白相对表达量Tab.5 Relative expression levels of TLR4/Myd88/NF-κB signaling pathway related proteins in rats of each group ±s
注:与空白组相比,aP<0.05;与模型组相比,bP<0.05;与上调组相比,cP<0.05
NF-κB 1.00 ± 0.01 1.59 ± 0.20a 1.99 ± 0.22ab 1.25 ± 0.13abc 5.423 0.001组别空白组模型组上调组下调组F值P值例数8888 TLR4 1.00 ± 0.01 1.55 ± 0.13a 1.79 ± 0.17ab 1.23 ± 0.12abc 5.402 0.001 Myd88 1.00 ± 0.01 1.60 ± 0.18a 1.98 ± 0.20ab 1.21 ± 0.13abc 4.556 0.001

图2 TLR4/Myd88/NF-κB 信号通路蛋白Western blot 图Fig.2 Western blot map of TLR4/Myd88/NF-κB signaling pathway protein
3 讨论
妊娠期肠梗阻的发生与肠套叠、肠粘连、疝、肠扭转等因素存在联系,临床多表现为呕吐、肠内容物无法排出、腹痛等,可对患者排气、排便造成不利影响,严重情况下可引发肠绞窄、肠穿孔等,进而对母婴健康构成了严重威胁,目前临床主要通过X 线对肠梗阻进行诊断,但因电离辐射对胎儿具有一定的损害,因此诊断难度较大,继而造成了治疗延误。
MAPK 在炎症介质调控中发挥着重要作用,可经JNK、p38MAPK、ERK1/2 等途径促进炎症细胞因子的生成,进而引发或加剧炎症反应。本研究发现,妊娠期肠梗阻大鼠经下调MAPK 干预后胃肠功能增强,炎性反应缓解,症状改善,提示下调MAPK 可抑制妊娠期肠梗阻病情进展。有研究[6]表明,在肠道屏障损伤、溃疡性结肠炎等疾病中MAPK 均呈异常表达,高表达的MAPK 可诱发细胞的炎症反应,进而增加了肠道的炎性细胞浸润,加重了肠道炎症,故抑制MAPK 表达可预防或减轻肠梗阻炎症反应,进而改善其临床症状,其结果与本研究结果相似。
肠道疾病发生、发展过程中MOT、VIP、GAS 发挥着重要作用,上述指标可对胃肠道功能进行反映[7]。本研究发现,妊娠期肠梗阻大鼠经下调MAPK 干预后MOT、IL-4、IL-10 水平上升,VIP、GAS、TNF-α、IL-6 水平下降,表明下调MAPK 对妊娠期肠梗阻胃肠功能具有改善作用,且可缓解炎性反应。有关研究[8-10]发现,MOT 可参与小肠分节活动、胃强力收缩、胃肠道水电解质运输、胃肠运动的胃肠激素,其水平上升对胃肠道蠕动具有促进作用,进而加速了肠内容物通过;VIP 主要在结肠、十二指肠中存在,对胃蛋白酶、胃酸分泌具有抑制作用,且可松弛胃底平滑肌,最终抑制性调控了胃肠活动;GAS 是可参与胃窦及胃体收缩、胃肠道运动的G 细胞分泌产物,其表达水平与胃肠道功能障碍呈正相关。另有研究[11-12]表明,TNF-α 是由细菌产物及脂多糖活化巨噬细胞后分泌的细胞因子,可加重炎症反应活性,IL-6 是可引发或加重器官炎症反应的免疫调节活性细胞因子,TNF-α、IL-6 水平升高可造成肠粘连、肠黏膜损伤;IL-4、IL-10 均是具有免疫调节、免疫抑制、抗炎等作用的Th2 细胞因子,对巨噬、嗜酸、中性粒细胞产生炎性因子具有抑制作用,可减轻肠黏膜炎症反应,缓解组织损伤,进而对组织修复、重建起到了有利作用。
TLR4/Myd88/NF-κB 信号通路可促使细胞炎症反应[13-15]。有研究[16]表明,阻断TLR4 的表达可抑制炎症反应和并发症,其中Myd88 为重要的链接蛋白因子,能够对TLR4/Myd88/NF-κB 信号分子下游转导进行识别,进而激活NF-κB,激活后的NF-κB 可显著提升TNF-α、IL-6 等炎性因子表达,进而引发细胞功能紊乱,对肠黏膜屏障完整性造成破坏。本研究发现,下调MAPK 干预后妊娠期肠梗阻大鼠TLR4/Myd88/NF-κB 表达量降低,提示下调MAPK 可通过调节TLR4/Myd88/NF-κB 信号通路抑制炎症因子表达,缓解胃肠功能障碍。刘继攀等[17]研究表明,MAPK 可引发一系列连锁反应,可活化核转录因子、激活肥大及巨噬细胞,进而促进了IL-1、TNF-α、IL-6 等趋化、促炎细胞因子释放,激活了TLR4/Myd88/NF-κB 信号通路,经下调MAPK 可抑制TLR4/Myd88/NF-κB 信号通路,减轻炎症反应,进而缓解了肠组织缺血损害,对肠屏障功能起到了有效保护作用,与本研究结果相同。
综上所述,本研究结果显示妊娠期肠梗阻发生后伴随着MOT 水平的下降,VIP、GAS、TNF-α、IL-6 水平的升高等表现,经下调MAPK 后,炎性反应得到抑制,胃肠功能改善,其机制可能与TLR4/Myd88/NF-κB 通路得到抑制有关,但本研究就仍具有局限性,例如研究指标较少且未分析MAPK在其他通路中的作用机制,因此需后续多角度、多方位、多指标研究探究,为临床妊娠期肠梗阻的靶向治疗提供依据。
【Author contributions】GAO Fei performed the experiments and wrote the article.LI Jing performed the experiments. LI Hongjian revised the article. All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
