K-ras基因突变与胃癌组织病理特征及预后的相关性分析
2024-04-24李照强田小豆
李照强 田小豆
(1.铜川市人民医院病理科,陕西 铜川 727031;2.靖边县人民医院内科,陕西 靖边 718500)
胃癌是非常常见的消化系统恶性肿瘤疾病之一,在我国的发病率逐年上升,严重威胁着居民的生活质量[1]。由于各种因素的影响,当前胃癌患者的早期诊断率比较低,很多患者在就诊时已处于中晚期,失去了手术治疗指征,即使采用手术治疗患者的复发率也比较高,因此寻找分子靶向治疗途经成为胃癌研究的热点[2]。影像学为胃癌的主要诊断方法,但是具有一定的主观性,为此在临床上多采用病理检查与分子生物学检查具有重要价值[3]。现代研究表明胃癌的演进是一个由良性到恶性逐步演变的过程,经历的时间比较长,也为早期诊断提供了基础[4];细胞生长与分化信号途经在胃癌的发生与发展中发挥重要作用,K-RAS基因编码的p21-ras蛋白就为上述信号突进的重要因子之一,K-RAS基因突变可造成K-RAS基因激活[5]。K-RAS基因突变主要发生于外显子5-6、外显子7-8、外显子8上,K-RAS基因突变可促进肿瘤细胞增殖,抑制肿瘤细胞凋亡[6]。本文旨在探讨K-ras基因突变与胃癌组织病理特征及预后的相关性,现报告如下。
1 资料与方法
1.1 一般资料选取2018年1月至2023年1月到我院就诊的100例胃癌患者作为胃癌组,同期选择在本院体检的健康人群100例作为对照组。胃癌组男55例,女45例;年龄(56.39±4.48)岁;心率(78.69±3.96)次/分;体质量指数(21.10±1.59)kg/m2;收缩压(125.88±10.13)mmHg,舒张压(76.69±2.68)mmHg。对照组男52例,女48例;年龄(56.92±5.09)岁;心率(78.92±4.10)次/分;体质量指数(21.33±1.48)kg/m2;收缩压(125.68±10.87)mmHg,舒张压(76.79±4.15)mmHg。在胃癌组患者中,淋巴结转移28例;病灶直径<5 cm 54例,≥5 cm 46例;组织学分化:低分化63例,中高分化37例;临床分期:Ⅰ期与Ⅱ期58例,Ⅲ期与Ⅳ期42例。纳入标准:(1)胃癌组为初发胃癌患者,手术病理诊断明确为胃癌,采样前未给予任何化疗、免疫与生物靶向治疗等;(2)年龄35~75岁;临床资料完整。排除标准:(1)组织病理学不够明确的患者;(2)妊娠孕妇与哺乳期妇女;(3)精神疾病患者;(4)合并其他部位肿瘤者;(5)合并凝血功能障碍者;(6)复发胃癌患者。两组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 K-ras基因突变检测抽取所有患者的外周静脉血5 mL,肝素抗凝30 min后,以3 000 rpm/min离心10 min,取下层血液组织,提取总DNA后,应用特异的PCR引物扩增K-ras基因的外显子5-6、外显子7-8、外显子8,扩增后进行测序分析,判定K-ras基因突变状况。
1.2.2 调查分析调阅胃癌患者的病史,通过查阅随访资料和电话等方式对患者展开随访,详细记录患者病理特征。随访患者到2023年4月1日,记录与观察患者的预后生存与死亡情况。

2 结 果
2.1 K-ras基因突变率对比胃癌组基因突变情况:外显子5-6有16例,外显子7-8有18例,外显子8有13例,突变率为49.0%;对照组基因突变情况:外显子5-6有2例,外显子7-8有1例,外显子8有2例,突变率为5.0%。胃癌组的K-ras基因突变率显著高于对照组(χ2=49.112,P<0.05)。
2.2 不同胃癌组织病理特征患者的K-ras基因突变率对比在胃癌组中,不同胃癌组织病理特征(病灶直径、组织学分化、临床分期、淋巴结转移)患者的K-ras基因突变率对比差异均有统计学意义(P<0.05)。见表1。
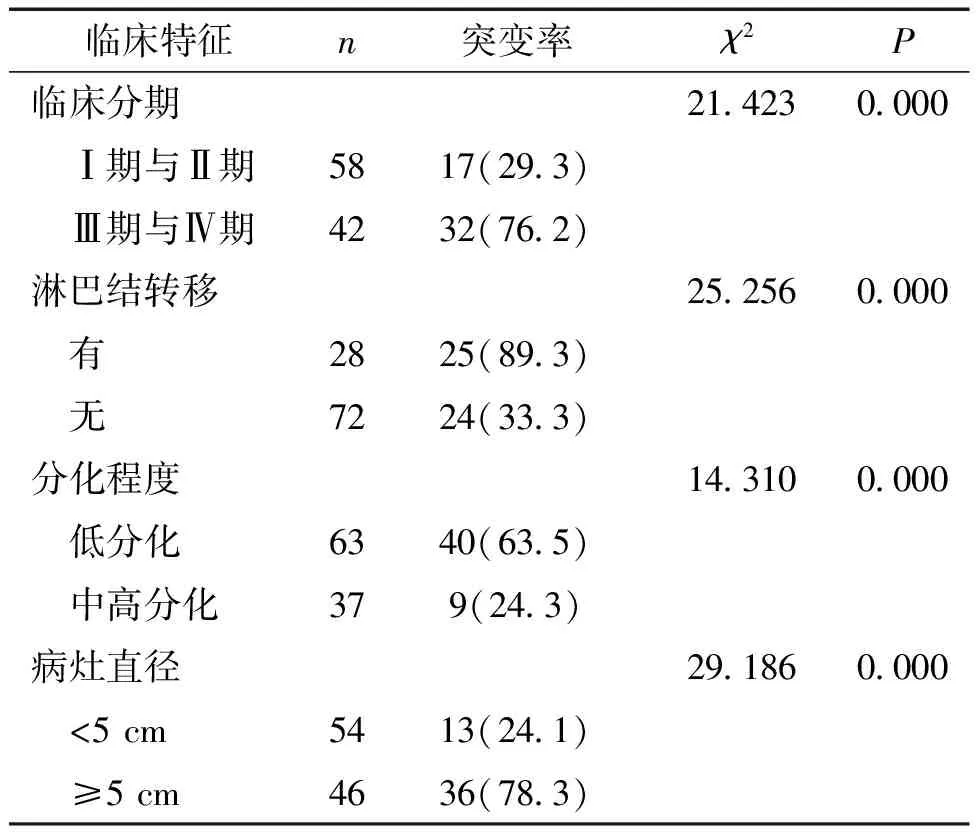
表1 不同胃癌组织病理特征患者的K-ras基因突变率对比[n(%),N=100]
2.3 不同胃癌预后患者的K-ras基因突变率对比胃癌患者随访到2023年4月1日,平均随访(35.59±1.19)月,其中死亡18例。死亡患者的K-ras基因突变率为88.9%(16/18),显著高于生存患者的40.2%(33/82)(χ2=13.976,P<0.05)。
2.4 相关性分析在胃癌组中,Spearman分析显示K-ras基因突变率与病灶直径、组织学分化、临床分期、淋巴结转移、预后死亡等存在正相关性(r=0.633、0.597、0.697、0.577、0.615,P<0.05)。
3 讨 论
K-ras基因是RAS基因家族的一员,可编码K-RAS蛋白,可调节EGFR的信号转导给MAPKs,进而调控肿瘤细胞的增殖与生长,还可调节肿瘤的血管生成[7]。当K-ras基因处于相对静止状态,当受到内外在各种因素的刺激下,K-ras基因发生突变可导致细胞恶性生长,促进肿瘤发生发展[8]。本文结果显示,胃癌组的K-ras基因突变率显著高于对照组(P<0.05);在胃癌组中,不同胃癌组织病理特征(病灶直径、组织学分化、临床分期、淋巴结转移)患者的K-ras基因突变率对比差异均有统计学意义(P<0.05),表明胃癌患者多伴随有血清K-ras基因基因突变。从机制上分析,K-ras基因突变可导致细胞大量增殖和恶化,可导致肿瘤细胞的细胞周期发生阻滞,抑制肿瘤细胞凋亡。当前有研究[9]显示K-ras基因突变与胃癌淋巴结转移、肿瘤分期等密切相关,可导致肿瘤细胞大量增殖和恶性转化。
K-ras基因的突变状态和靶向表皮生长因子受体单克隆抗体的治疗效果相关,K-ras基因突变的患者,治疗预后比较差。本文结果显示,胃癌患者随访到2023年4月1日,平均随访时间(35.59±1.19)月,死亡18例,死亡患者的K-ras基因突变率为88.9%,显著高于生存患者的40.2%(P<0.05),表明胃癌死亡患者的K-ras基因突变率更高。
K-ras基因突变是胃肠道肿瘤的一个重要的分子标志,对胃癌的诊断、病理判断具有重要价值。本研究Spearman分析显示胃癌患者的K-ras基因突变率与病灶直径、组织学分化、临床分期、淋巴结转移、预后死亡等存在正相关性(P<0.05)。从机制上分析,胃癌的癌变过程是多基因、多步骤相互作用的过程,原癌基因激活、抑癌基因失活在胃癌的发生中发挥重要作用。K-ras基因突变可以提升肿瘤细胞的侵袭能力,可导致患者病情恶化[10]。然而本研究也存在缺陷,没有进行组织K-ras基因突变检测,也没有纳入良性肿瘤患者进行分析,将在下一步进行深入分析。
利益冲突说明/Conflict of Intetests
所有作者声明不存在利益冲突。
伦理批准及知情同意/Ethics Approval and Patient Consent
本研究通过铜川市人民医院医学伦理委员会批准,患者均知情同意。
