谷胱甘肽过氧化酶4在胃肠道肿瘤中的作用与治疗
2024-04-23陈雅茹贾彦彬
陈雅茹, 高 芳, 贾彦彬*
(1)包头医学院基础医学与法医学院, 内蒙古 包头 014040;2)包头医学院医学技术与麻醉学院, 内蒙古 包头 014040)
2021年全球癌症统计数据显示,我国恶性肿瘤发病和死亡数持续上升。2020年我国发病率前3的癌症为:肺癌、结直肠癌和胃癌。死亡率前3的癌症为:肺癌、肝癌和胃癌。其中,胃肠道肿瘤的发病率为22.7%,死亡率为21.9%[1]。只有提前预防加有效治疗双管齐下,才能更好地降低癌症负担,因此,需要深入研究胃肠道肿瘤的分子机制和可能潜在的生物标志物及药物靶点。
铁死亡是一种铁依赖的,区别于细胞凋亡、坏死、自噬的细胞程序性死亡方式,与肿瘤的发生发展和耐药密切相关。谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)是铁死亡核心因子之一,其主要作用是抵抗细胞磷脂过氧化,进而抵御铁死亡。GPX4在胃肠道肿瘤中表达异常,并参与癌症相关基因及药物调控肿瘤发生发展的过程。本文就触发铁死亡的间接靶点——GPX4在胃肠道肿瘤中的研究进展进行详细阐述,为胃肠道肿瘤的研究提供新的参考方向。
1 铁死亡概述
铁死亡受磷脂过氧化驱动,其过程主要表现为膜结构脂质过氧化损伤,进而导致细胞的完整性破坏并崩解死亡。铁死亡有两大系统:氧化系统和抗氧化系统。氧化系统由磷脂过氧化引起,无限制的脂质过氧化激活铁死亡。简而言之,在细胞内外信号或环境压力下,细胞代谢发生改变,产生活性氧(reactive oxygen species,ROS)、过渡金属铁和含有多不饱和脂肪酸链的磷脂,进而触发脂质过氧化,生成磷脂氢过氧化物(phospholipid hydroperoxides,PLOOHs)。当细胞内产生的PLOOHs大于阈值时,其会作为执行者使细胞发生铁死亡。抗氧化系统包括3条通路:经典的由GPX4介导的通路、独立于GPX4调控铁死亡的铁死亡抑制蛋白1(ferroptosis suppressor protein 1,FSP1)通路、以及GTP环化水解酶1(GTP cyclohydrolase-1,GCH1)通路。抗氧化系统执行抵抗铁死亡的命令,因此,铁死亡受氧化系统和抗氧化系统的平衡调节[2]。
许多肿瘤抑制因子能使细胞发生铁死亡,例如p53和乳腺癌Ⅰ型易感性蛋白相关蛋白1(breast cancer type 1 susceptibility protein associated protein 1,BAP1)[3,4],铁死亡能促进这些肿瘤抑制因子的抗肿瘤活性[5],提示肿瘤抑制是铁死亡重要的生理功能[2]。诱导肿瘤细胞铁死亡对于癌症治疗表现出巨大的潜力。在癌症治疗中,特别是对传统疗法耐药的侵袭性恶性肿瘤,更容易触发铁死亡[6],例如间充质癌细胞和去分化癌细胞通常对凋亡和常规治疗手段具有抵抗力,但对铁死亡诱导剂敏感,提示诱导肿瘤细胞铁死亡可能是治疗肿瘤耐药的一个新方向。
2 谷胱甘肽过氧化酶4
GPX4是铁死亡抗氧化系统的中心成员,其介导的经典通路由半胱氨酸(cysteine,Cys)、谷胱甘肽(glutathione,GSH)和GPX4组成,即Cys-GSH-GPX4通路。Cys是合成GSH的限速底物,且Cys的巯基作为GSH的活性基团。GSH本身是一种抗氧化剂,又是GPX4的辅因子。这一系统还包括细胞膜上胱氨酸/谷氨酸反向转运体(cystine/glutamate antiporter,System Xc-),此系统由溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)的催化亚基和溶质载体家族3成员2(solute carrier family 3 member 2,SLC3A2)调节亚基组成[7]。Xc-系统以1∶1的比例将谷氨酸运送到细胞外,将胱氨酸运送到细胞内。在氧化应激条件下,由Xc-系统转运进来的胱氨酸被还原为Cys,并参与GSH的合成。合成的GSH被GPX4氧化为氧化形式的谷胱甘肽,同时,GPX4可以将PLOOHs还原为对应的羟基脂(PLOH),从而抵抗铁死亡。已有研究表明,抑制Xc-/GSH/GPX4轴中的关键分子是治疗耐药性实体瘤的一种新的有效方法[8]。
硒蛋白是微量元素硒实现生理功能的关键生物分子,GPX4是人类25种专用硒蛋白之一,属于谷胱甘肽过氧化物酶系(GPX)。GPX4功能和活性的关键是硒作为硒代半胱氨酸残基掺入GPX4的催化中心。GPX4在多种肿瘤细胞及组织中高表达,与肿瘤的不良生物学行为相关[6]。GPX4高表达有利于肿瘤细胞应对氧化应激,增强增殖能力,进而抵抗铁死亡,促进肿瘤的发展。研究证实,铁死亡的内在机制取决于GPX4的活性和脂质过氧化,目前,至少已经开发了四类铁死亡诱导剂,包括Xc-系统抑制剂(erastin)、GPX4抑制剂(RSL3)、FIN56(消耗GPX4蛋白)和FINO2(间接抑制GPX4)[9]。其中,一些GPX4抑制剂已被证实可以促进耐药性肿瘤细胞发生铁死亡[6]。有研究认为,无论上游基因如何,GPX4都是铁死亡的主要靶点,是调节铁死亡的关键末端效应器[10]。由此可见,靶向作用于GPX4从而诱导肿瘤细胞铁死亡的重要性,这将为耐药性肿瘤细胞的治疗提供有力的策略。
3 谷胱甘肽过氧化酶4与胃肠道肿瘤
GPX4作为铁死亡重要的靶点之一,与胃肠道肿瘤的发生发展、治疗及耐药密切相关。针对胃肠道肿瘤中GPX4的调节,最近开发了用于胃肠道肿瘤治疗的GPX4抑制剂,例如小分子化合物、纳米反应器和药物等(Table 1),以GPX4为靶点的策略有望成为治疗胃肠道肿瘤的新途径。

Table 1 Novel drugs for ferroptosis in gastrointestinal tumors
3.1 GPX4与胃癌
胃癌(gastric cancer,GC)是一种高致死性的恶性肿瘤,与幽门螺杆菌感染、吸烟、遗传、人口老龄化等因素紧密相关,早期的诊断和治疗可以增加GC患者生存和康复的机会。GPX4在GC中表达异常,并受到多种信号通路和相关因子的调控(Fig.1),进而直接或间接调节GC中铁死亡的发生。抑制GPX4的表达有助于提升GC患者化疗的药物敏感性,以GPX4为枢纽调控铁死亡的靶点与通路将会是GC有前景的治疗策略。
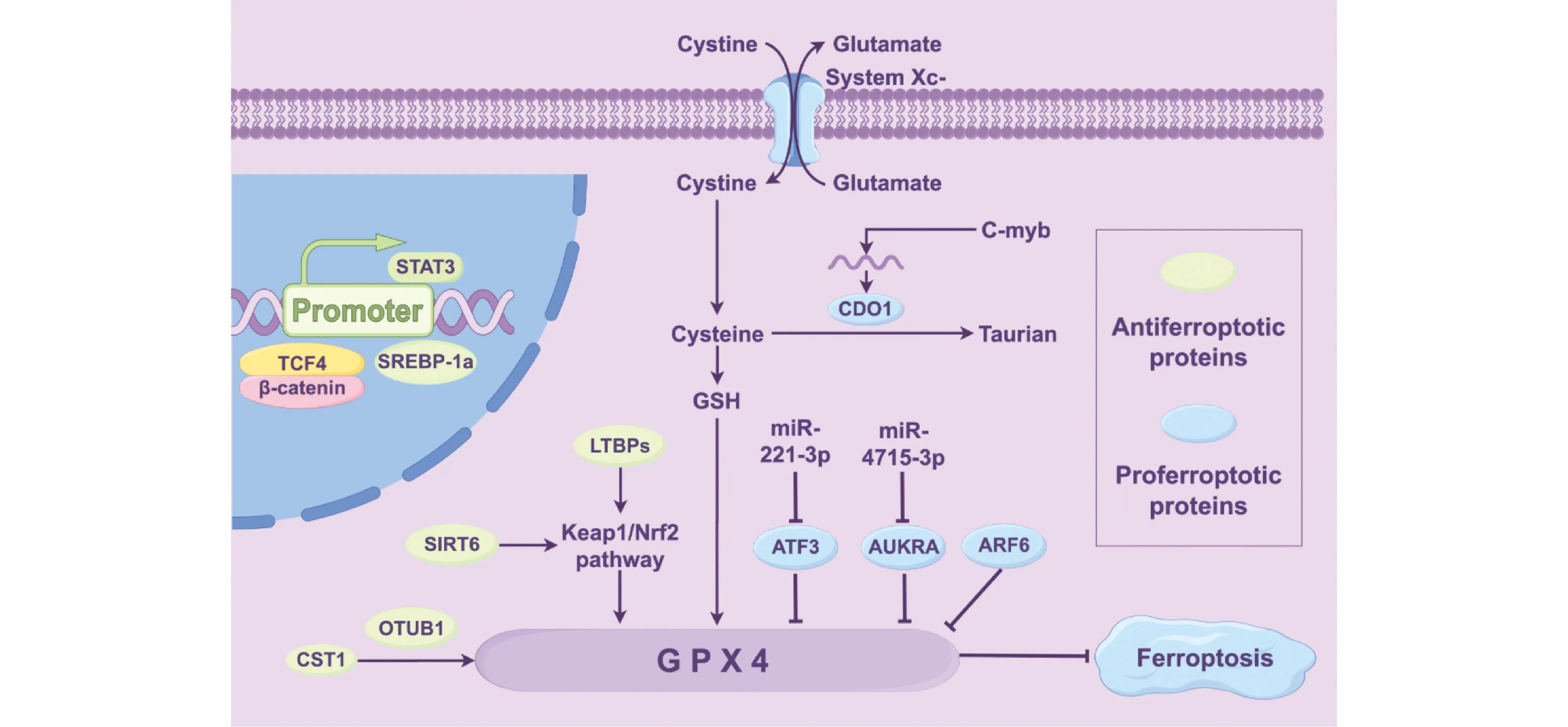
Fig.1 The main regulation of GPX4 in GC
3.1.1 GPX4在GC中的表达 王首寒等[11]在Oncomine和基因表达谱动态分析(gene expression profiling interactive analysis,GEPIA)数据库中分析表明,GPX4 mRNA在GC组织中明显高表达,且与患者不良的总生存(overall survival,OS)率密切相关。Hu等[12]利用TIMER数据库发现,GC中GPX4 mRNA升高,免疫组化结果显示,GPX4蛋白质水平上升。而Ye等[13]利用Kaplan-Meier 绘图仪发现,只有在GC患者临床Ⅲ期后,GPX4 mRNA表达上调才与OS显著相关,但GPX4表达的增加对GC患者的预后未见显著影响。然而,Lan等[14]利用qRT-PCR方法,研究40例GC患者中硒蛋白在GC中的表达情况时发现,GPX4 mRNA呈低表达水平。Zhao等[15]利用免疫组化染色发现,在89例GC患者中GPX4蛋白呈低表达状态,并与不良预后有关。目前,有关GPX4 在GC中的相关研究报道较少,且由于个体研究样本量的局限性及研究方法不同,所得的结论一致性不高。因此,GPX4在GC中的表达情况仍需扩大样本量,并用多种方法研究以得出确切的结果。
3.1.2 GPX4在GC中的调控机制 GPX4-MPND融合基因是GC中发现的一个新的分子事件,此融合基因能够促进GC细胞的增殖和侵袭能力[16]。半胱氨酸双加氧酶1(cysteine dioxygenase 1,CDO1) 可以将Cys转化为牛磺酸(taurian),从而竞争性地掠夺细胞用于合成GSH的Cys。而转录因子c-Myb可以与CDO1的启动子相互作用,抑制CDO1的表达。当CDO1表达受到抑制时,GSH向牛磺酸的转化减少,GSH生成增多,GPX4活性得到促进,导致GC细胞抵抗铁死亡[17]。Ouyang等[18]发现,信号转导子和转录激活子3(signal transducer and activator of transcription 3,STAT3)能与GPX4基因启动子中的共有应答元件结合并上调其表达,进而增加GC的化疗耐药性,靶向STAT3为晚期GC和化疗耐药提供了一种新的治疗策略。此外,下调ADP核糖基化因子6(ADP ribosylation factor 6,ARF6)的表达可以增强 GPX4的表达,并减弱erastin诱导GC细胞铁死亡[19]。半胱氨酸蛋白酶抑制剂SN(cystatin SN,CTS1)能通过招募去泛素化酶OTUB1来缓解GPX4的泛素化修饰,增强GPX4的稳定性,进而抑制铁死亡并促进GC细胞的转移[20]。最近还发现,下调miR-221-3p的表达时其下游激活转录因子3(activating transcription factor 3,ATF3)在GC中被上调,ATF3的上调可通过抑制GPX4的表达促进GC细胞铁死亡,并显著减弱小鼠GC细胞的生长[21]。Gomaa等[22]发现,下调miR-4715-3p可以促进极光激酶A(aurora kinase A,AURKA)的表达,AURKA可以显著下调GPX4的表达水平,并促进GC细胞的铁死亡,提示miRNA/GPX4轴可能也是GC治疗的重要靶点。
GPX4可参与GC细胞的多种信号通路。研究表明,多数GC患者中存在Wnt/β-catenin信号通路的失调[23],与GC的发展和化疗耐药性密切相关。Wang等[24]发现,转录因子TCF4可以作为Wnt/β-catenin信号通路的开关,并且与β-联环蛋白(β-catenin)结合形成转录复合物。TCF4/β-catenin可以与GPX4的启动子区结合并诱导其表达,抑制GC铁死亡。LF3是一种4-硫脲基-苯磺酰胺衍生物,可以强烈抑制β-联环蛋白和TCF4之间的相互作用[25]。利用LF3靶向抑制TCF4后,GPX4的表达降低,并且在体内外显著增强了GC对顺铂的敏感性。提示靶向Wnt/β-catenin/TCF4/GPX4在治疗GC中的潜在策略。此外,该研究还发现感染幽门螺杆菌的GC细胞中TCF4和GPX4 的表达水平上升,缺乏TCF4时GPX4的表达下调,说明幽门螺杆菌通过TCF4上调GPX4的表达和活性,从而导致GC的高抗氧化状态。因此,根除幽门螺杆菌有利于引发铁死亡,提高幽门螺杆菌阳性GC患者化疗的敏感性。沉默NAD依赖性脱乙酰酶6(sirtuins 6,SIRT6)可以抑制Keap1/Nrf2信号通路,并下调GPX4的表达,进而来克服索拉非尼的耐药性[26]。因此,SIRT6/ Keap1/Nrf2/GPX4轴的抑制可能是提高索拉非尼疗效的潜在策略。同样的,潜在转化生长因子β结合蛋白(latent transforming growth factor β binding proteins,LTBPs)以极为相似的方式通过p62/Keap1/Nrf2/GPX4轴调控GC细胞铁死亡[27]。沉默与SIRT6同家族的SIRT1可以上调p53的表达水平并下调GPX4的水平,进而促进GC铁死亡[28]。最新研究表明,B细胞淋巴瘤6(B-cell lymphoma 6,BCL6)的上调可在体外和体内显著抑制GC细胞的增殖和转移,其内在机制是由于BCL6可以通过FZD7/β-catenin/TP63/GPX4途径促进脂质过氧化,导致GC细胞铁死亡[29]。此外,GPX4还参与免疫相关途径,在GC肿瘤微环境中发现自然杀伤细胞(natural killer,NK)的浸润显著减少,导致GC细胞易发生免疫逃逸。Cui等[30]发现高表达GPX4会降低NK细胞生存能力,GC细胞也表现出耐药性,而敲除GPX4后则表现出显著的疗效,表明降低GPX4的表达可能是GC免疫治疗的潜在策略。
靶向诱导GC细胞铁死亡也是目前研究的热点。Zhang等[31]首次将生物活性化合物6-硫鸟嘌呤(6-thioguanine,6-TG)鉴定为GC细胞潜在的铁死亡诱导剂,6-TG可以使Xc-系统中的SLC7A11失活,阻断GSH的产生,下调GPX4的表达。Hu等[12]发现,小分子GPX4抑制剂—多酚B(polyphyllin B,PB)在GC细胞和小鼠模型中均显示出良好的抗肿瘤疗效,这是由于PB可以抑制GPX4的表达并促进GC铁死亡,惊喜的是该过程不会引起显著的宿主毒性,提示进一步研究更多毒性低的GPX4抑制剂对于GC的治疗是必不可少的。纳米颗粒(nanoparticles,NPs)诱导癌细胞铁死亡的新型治疗方法在GC中也被广泛研究。mPEG-PLG(DNs)自组装形成的纳米颗粒NP-DNs,可以通过消耗GSH和释放SO2下调GPX4的表达,从而触发GC细胞铁死亡[32]。Atranorin是一种地衣的次生代谢产物,根据Atranorin设计的超顺磁性氧化铁纳米颗粒(superparamagnetic iron oxide nanoparticles,SPION)复合物(Atranorin@SPION)可以减弱SLC7A11和GPX4 mRNA 3′ UTR的hm5C修饰水平,并降低二者的表达水平,进而引起GC干细胞铁死亡[33]。日本圆菊(Cirsiumjaponicum)是一种植物中草药,根据其合成的金纳米颗粒CJ-AuNPs可以通过靶向抑制GPX4,介导GC细胞铁死亡[34]。上述多项研究结果提示,GPX4可以作为纳米材料诱发铁死亡的有效靶点。
3.1.3 GPX4与药物 阿帕替尼(apatinib)是血管内皮生长因子受体-2(vascular endothelial growth factor receptor-2,VEGFR2)的竞争性抑制剂,转录因子类固醇调节元件结合蛋白1a(sterol regulatory element-binding protein-1a,SREBP-1a)可以通过结合GPX4启动子区激活GPX4的转录。阿帕替尼可以通过抑制SREBP-1a的表达而下调GPX4的表达,进而增强GC细胞铁死亡。值得注意的是,多耐药GC细胞更易受阿帕替尼诱导的GPX4抑制作用的影响[15],提示GPX4可能是阿帕替尼对GC疗效评估和治疗的潜在靶点。喻鑫等[35]发现,双硫仑(disulfiram,DSF)协同奥沙利铂(oxaliplation,Oxa)联合用药作用于GC细胞时,GPX4的mRNA表达水平明显下降,并通过时间和剂量依赖性协同抑制GC细胞增殖。
近几年,越来越多的研究表明,中药治疗肿瘤的潜在机制可能与铁死亡相关。如研究证实麦冬皂苷B(ophiopogonin B,OP-B)可通过阻断SLC7A11/GPX4通路在体内外触发GC细胞铁死亡[36]。猕猴桃根(actinidia chinensis planch,ACP)已被批准为一种在临床上广泛应用的抗肿瘤药物,研究发现,ACP可通过抑制GPX4诱导GC细胞铁死亡,斑马鱼异种移植物研究进一步在体内证实了这一结果[37]。黄芩苷可以通过抑制GPX4的表达,有效抑制GC细胞的增殖[38]。济源冬凌草甲(jiyuan oridonin A,JDA)是从中草药济源冬凌草中分离得到的一种天然化合物,其衍生物a2可以降低CRC中GPX4的表达,在异种移植小鼠模型中,a2表现出比5-氟尿嘧啶更强的抗癌活性[39]。扶正泥增汤(fuzheng nizeng decoction)可以降低GPX4/GSH水平,促进GC前病变细胞铁死亡,有助于GC的预防[40]。
3.2 GPX4与结直肠癌
结直肠癌(colorectal cancer,CRC)是世界上第三大常见恶性肿瘤[41],发病率呈不断上升趋势。饮食、环境及肠道菌群等因素与CRC密切相关[42]。CRC的特征是频繁突变的基因,例如TP53和Kirsten大鼠肉瘤病毒癌基因同源物(kirsten rat sarcoma viral oncogene homolog,KRAS)。GPX4在CRC中表达异常,其可以作为多种物质的靶点(Fig.2),并参与化疗耐药的调控。
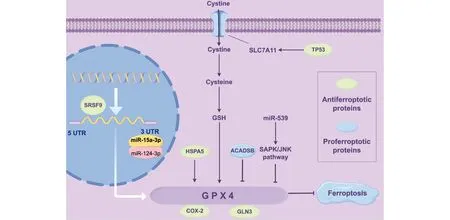
Fig.2 The main regulation of GPX4 in CRC
3.2.1 GPX4在CRC中的表达 研究发现,结肠癌患者组织中的GPX4 mRNA及蛋白质水平均升高[43,44]。蓝炜强等[44]研究表明,GPX4高表达是结肠癌患者不良预后的独立影响因素,与结肠癌肿瘤直径和低生存率相关。罗寿等[45]发现,GPX4 在左半结肠腺癌组织中的高表达率高于右半结肠腺癌组织,但此表达差异是否对患者预后存在影响仍需进一步研究。Yagublu等[46]发现,GPX4在不同分期的结肠癌组织中表达也有差异,除了T3期患者肿瘤样本外,其他阶段的GPX4蛋白表达水平均显著上调。在T3和T4期患者肿瘤样本中也发现了较高的mRNA水平,提示在晚期肿瘤中,GPX4可以确保对氧化应激的防御,并抑制肿瘤细胞的死亡。此外,JIA等[47]进行的甲基化分析结果显示,CRC中GPX4高甲基化与患者的低生存率有关。提示GPX4的甲基化对于CRC机制研究可能是一个新的切入点。
3.2.2 GPX4在CRC中的调控机制 GPX4的活性关键在于硒的掺入,而硒的掺入需要GPX4 mRNA 3′ UTR中特定的RNA茎环结构。GPX4单核苷酸多态性rs713041 T/C位于3′-UTR区,rs713041核苷酸的变化改变了mRNA与相关蛋白质的亲和力,以此来调节GPX4的合成[48],与T等位基因相比,C等位基因促进了GPX4合成的能力[49]。研究发现,rs713041与CRC易感性有关,最初G. Bermano等[50]2006年在苏格兰546例的人群中研究发现,与C等位基因相比,rs713041 T等位基因降低了CRC风险。之后2010年Meéplan等人[51]在捷克共和国1 400多名人群中的研究却得到了相反的结果,研究表明,与CC和TT基因型相比,CT基因型增加了CRC的发病风险,作者认为应该进一步在更大的人群中进行研究。2022年,一项Meta分析显示,rs713041 T等位基因携带者与CRC风险增加相关[52]。由于rs713041在CRC中的研究报道有限,且不同的地区、不同的人群亚结构和生活环境因素等都可能影响结果,因此,后续应进一步在大范围人群中研究以得到可靠的结果。在药物联合治疗转移性CRC的研究中发现,GPX4单核苷酸多态性rs4807542与西妥昔单抗/FOLFIRI组的OS显著相关,与AA和AG基因型相比,GG基因型有更好的OS,但在多变量分析中其影响是边缘的[53],推测可能是因为样本量较少,后续可扩大样本量进行验证。
p53是重要的抑癌基因,也是人类癌症中最常见的突变基因。研究发现,突变型p53可以直接靶向SLC7A11,并通过下调GPX4的表达和增加ROS的产生促进CRC铁死亡[54]。Wang等[55,56]发现,在一些肿瘤中被认为是原癌基因的富含丝氨酸和精氨酸的剪接因子9(serine and arginine rich splicing factor 9,SFRS9)在CRC中高表达,并且可以和GPX4的mRNA结合从而促进GPX4表达,进而抑制CRC铁死亡。因此,进一步敲低SFRS9,发现在体内和体外都可以抑制CRC的发展。类似地,Wang等[57]发现,70 kD热激蛋白5(heat shock 70 kD protein 5,HSPA5)可以直接与GPX4蛋白结合维持其稳定性,并调控CRC的免疫微环境,促进CRC的发展。酰基辅酶A脱氢酶,短/支链(Acyl-CoA dehydrogenase,short/ branched chain,ACADSB)是酰基辅酶A脱氢酶家族的一员,在CRC组织中低表达,其可以负调控GPX4的表达[58]。
GPX4蛋白质水平的上调可能参与细胞周期的调控,并促进上皮间质转化(epithelial-mesenchymal transition,EMT),导致肿瘤抵抗铁死亡并发生侵袭和迁移等行为,最终导致肿瘤对化疗药物不敏感。张波等[59]研究发现,在瑞格菲尼抵抗的CRC细胞株中,GPX4 mRNA及蛋白质水平均显著增高,磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)、蛋白激酶B (Akt)及波形蛋白(vimentin)表达升高,E-钙黏着蛋白(E-cadherin)表达降低,前2种蛋白质与细胞周期调控有关,后2种蛋白质是EMT的标志物,表明GPX4可以促进细胞的EMT,介导CRC细胞瑞格菲尼抵抗的形成。Yan等[60]发现,KRAS基因突变的男性CRC患者中GPX4高表达,KRAS可以通过Xc-GSH-GPX4途径抑制铁死亡,其生存期较差,这些KRAS突变的CRC患者用表皮生长因子受体(epidermal growth factor receptor,EGFR)单药(如西妥昔单抗)治疗效果受限。此后,Chen等[61]为了进一步研究CRC的耐药机制,使用榄香烯和西妥昔单抗联合应用于KRAS突变的CRC细胞,发现GPX4表达受到抑制,E-钙黏着蛋白表达升高且波形蛋白表达降低,提示二者是通过诱导铁死亡和抑制EMT使CRC细胞敏感。有趣的是,与非耐药的癌细胞相比,经历了EMT的耐药癌细胞更有可能被铁死亡诱导物杀死[62]。因此,抑制GPX4在一定程度上抑制大肠癌的EMT,提示靶向GPX4作用于KRAS突变的患者可能克服传统的CRC耐药性。在肠上皮细胞的研究中,发现GPX4通过对凋亡诱导因子(apoptosis-inducing factor,AIF)的影响,保护线粒体免受氧化损伤,维持氧化磷酸化复合物的稳定性。GPX4活性改变导致的线粒体氧化功能的变化可能会影响结肠细胞增殖,但需要进一步的研究来确定这种情况是否存在以及是否影响CRC风险[63]。
GPX4还参与CRC的某些信号通路。Yang等[64]发现,抑制KIF20A/NUAK1/Nrf2/GPX4信号通路诱导CRC铁死亡,并增强CRC对奥沙利铂的敏感性,这一通路为逆转CRC的耐药性提供了新思路。
在CRC中,GPX4是许多物质的作用靶点。小分子化合物RSL3可以以时间及剂量依赖性的方式特异性抑制GPX4的活性,抑制结肠腺癌细胞的生长,使其细胞增殖减慢,活性减弱[65]。有证据表明,5-氟尿嘧啶(5-fluorouracil,5-Fu)联合RSL3治疗小鼠异种移植物能有效抑制CRC肿瘤再生[66],同样,将索拉非尼和RSL 3给予索拉非尼耐药的CRC细胞时发现,可以导致铁和脂质过氧化物水平升高,最终导致CRC细胞铁死亡[67]。提示GPX4抑制剂联合化疗或靶向治疗可能是大肠癌的一种有前途的治疗方法。
GPX4还可以作为miRNA的靶点,在CRC中过表达miR-15a-3p[68]和miR-124-3p[69]基因,发现二者均可以直接与GPX4的3′-UTR结合来抑制GPX4。在耐奥沙利铂的细胞中高表达miR-124-3p基因,可通过降低GPX4蛋白的表达诱导铁死亡而逆转其耐药性。miR-539可以激活SAPK/JNK通路,并下调GPX4的表达并促进CRC铁死亡[70]。因此,miRNA/GPX4调节体系可能也会成为今后CRC治疗的重要靶点。研究发现,中药化学单体白藜芦醇(resveratrol,RSV)可以通过下调miR-31的表达,抑制SLC7A11和GPX4的表达,从而促进CRC死亡[71]。为了提高递送效率,Zhang等[72]开发了一种RSV仿生纳米载体(RSV-NPs@RBCm),这种纳米载体可以特异性穿透肿瘤,并显著降低GPX4的表达,促进CRC铁死亡,体内研究结果显示,其对CRC具有良好的治疗效果,这一发现表明,RSV有作为GPX4抑制剂的潜力,为RSV纳米载体应用在CRC治疗中铺平道路。与此类似,Mu等[73]利用微管蛋白抑制剂多西他赛(docetaxel ,DOC)设计了一种基于单宁酸(tannic acid, TA)、铁离子和多西他赛DOC的超分子纳米反应器(DOC@TA-Fe3+),这种纳米反应器被CRC细胞内化后可以从溶酶体逃逸并释放有效载荷,随后由TA介导的Fe3+/Fe2+转化可以触发芬顿(Fenton)反应,引起ROS浓度升高。此外,Fe3+通过消耗GSH来抑制GPX4的活性,从而诱导铁死亡。同时,释放的DOC控制微管动力学以激活细胞凋亡途径。其优越的抗肿瘤功效在小鼠模型中得到了验证。Zhou等[74]发现,微波诱导的基于铜-半胱氨酸(Cu-Cy)纳米颗粒的光动力疗法对CRC治疗有效果,这是因为Cu-Cy可以耗尽GPX4并诱导铁死亡来杀死CRC细胞,小鼠体内模型也证实Cu-Cy优越的体内抗肿瘤功效。总的来说,纳米材料有望成为靶向GPX4使CRC发生铁死亡的潜在分子。
GPX4还可以作用于许多蛋白质,共同调控CRC的发展。早在20年前就有研究表明,GPX4过表达会诱导结肠癌细胞环氧合酶2(cyclooxygenase-2,COX-2)活性增加,COX已被证明是非甾体抗炎药的靶点,而非甾体抗炎药的使用与结肠癌风险降低之间存在相关性[75]。另有研究表明,GPX4与鸟嘌呤核苷酸结合蛋白3(guanine nucleotide-binding protein-like 3,GNL3)表达呈正相关,GLN3参与细胞自我更新、增殖、凋亡、维持细胞基因组稳定性和端粒完整性等多种细胞生物学功能,说明GPX4、GLN3蛋白在结肠癌中共同作用参与调控肿瘤的发生发展[45]。
最新研究表明,CRC中存在非突变药物耐受持久性(drug-tolerant persister cells,DTP)细胞,DTP细胞的关键特征包括其静止状态和在绝大多数细胞群被快速杀死的条件下保持存活的能力,DTP细胞表现出可逆状态,移除药物后可恢复增殖和生长,并对初始治疗保持敏感。而在这种细胞中,发现GPX4显著上调,这导致CRC对模型药物的敏感性降低,使用GPX4抑制剂诱导使得敏感性增强[66]。提示抑制GPX4能作为DTP细胞的治疗靶点,可以选择性消除残留的CRC细胞库。
肠道菌群在CRC的肿瘤发生中发挥重要作用。肠道菌群失调、特定致病微生物、相关代谢产物和毒力因子会促进CRC的发生和发展[76]。肠道菌群与放化疗和免疫治疗等抗肿瘤治疗的疗效或不良反应有关,相关干预措施可以提高抗肿瘤治疗的疗效和严重的肠道毒性作用[77]。有证据显示,饮食和肠道菌群协同作用会降低结CRC风险,膳食纤维经过肠道菌群发酵可以生成丁酸盐,丁酸盐与ω-3多不饱和脂肪酸(omega-3 polyunsaturated fatty acids,n-3 PUFA)联合作用可以促进GPX4依赖性的铁死亡作用,从而降低CRC风险[78]。提示GPX4在介导饮食、肠道菌群与CRC之间的关联有潜在重要作用。
3.2.3 GPX4与药物 越来越多的研究表明,中药与结肠癌细胞铁死亡相关。雷公藤内酯酮(triptoinde,TN)是从雷公藤根茎分离提取的三萜类化合物,研究发现,TN 具有抗结肠癌的作用,而GPX4是TN抗癌的关键靶点,TN通过抑制GPX4激活结肠癌细胞铁死亡[79]。Miyazaki等[80]发现,姜黄素(curcumin)和穿心莲(andrographis)联合使用可以通过激活铁死亡和双重抑制GPX4和FSP-1在CRC中发挥抗肿瘤作用。Cai等[81]在小鼠模型中发现,龙须菜多糖可以通过激活GPX4通路增强CRC顺铂化疗的敏感性。抗疟疾药物青蒿琥酯(artesunate)可以通过抑制System Xc-/ GSH/ GPX4信号通路诱导CRC细胞发生铁死亡[82]。Honokiol作为潜在的高效特异的抗癌中草药,被发现可以通过降低GPX4的活性诱导CRC细胞铁死亡[83]。同样也有针对西药对GPX4的调控机制的研究,伊曲康唑(itraconazole,Itra)是一种抗真菌药物,其可以通过激活AMPK信号通路抑制GPX4的表达,促进CRC细胞铁死亡[84]。静脉麻醉药异丙酚(propofol)可以通过调节STAT3并下调GPX4的表达,诱导CRC铁死亡[85]。上述研究为治疗结肠癌提供了很好的药理依据,但进一步在动物模型体内的毒理药理研究也至关重要。
4 问题与展望
GPX4与胃肠道肿瘤的发生发展密切相关,有望成为治疗胃肠道肿瘤的药物靶点以及检测预后和复发转移的生物标志物。目前,仍有一些领域需要我们继续探索,例如,需进一步研究和阐明GPX4在胃肠道肿瘤中的分子机制,及其涉及的信号通路之间的干扰和交互作用。靶向GPX4使癌细胞铁死亡固然诱人,但是GPX4 抑制剂是否能应用于临床尚不清楚。抑制GPX4对胚胎、生殖发育和脑神经等产生着不可小觑的危害, 对其他生理过程也可能会有重大影响。因此,后期应着重探索有效安全的GPX4抑制剂,减少由于GPX4 缺失而引起的机体损伤,最终目标是确定抑制GPX4的药物与其他癌症疗法(如化疗和放疗)的最有效组合,以实现治疗效果最大化。
