中药调控铁死亡抑制脑缺血再灌注损伤的研究进展
2024-04-22赵文举付海鑫应春苗刘向哲
赵文举,付海鑫,应春苗,刘向哲
中药调控铁死亡抑制脑缺血再灌注损伤的研究进展
赵文举1, 2,付海鑫1, 2,应春苗1, 2,刘向哲1*
1. 河南中医药大学第一附属医院脑病中心,河南 郑州 450046 2. 河南中医药大学第一临床医学院,河南 郑州 450099
脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)是缺血性脑卒中的关键病理过程,是临床患者恢复亟须解决的问题。近年来研究发现,铁死亡的病理机制和CIRI密切相关,成为治疗CIRI的新兴靶点。中药治疗卒中具有独特优势,可通过减轻铁超载、减少活性氧产生、激活铁死亡防御通路、调节脂质合成等关键环节抑制铁死亡,减轻CIRI,保护神经功能,促进损伤恢复。通过对中药调控铁死亡治疗CIRI的最新研究进行综述,为中医药治疗CIRI和药物研发提供新思路与新途径。
铁死亡;脑缺血再灌注损伤;谷胱甘肽/谷胱甘肽过氧化物酶4信号通路;神经保护;氧化损伤;地黄苷A;黄芪甲苷;黄芩素;大黄酸
在我国,脑卒中是成年人致死、致残的首位病因[1-2]。中国卒中报告[3]指出,近30年,我国缺血性卒中的发病率增加了34.7%。目前急性缺血性卒中的治疗关键为恢复缺血脑组织的血流再灌注,逆转缺血半暗带,主要手段为静脉溶栓和血管内治疗[4]。但是,这些治疗方法因严格的时间窗和使用标准使得在临床中使用受到限制[5],且缺血再灌注可能会引起进一步的神经损伤,即脑缺血再灌注损伤(cerebral ischemia reperfusion injury,CIRI)。因此寻求减轻CIRI的治疗方法十分必要。CIRI涉及复杂的病理生理过程,激活多种细胞死亡途径[6]。其中铁死亡与CIRI密切相关,已成为急性缺血性卒中潜在的治疗靶标[7-9]。研究发现,中药萜类、皂苷类、黄酮类、醌类、多糖类等活性成分可以通过减轻铁过载、减少活性氧生成、抗脂质过氧化、激活防御信号通路等关键环节抑制铁死亡,进而发挥治疗CIRI的作用。铁死亡有望成为中药治疗CIRI新的研究方向,本文总结了中药干预铁死亡的最新研究进展,为CIRI的防治和进一步的药物开发提供思路,为中医药现代化建设提供依据。
1 铁死亡的发生机制
铁死亡是一种铁依赖性脂质过氧化驱动的细胞死亡形式,是细胞中活性氧等自由基在铁的作用下,氧化磷脂膜上的多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)产生脂质过氧化物,造成细胞膜破裂,作用于线粒体膜造成线粒体萎缩、线粒体双层膜结构密度增加、线粒体嵴减少或消失,进而造成细胞死亡[10-12]。
铁过载是铁死亡发生、发展的关键。铁正常转运途径[13]为:细胞外Fe3+与转铁蛋白形成复合物,再与细胞膜上的转铁蛋白受体(transferrin receptor,TFR)结合进入细胞内,Fe3+被还原成Fe2+后,经二价金属转运蛋白1(divalent metal transporter 1,DMT1)介导储存在不稳定的铁池或铁蛋白中,Fe2+可以经铁泵蛋白氧化成Fe3+转运出细胞。在组织器官处于缺血缺氧的应激情况时,铁过载涉及的调节机制失衡[14-15],导致细胞内Fe2+增多。活性氧主要源于线粒体呼吸过程中的副产物,当活性氧产生增多、抗氧化功能受损时,抗氧化系统失衡会促进铁死亡的发生[16]。含PUFA的磷脂(PUFA phosphatidyl ethanolamine,PUFA-PE)为铁死亡发生的底物,酰基辅酶A合成酶长链家族成员4(acyl-CoA synthetase long-chain family member 4,ACSL4)能催化PUFA乙酰化产生PUFA-CoA,在溶血磷脂酰胆碱酰基转移酶3(lysophosphatidylcholine acyltransferase 3,LPCAT3)的作用下酯化,与磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)反应生成PUFA-PE,PUFA-PE主要在内质网上通过脂氧合酶介导的酶促反应过氧化,产生脂质氢过氧化物(PL-PUFA-OOH),进而导致铁死亡[17-18]。ACSL3能激活单不饱和脂肪酸(monounsaturated fatty acid,MUFA)代替PUFA在细胞膜中积累,降低细胞膜对过氧化的敏感性,抑制铁死亡[19-20]。
目前研究表明[5,21-24],铁死亡相关独立防御通路包括谷胱甘肽/谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)、铁死亡抑制蛋白1/辅酶Q、三磷酸鸟苷环化水解酶1/四氢生物蝶呤和二氢乳酸脱氢酶/辅酶Q信号通路。其中还原型谷胱甘肽和GPX4是铁死亡经典防御信号通路的关键调节因子。GPX4是一种膜脂修复酶,在其作用下,PL-PUFA-OOH与谷胱甘肽生成PUFA的磷脂醇和氧化型谷胱甘肽(glutathione oxidized,GSSG),进而减少活性氧对细胞膜的破坏[23]。谷胱甘肽由谷氨酸、半胱氨酸和甘氨酸合成,其中由胱氨酸转化而来的半胱氨酸是谷胱甘肽生物合成的重要限速前体[24],溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)[25]是胱氨酸/谷氨酸逆向转运体(System Xc-)中的功能亚基,其高表达能促进胱氨酸转运进入细胞内,进而促进谷胱甘肽合成。
总之,铁死亡发生的基础为铁、活性氧等自由基和不饱和脂肪酸等脂质,并干预谷胱甘肽/GPX4为代表的多条信号通路。因此调节铁转运途径上的蛋白表达以减轻铁过载、减少活性氧等自由基生成、降低膜磷脂对过氧化的敏感性、激活铁死亡防御信号通路,是抑制铁死亡的潜在靶标,也是研究抗铁死亡药物的靶点所在。主要机制见图1。
2 铁死亡与CIRI
脑缺血再灌注时的铁稳态调节功能异常,而血脑屏障具有维持脑组织内铁稳态的功能,当脑缺血发生时,血脑屏障受损,导致脑内铁稳态失衡,驱动铁死亡发生[28-29]。在小鼠大脑中动脉闭塞模型(middle cerebral artery occlusion,MCAO)中可观察到缺血脑组织区域的铁蓄积[30],给MCAO大鼠补充铁时,会加重梗死程度;而使用铁螯合剂降低铁水平,可显著减小梗死面积[31]。多项研究表明缺血性脑卒中患者血清中铁水平升高,其升高程度和神经缺损程度呈正相关,可能与患者血清铁调素水平升高,诱导铁泵蛋白降解,导致细胞内Fe2+增多有关[32-35]。因此,铁过载被认为是参与缺血性脑卒中继发性损伤的重要病理因素。
脑缺血再灌注过程中会产生大量活性氧,而CIRI的发生与活性氧激活铁死亡密切相关[36]。脑组织缺血再灌注过程中产生大量活性氧的机制有:(1)缺血缺氧时,线粒体功能受损,呼吸链传递电子的效能下降,使自由基生成增加;再灌注时,呼吸链产生大量活性氧[37]。(2)组织或器官在缺氧情况下,三磷酸腺苷不足,生成大量次黄嘌呤,并使黄嘌呤脱氢酶的构象变为黄嘌呤氧化酶;再灌注时,氧气恢复供应,次黄嘌呤在黄嘌呤氧化酶的作用下产生大量活性氧[38]。(3)缺血时,机体会产生炎症介质等大量趋化因子,吸引中性粒细胞在缺血组织局部聚集并激活;再灌注期间,激活的中性粒细胞耗氧量显著增加,同时形成大量氧自由基,这个过程被称为“氧爆发”[39]。(4)脑缺血缺氧时,细胞膜功能受损,导致Ca2+超载,会激活磷脂酶A2使膜磷脂降解为花生四烯酸,花生四烯酸经环氧合酶生成前列腺素和白三烯的过程中产生大量的活性氧[40-41]。(5)缺血再灌注的应激条件下,交感-肾上腺髓质系统会大量释放儿茶酚胺并伴有酸中毒现象,儿茶酚胺易氧化,也会增加氧自由基的含量。脑组织缺乏过氧化氢酶抗氧化系统,缺血时抗氧化剂水平进一步降低[42],再灌注后活性氧产生增加,导致抗氧化功能失衡,同时脑组织中含有大量PUFA,神经元细胞不可再生[43],因此脑缺血再灌注时更容易发生铁死亡,导致神经功能损伤。
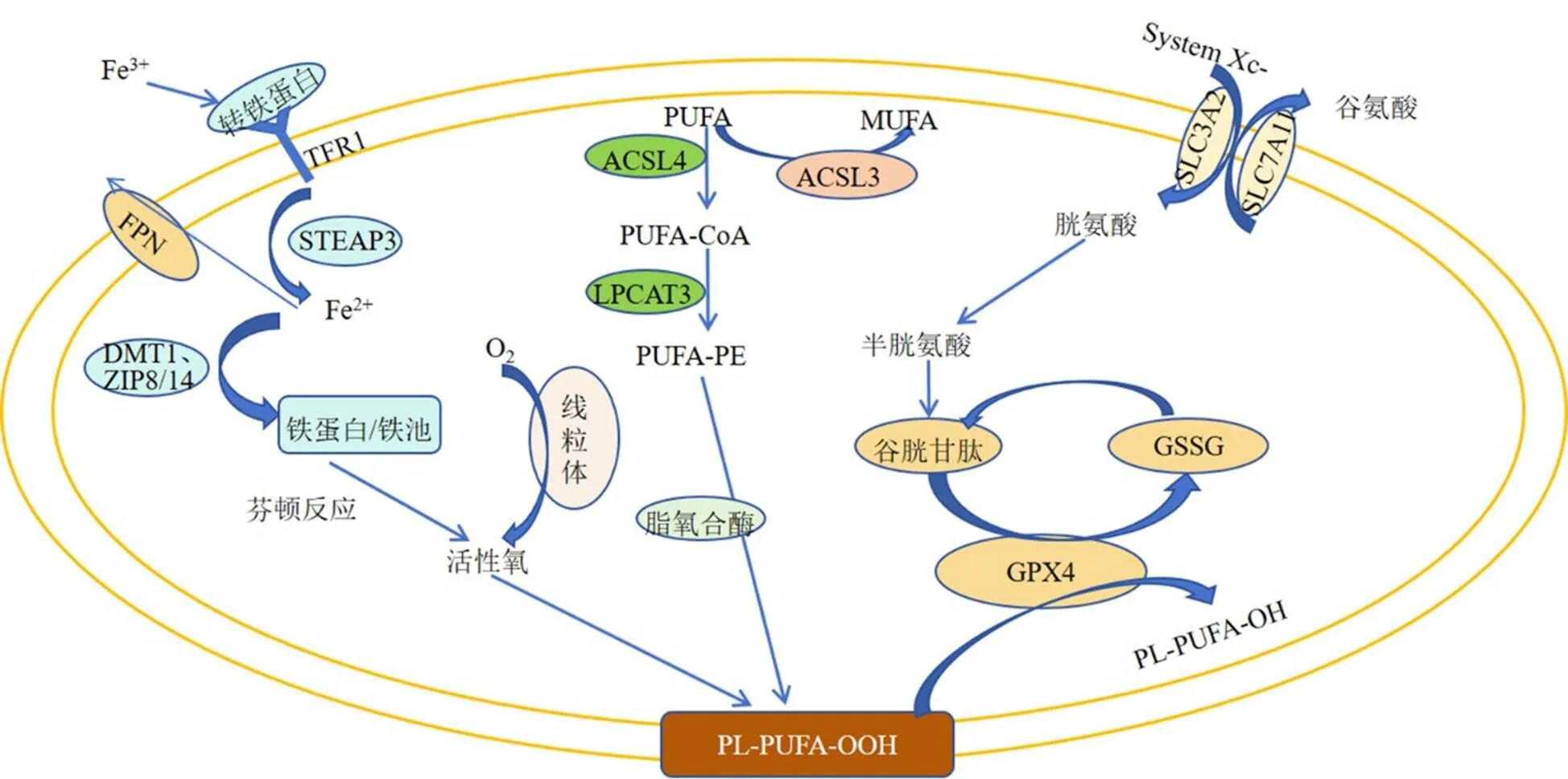
STEAP3-前列腺六跨膜上皮抗原3;ZIP8/14-锌铁调控转运蛋白8/14;SLC3A2-溶质载体家族3成员2。
脑缺血再灌注时可抑制铁死亡防御信号通路。同时,脑缺血再灌注时谷氨酸过度释放,抑制胱氨酸经System Xc-系统转运进细胞内,影响谷胱甘肽合成,抑制谷胱甘肽/GPX4信号通路,进而诱发铁死亡造成神经细胞死亡,加重神经功能损伤[44]。
综上,脑缺血再灌注时,铁过载、活性氧等自由基大量产生、铁死亡防御信号通路被抑制等因素同时出现,可能是激活铁死亡和产生CIRI的病理诱因。而通过抑制铁死亡发挥神经保护作用,可能成为防治CIRI的潜在治疗途径。
3 中药单体成分通过调控铁死亡治疗CIRI的研究
中医药治疗缺血性脑卒中历史悠久,积累了丰富经验。随着现代分子生物学等技术的进步,挖掘中药治疗CIRI在分子层面的作用机制成为当前研究的热点和中药新药开发的前沿方向,因此对中药活性成分干预铁死亡防治CIRI的进展进行总结。
3.1 萜类
地黄苷A是地黄的主要活性成分之一[45]。Fu等[46]发现地黄苷A 80 mg/kg可以减小MCAO大鼠的脑梗死区域并改善认知能力,地黄苷A 80 μmol/L可以减轻过氧化氢诱导的人神经母细胞瘤SH-SY5Y细胞铁死亡,其机制为升高磷酸化磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)、磷酸化蛋白激酶B(protein kinase B,Akt)、核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)、血红素氧合酶-1(heme oxygenase-1,HO-1)和SLC7A11的表达,通过激活PI3K/Akt/Nrf2和SLC7A11/GPX4信号通路抑制铁死亡、发挥神经保护作用。
β-石竹烯来源于丁香、肉桂等中药,具有抗炎、抗氧化、抗焦虑的药理活性[47]。Hu等[48]研究发现β-石竹烯306 mg/kg可以改善大脑中动脉闭塞/再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)大鼠的神经功能评分、梗死体积和病理损伤,β-石竹烯20 μmol/L可以增强氧葡萄糖剥夺/再氧合(oxygen-glucose deprivation/reoxygenation,OGD/R)原代星形胶质细胞的Nrf2核易位。以上研究表明中药活性成分可以通过激活Nrf2/HO-1抗氧化信号通路,减少活性氧生成和降低铁过载,从而抑制铁死亡。
3.2 皂苷类
黄芪甲苷是黄芪中的有效成分之一,既往研究表明其具有激活p62/Kelch样ECH相关蛋白1(Kelch like ECH associated protein 1,Keap1)/Nrf2途径并通过抗氧化、抗炎和抗凋亡途径减轻CIRI的作用[49]。Wang等[50]研究表明黄芪甲苷40 μmol/L可减轻SH-SY5Y细胞的损伤和死亡,黄芪甲苷28 mg/kg能改善改善MCAO/R大鼠模型的感觉和运动功能障碍,其机制为增加p62和Nrf2蛋白水平,降低Keap1水平,进而影响铁死亡的关键蛋白和抗脂质过氧化,抑制铁死亡。Zhang等[51]研究发现,ip黄芪甲苷20 mg/kg于MCAO大鼠,可增加大鼠脑组织SLC7A11和GPX4水平,降低活性氧水平,其机制与Nrf2/HO-1信号通路有关。
三七总皂苷是三七的主要有效成分之一,既往研究显示,其可以通过抗炎、抗氧化、促进血管新生等机制发挥抗CIRI作用[52]。王林琳等[53]研究发现,三七总皂苷20、40、80 mg/kg均能通过抑制铁死亡改善MCAO/R大鼠神经功能缺损评分,减少脑梗死区域体积,降低缺血侧脑组织中Fe2+和丙二醛含量,增加脑组织谷胱甘肽含量和GPX4表达水平。以上研究表明,中药活性成分可以通过激活Nrf2/ HO-1抗氧化信号通路、降低活性氧水平、激活谷胱甘肽/GPX4信号通路来抑制铁死亡。
3.3 黄酮类
淫羊藿次苷II是淫羊藿的主要成分之一,具有抗氧化活性,在多种氧化应激组织损伤治疗中具有良好的效果[54]。Gao等[55]研究发现,淫羊藿次苷II10 mg/kg可以减轻MCAO/R小鼠模型的神经损伤,结合原代星形胶质细胞OGD/R实验,发现淫羊藿次苷II6.25 μmol/L可以与Nrf2结合,增强其转录活性,促进Nrf2核易位和激活氧化磷酸化(oxidative phosphorylation,OXPHOS)/NF-κB/铁死亡轴。
牡荆素具有抗炎、抗氧化和抗肿瘤等作用[56]。Guo等[57]研究发现牡荆素0.5、2.5、10.0 nmol/L均可调节OGD/R原代皮质神经细胞模型Keap1/ Nrf2/HO-1通路蛋白的表达,增加核内Nrf2表达、降低Nrf2从核到细胞质的转移率,增加HO-1、SLC7A11、GPX4水平,降低Keap1、TFR1水平,牡荆素45 mg/kg可减轻MCAO/R大鼠模型脑损伤体积,减轻组织病理损伤和改善线粒体功能,减少活性氧产生,在铁死亡中发挥保护作用。
白杨素是为蜂胶、黄芩、木蝴蝶等中药的成分之一,既往研究表明,白杨素通过调节氧化应激、炎症和细胞凋亡,发挥保护神经功能的作用[58]。尚津锋等[59]发现白杨素50 mg/kg能促进MCAO/R大鼠神经功能恢复,降低脑梗死率,减轻脑组织病理学改变,其机制为降低大鼠脑组织和血清中的总铁、脂质过氧化物、丙二醛含量,增加、的mRNA和蛋白表达,减少TFR1、铁死亡标志物前列腺素内过氧化物合成酶2(prostaglandinen-doperoxide synthase 2,PTGS2)、的mRNA和蛋白表达。
二氢杨梅素是藤茶的有效成分之一,具有抗氧化、抗炎、抗高血脂、改善缺血性卒中的脑损伤等作用[60-61]。Xie等[62]研究发现,二氢杨梅素150、200、250 mg/kg可以改善MCAO/R大鼠模型的神经功能缺损、脑含水量、脑梗死体积和脑组织细胞死亡,且改善效果与剂量成正相关,其机制为抑制鞘氨醇激酶1/哺乳动物雷帕霉素靶蛋白信号通路进而抑制铁死亡;小鼠海马神经元HT22细胞OGD/R模型实验显示,二氢杨梅素30 μmol/L可降低活性氧和细胞内铁水平,增强GPX4表达,降低ACSL4的水平。
高良姜素是从中药高良姜中提取的中药活性成分,具有抗炎、抗氧化、抗肿瘤和抑菌作用[63]。关雪[64]研究发现高良姜素1.2 mmol/L能增加海马神经细胞OGD/R模型SLC7A11和GPX4的表达,增加超氧化物歧化酶、谷胱甘肽的水平,减少DNA氧化损伤标志蛋白H2AX、脂质过氧化产物丙二醛和4-羟基壬烯醛、PTGS2的表达,高良姜素100 mg/kg可改善MCAO/R沙鼠的学习和记忆功能,减少脑细胞死亡,其机制为激活SLC7A11/GPX4通路,降低氧化应激水平,促进脂质过氧化物代谢。
黄芩素是一种从黄芩跟中提取重要活性成分,具有抗氧化、抗炎、保护线粒体功能和结构、抑制细胞凋亡的作用[65]。李鸣[66]研究证实,黄芩素80 mg/kg可减轻MCAO小鼠模型神经细胞死亡和改善认知功能,黄芩素4、20 μmol/L均能增加HT22细胞OGD/R模型GPX4、铁蛋白重链多肽1、线粒体铁储存蛋白、System Xc-功能亚基SLC7A11和ACSL3的蛋白表达,降低ACSL4蛋白表达和总铁水平,改善效果与剂量正相关,证实其抑制铁死亡减轻CIRI的机制为降低铁含量、抑制脂质过氧化反应、增加内源性抗氧化活性和调控多种铁死亡相关蛋白表达。黄芩苷是黄芩素的活性前体,邓翕仁等[67]研究证实,黄芩苷50 mg/kg可升高小鼠短暂双侧颈总动脉闭塞模型海马组织DMT1水平,降低PTGS2、丙二醛水平,通过促进铁储存、激活铁死亡防御通路,改善小鼠认知功能。
大豆异黄酮能竞争性与雌激素受体结合,并可以透过血脑屏障,在体内发挥保护中枢神经的作用,被称为“天然雌激素”[68]。李晒等[69]研究发现ig大豆异黄酮120 mg/kg于MCAO/R大鼠模型,与对照组相比,缺血半暗带区的Fe2+和丙二醛含量降低、谷胱甘肽及GPX4表达升高,提示其能通过减轻氧化应激和抑致铁死亡发挥神经元保护作用。
毛蕊异黄酮是从黄芪跟中提取的典型植物雌激素,具有抗CIRI的作用[70]。Liu等[71]通过ip毛蕊异黄酮5、10、20 mg/kg于MCAO/R大鼠模型,证实毛蕊异黄酮可以抑制铁死亡,毛蕊异黄酮15、30、60 μmol/L处理OGD/R大鼠肾上腺髓质嗜铬瘤PC12细胞证实,毛蕊异黄酮可以降低TFR1表达,增加铁蛋白重链多肽1和GPX4的水平,且均与剂量呈正相关,这种保护机制是通过抑制ACSL4蛋白的表达通路发挥作用。因此,中药活性成分能通过激活抗氧化信号通路减少活性氧生成、减轻铁过载、改变膜成分降低细胞膜对过氧化的敏感性、启动谷胱甘肽/GPX4信号通路来抑制铁死亡。
3.4 醌类
二氢丹参酮I是丹参的重要活性成分,具有抗肿瘤、保护心脑血管、抗炎、抗过敏、保肝的作用[72]。Wu等[73]研究表明,二氢丹参酮I10 μmol/L可以降低PC12细胞OGD/R模型的铁死亡,表现为活性氧减少、GPX4表达和谷胱甘肽/GSSG的值增加,线粒体功能改善;二氢丹参酮30 mg/kg能改善MCAO大鼠模型神经学评分、减轻梗死体积和脑水肿、增加局部脑血流量,改善大鼠脑微观结构,其机制为激活Nrf2相关信号通路。
大黄酸为大黄的主要成分之一。Liu等[74]研究证实,大黄酸可以减轻MCAO大鼠神经功能缺损、减小梗死体积,保护血脑屏障,且与剂量成正相关,能通过Nrf2/SLC7A11/GPX4信号通路减少HT22细胞OGD/R模型活性氧生成、降低Fe2+水平,进而抑制铁死亡保护神经细胞。以上研究表明,中药活性成分能通过减少活性氧生成、减轻铁过载、启动谷胱甘肽/GPX4信号通路来抑制铁死亡。
3.5 多糖类
天麻多糖是中药天麻的活性成分之一,Zhang等[75]研究证实,天麻多糖1 mg/kg能减轻MCAO/R模型小鼠神经功能缺损症状,减小梗死体积,缓解脑水肿,天麻多糖500 μg/mL促进OGD/R诱导的HT22细胞存活,机制为上调GPX4水平,降低活性氧、丙二醛、Fe2+水平,上调Nrf2和HO-1的表达,促进Nrf2核转移,验证了天麻多糖通过介导Nrf2/ HO-1信号通路发挥抗炎和抗铁死亡的作用。
综上所述,萜类、皂苷类、黄酮类、醌类、多糖类等多种中药活性成分,可以通过减轻铁过载、减少活性氧生成、调节膜磷脂合成、激活防御通路等关键环节抑制铁死亡,发挥保护神经细胞、减小脑梗死面积、保护神经功能的作用,提示了中药成分具有治疗CIRI的广阔前景和巨大潜力。
4 结语与展望
CIRI是困扰临床已久的问题,近些年围绕铁死亡的研究,为进一步揭示脑缺血再灌注机制和治疗CIRI奠定了基础。本研究通过文献综述发现,中药成分靶向调控铁死亡和CIRI的各个关键环节,尤其表现在激活谷胱甘肽/GPX4信号通路相关的蛋白和靶点,其次是减少活性氧生成和铁过载;通过抑制铁死亡治疗CIRI的中药活性成分多为黄酮类,其次为萜类和皂苷类;相关活性成分来源的中药多归肝、脾经,性味多苦或甘。但目前中药抗铁死亡的研究仍局限于细胞和动物实验,缺少中药复方和针灸等临床试验,少量的复方临床试验虽然证实了中药的抗铁死亡作用[76-77],但是中药复方成分复杂,增加了代谢途径和作用靶点的研究难度;其次临床中患者病情复杂,中药成分可能产生不同的毒理或生理反应。因此,深入研究中药通过抑制铁死亡治疗CIRI,对开发基于中药成分治疗CIRI的药物具有重要意义,但仍有待结合网络药理学、生物信息学、分子对接、高通量质谱分析等前沿技术进行更多研究。
利益冲突 所有作者均声明不存在利益冲突
[1] 《中国脑卒中防治报告》编写组. 《中国脑卒中防治报告2020》概要 [J]. 中国脑血管病杂志, 2022, 19(2): 136-144.
[2] Wu S M, Wu B, Liu M,. Stroke in China: Advances and challenges in epidemiology, prevention, and management [J]., 2019, 18(4): 394-405.
[3] Wang Y J, Li Z X, Gu H Q,. China stroke statistics: An update on the 2019 report from the national center for healthcare quality management in neurological diseases, China national clinical research center for neurological diseases, the Chinese stroke association, national center for chronic and non-communicable disease control and prevention, Chinese center for disease control and prevention and institute for global neuroscience and stroke collaborations [J]., 2022, 7(5): 415-450.
[4] Hollist M, Morgan L, Cabatbat R,. Acute stroke management: Overview and recent updates [J]., 2021, 12(4): 1000-1009.
[5] Powers W J, Rabinstein A A, Ackerson T,. Guidelines for the early management of patients with acute ischemic stroke: 2019 update to the 2018 guidelines for the early management of acute ischemic stroke: A guideline for healthcare professionals from the American heart association/american stroke association [J]., 2019, 50(12): e344-e418.
[6] Gong L L, Tang Y W, An R,. RTN1-C mediates cerebral ischemia/reperfusion injury via ER stress and mitochondria-associated apoptosis pathways [J]., 2017, 8(10): e3080.
[7] Yan H F, Zou T, Tuo Q Z,. Ferroptosis: Mechanisms and links with diseases [J]., 2021, 6(1): 49.
[8] Wu M Y, Yiang G T, Liao W T,. Current mechanistic concepts in ischemia and reperfusion injury [J]., 2018, 46(4): 1650-1667.
[9] 石晓花, 莽靖, 徐忠信. 脑缺血再灌注损伤细胞死亡模式的研究进展 [J]. 吉林大学学报: 医学版, 2022, 48(6): 1635-1643.
[10] Dixon S J, Lemberg K M, Lamprecht M R,. Ferroptosis: An iron-dependent form of nonapoptotic cell death [J]., 2012, 149(5): 1060-1072.
[11] 龚卓之, 曹增, 姚梦茜, 等. 从铁死亡探讨溃疡性结肠炎不同时期的发病机制及相关天然药物筛选 [J]. 中草药, 2023, 54(7): 2187-2196.
[12] 陈祥宇, 张晶涵, 赖嘉豪, 等. 基于数据挖掘的益气活血类方防治脑缺血再灌注损伤用药规律及其作用机制研究[J]. 中草药, 2023, 54(10): 3221-3236.
[13] Tang D L, Chen X, Kang R,. Ferroptosis: Molecular mechanisms and health implications [J]., 2021, 31(2): 107-125.
[14] Yan H F, Tuo Q Z, Yin Q Z,. The pathological role of ferroptosis in ischemia/reperfusion-related injury [J]., 2020, 41(3): 220-230.
[15] Wu J R, Tuo Q Z, Lei P. Ferroptosis, a recent defined form of critical cell death in neurological disorders [J]., 2018, 66(2): 197-206.
[16] Valgimigli L. Lipid peroxidation and antioxidant protection [J]., 2023, 13(9): 1291.
[17] Kenny E M, Fidan E, Yang Q,. Ferroptosis contributes to neuronal death and functional outcome after traumatic brain injury [J]., 2019, 47(3): 410-418.
[18] 王梅芳, 李德冠. 铁死亡及其在心脑血管疾病中的研究进展 [J]. 生命科学, 2019, 31(9): 886-893.
[19] Yang Y F, Zhu T, Wang X,. ACSL3 and ACSL4, distinct roles in ferroptosis and cancers [J]., 2022, 14(23): 5896.
[20] Bai T, Li M X, Liu Y F,. Inhibition of ferroptosis alleviates atherosclerosis through attenuating lipid peroxidation and endothelial dysfunction in mouse aortic endothelial cell [J]., 2020, 160: 92-102.
[21] Gao M, Fan K X, Chen Y H,. Understanding the mechanistic regulation of ferroptosis in cancer: The gene matters [J]., 2022, 49(10): 913-926.
[22] Mao C, Liu X G, Zhang Y L,. DHODH-mediated ferroptosis defence is a targetable vulnerability in cancer [J]., 2021, 593(7860): 586-590.
[23] Doll S, Freitas F P, Shah R,. FSP1 is a glutathione-independent ferroptosis suppressor [J]., 2019, 575(7784): 693-698.
[24] Bersuker K, Hendricks J M, Li Z P,. The CoQ oxidoreductase FSP1 acts parallel to GPX4 to inhibit ferroptosis [J]., 2019, 575(7784): 688-692.
[25] Alim I, Caulfield J T, Chen Y X,. Selenium drives a transcriptional adaptive program to block ferroptosis and treat stroke [J]., 2019, 177(5): 1262-1279.e25.
[26] Xue Y, Lu F J, Chang Z Z,. Intermittent dietary methionine deprivation facilitates tumoral ferroptosis and synergizes with checkpoint blockade [J]., 2023, 14(1): 4758.
[27] Pang P, Si W, Wu H,. YTHDF2 promotes cardiac ferroptosis via degradation of SLC7A11 in cardiac ischemia-reperfusion injury [J]., 2023, doi: 10.1089/ars.2023.0291.
[28] Friedmann Angeli J P, Krysko D V, Conrad M. Ferroptosis at the crossroads of cancer-acquired drug resistance and immune evasion [J]., 2019, 19(7): 405-414.
[29] Kajarabille N, Latunde-Dada G O. Programmed cell-death by ferroptosis: Antioxidants as mitigators [J]., 2019, 20(19): 4968.
[30] Tuo Q Z, Lei P, Jackman K A,. Tau-mediated iron export prevents ferroptotic damage after ischemic stroke [J]., 2017, 22(11): 1520-1530.
[31] Abdul Y, Li W G, Ward R,. Deferoxamine treatment prevents post-stroke vasoregression and neurovascular unit remodeling leading to improved functional outcomes in type 2 male diabetic rats: Role of endothelial ferroptosis [J]., 2021, 12(4): 615-630.
[32] Reiche E M V, Gelinksi J R, Alfieri D F,. Immune-inflammatory, oxidative stress and biochemical biomarkers predict short-term acute ischemic stroke death [J]., 2019, 34(3): 789-804.
[33] Zhang Y F, Lu X Y, Tai B,. Ferroptosis and its multifaceted roles in cerebral stroke [J]., 2021, 15: 615372.
[34] Azab S F, Akeel N E, Abdalhady M A,. Serum hepcidin levels in childhood-onset ischemic stroke: A case-control study [J]., 2016, 95(9): e2921.
[35] Khalil S, Cavagnero K J, Williams M R,. Regulation of epidermal ferritin expression influences systemic iron homeostasis [J]., 2024, 144(1): 84-95.
[36] 李昕, 王芷宁, 付璐, 等. 缺血-再灌注氧化损伤机制及其对不同器官功能的影响 [J]. 中国比较医学杂志, 2022, 32(7): 149-154.
[37] Zhou H, Du W J, Li Y,. Effects of melatonin on fatty liver disease: The role of NR4A1/DNA-PKcs/p53 pathway, mitochondrial fission, and mitophagy [J]., 2018, 64(1): e12450.
[38] Li H, Yan Z Y, Zhu J,. Neuroprotective effects of resveratrol on ischemic injury mediated by improving brain energy metabolism and alleviating oxidative stress in rats [J]., 2011, 60(2/3): 252-258.
[39] Zhang X J, Cheng X, Yan Z Z,. An ALOX12-12-HETE-GPR31 signaling axis is a key mediator of hepatic ischemia-reperfusion injury [J]., 2018, 24(1): 73-83.
[40] Tang L J, Luo X J, Tu H,. Ferroptosis occurs in phase of reperfusion but not ischemia in rat heart following ischemia or ischemia/reperfusion [J]., 2021, 394(2): 401-410.
[41] Hassannia B, Vandenabeele P, Vanden Berghe T. Targeting ferroptosis to iron out cancer [J]., 2019, 35(6): 830-849.
[42] Shalavadi M H, Chandrashekhar V M, Muchchandi I S. Neuroprotective effect ofChoisy in oxidative stress model of cerebral ischemia reperfusion injury and assessment of MAP2 in rats [J]., 2020, 249: 112393.
[43] 齐磊, 欧阳欣, 于明帅, 等. 丙泊酚对大鼠局灶性脑缺血再灌注模型神经功能改善及PKA-CREB通路的影响 [J]. 中国比较医学杂志, 2021, 31(2): 30-36.
[44] Ziemens D, Oschmann F, Gerkau N J,. Heterogeneity of activity-induced sodium transients between astrocytes of the mouse hippocampus and neocortex: Mechanisms and consequences [J]., 2019, 39(14): 2620-2634.
[45] 周倩, 王慧森, 李更生, 等. 怀药熟地黄地黄苷A RP-HPLC定量及TLC定性评价方法 [J]. 中华中医药学刊, 2014, 32(12): 2918-2921.
[46] Fu C, Wu Y F, Liu S J,. Rehmannioside A improves cognitive impairment and alleviates ferroptosis via activating PI3K/Akt/Nrf2 and SLC7A11/GPX4 signaling pathway after ischemia [J]., 2022, 289: 115021.
[47] Yang M, Lv Y J, Tian X C,. Neuroprotective effect of β-caryophyllene on cerebral ischemia-reperfusion injury via regulation of necroptotic neuronal death and inflammation:and[J]., 2017, 11: 583.
[48] Hu Q W, Zuo T R, Deng L,. β-caryophyllene suppresses ferroptosis induced by cerebral ischemia reperfusion via activation of the Nrf2/HO-1 signaling pathway in MCAO/R rats [J]., 2022, 102: 154112.
[49] Kang X H, Su S Y, Hong W D,. Research progress on the ability of astragaloside IV to protect the brain against ischemia-reperfusion injury [J]., 2021, 15: 755902.
[50] Wang L L, Liu C W, Wang L L,. Astragaloside IV mitigates cerebral ischaemia-reperfusion injury via inhibition of p62/Keap1/Nrf2 pathway-mediated ferroptosis [J]., 2023, 944: 175516.
[51] Zhang C L, Shi Z H, Xu Q Y,. Astragaloside IV alleviates stroke-triggered early brain injury by modulating neuroinflammation and ferroptosis via the Nrf2/HO-1 signaling pathway [J]., 2023, 38: e380723.
[52] 张文杰. 灯盏花素联合三七总皂苷对急性脑梗死大鼠模型TNOS、iNOS的影响 [D]. 太原: 山西医科大学, 2014.
[53] 王林琳, 康智能, 刘文鹏, 等. 三七总皂苷抑制铁死亡和炎症反应减轻大鼠脑缺血再灌注损伤 [J]. 中国免疫学杂志, 2022, 38(3): 296-300.
[54] Liu X, Li Z, Li M,. Icariside II overcomes BRAF inhibitor resistance in melanoma by inducing ROS production and inhibiting MITF [J]., 2020, 44(1): 360-370.
[55] Gao J M, Ma C J, Xia D Y,. Icariside II preconditioning evokes robust neuroprotection against ischaemic stroke, by targeting Nrf2 and the OXPHOS/NF-κB/ferroptosis pathway [J]., 2023, 180(3): 308-329.
[56] Ganesan K, Xu B J. Molecular targets of vitexin and isovitexin in cancer therapy: A critical review [J]., 2017, 1401(1): 102-113.
[57] Guo L, Shi L. Vitexin improves cerebral ischemia-reperfusion injury by attenuating oxidative injury and ferroptosis via Keap1/Nrf2/HO-1signaling [J]., 2023, 48(3): 980-995.
[58] Mishra A, Mishra P S, Bandopadhyay R,. Neuroprotective potential of chrysin: Mechanistic insights and therapeutic potential for neurological disorders [J]., 2021, 26(21): 6456.
[59] 尚津锋, 焦家康, 李倩楠, 等. 白杨素通过抑制铁死亡减轻大鼠脑缺血再灌注损伤 [J]. 中国中药杂志, 2023,48(06):1597-1605.
[60] Zhang J Y, Chen Y, Luo H Q,. Recent update on the pharmacological effects and mechanisms of dihydromyricetin [J]., 2018, 9: 1204.
[61] Zhang Q, Wang J, Zhang H L,. Dihydromyricetin inhibits oxidative stress and apoptosis in oxygen and glucose deprivation/reoxygenation-induced HT22cells by activating the Nrf2/HO-1 pathway [J]., 2021, 23(6): 397.
[62] Xie J B, Zhang T T, Li P C,. Dihydromyricetin attenuates cerebral ischemia reperfusion injury by inhibiting SPHK1/mTOR signaling and targeting ferroptosis [J]., 2022, 16: 3071-3085.
[63] Huang H Z, Chen A Y, Ye X Q,. Galangin, a flavonoid from lesser galangal, induced apoptosis via p53-dependent pathway in ovarian cancer cells [J]., 2020, 25(7): 1579.
[64] 关雪. 高良姜素对脑缺血再灌注损伤沙鼠海马神经元的保护作用及机制研究 [D]. 沈阳: 辽宁中医药大学, 2022.
[65] Mu X, He G R, Cheng Y X,. Baicalein exerts neuroprotective effects in 6-hydroxydopamine-induced experimental Parkinsonismand[J]., 2009, 92(4): 642-648.
[66] 李鸣. 抑制铁死亡介导的黄芩素对脑缺血再灌注损伤的保护作用机制研究 [D]. 长春: 吉林大学, 2022.
[67] 邓翕仁, 曾道君, 张官鹏, 等. 黄芩苷通过PGE2在脑缺血再灌注损害小鼠认知功能中的作用研究 [J]. 实用医学杂志, 2023, 39(15): 1881-1887.
[68] Kim I S. Current perspectives on the beneficial effects of soybean isoflavones and their metabolites for humans [J]., 2021, 10(7): 1064.
[69] 李晒, 李丽, 闵思敏, 等. 大豆异黄酮可减轻大鼠脑缺血/再灌注损伤:基于抑制铁死亡及炎症级联反应 [J]. 南方医科大学学报, 2023,43(2):323-331.
[70] Yu S Z, Wu K, Liang Y J,. Therapeutic targets and molecular mechanism of calycosin for the treatment of cerebral ischemia/reperfusion injury [J]., 2021, 13(12): 16804-16815.
[71] Liu H, Zhao Z B, Yan M Y,. Calycosin decreases cerebral ischemia/reperfusion injury by suppressing ACSL4-dependent ferroptosis [J]., 2023,734:109488.
[72] Chen X P, Yu J, Zhong B L,. Pharmacological activities of dihydrotanshinone I, a natural product fromBunge [J]., 2019, 145: 104254.
[73] Wu C H, Duan F P, Yang R C,. 15,16-dihydrotanshinone I protects against ischemic stroke by inhibiting ferroptosis via the activation of nuclear factor erythroid 2-related factor 2 [J]., 2023, 114: 154790.
[74] Liu H, Zhang T A, Zhang W Y,. Rhein attenuates cerebral ischemia-reperfusion injury via inhibition of ferroptosis through Nrf2/SLC7A11/GPX4 pathway [J]., 2023, 369: 114541.
[75] Zhang Y G, Ye P, Zhu H,. Neutral polysaccharide fromalleviates cerebral ischemia-reperfusion injury by inhibiting ferroptosis-mediated neuroinflammation via the Nrf2/HO-1 signaling pathway [J]., 2023, 30(3): e14456.
[76] 饶政清, 梅志刚, 葛金文, 等. 脑泰方调控细胞铁转运抑制铁死亡保护脑卒中缺血损伤的机制研究 [J]. 中草药, 2021, 52(21): 6552-6560.
[77] 邓秋媚, 吴林, 袁莉, 等. 温阳复元方通过调控miRNA-137/线粒体铁死亡通路保护大鼠脑缺血再灌注损伤机制研究[J]. 辽宁中医药大学学报, 2024, 26(2): 31-36.
Research progress on regulating ferroptosis and inhibiting cerebral ischemia reperfusion injury by traditional Chinese medicine
ZHAO Wenju1, 2, FU Haixin1, 2, YING Chunmiao1, 2, LIU Xiangzhe1
1. Encephalopathy Center of the First Affiliated Hospital of Henan University of Chinese Medicine, zhengzhou 450046, China 2. The First Clinical Medical College of Henan University of Chinese Medicine, zhengzhou 450099, China
Cerebral ischemia reperfusion injury (CIRI) is the key pathological process of ischemic stroke, which is an urgent problem of clinical patient recovery. Recent studies have revealed that the pathological mechanism of ferroptosis is closely related to CIRI, becoming an emerging target for the treatment of CIRI. Traditional Chinese medicine has unique advantages in treatment of stroke. It can inhibit ferroptosis, reduce CIRI, protect nerve function, and promote the recovery of injury by reducing iron overload, reducing reactive oxygen species production, activating ferroptosis defense pathway, and regulating lipid synthesis. This paper reviews the latest research on the regulation of ferroptosis by traditional Chinese medicine in treatment of CIRI, and provides new ideas and new approaches for treatment of CIRI and drug development with traditional Chinese medicine.
ferroptosis; cerebral ischemia reperfusion injury; glutathione/glutathione peroxidase 4 signaling pathway; neuroprotection; oxidative damage; rehmannioside A; astragaloside IV; baicalein; rhein
R285
A
0253 - 2670(2024)08 - 2812 - 08
10.7501/j.issn.0253-2670.2024.08.030
2023-11-20
国家重点研发计划(2022YFC3501103);河南省科技攻关项目(242102311277);河南省中医药传承与创新人才工程(仲景工程)中医药学科领军人才(豫卫中医函 [2021] 8号);河南省“双一流”创建学科中医学科研专项课题(HSRP-DFCTCM-2023-2-18)
赵文举,硕士研究生,研究方向为中医药防治脑血管病。E-mail: 18614981763@163.com
通信作者:刘向哲(1966—),男,教授,主任医师,博士生导师,从事中医药防治脑血管病研究。E-mail: liuxiangzhe@163.com
[责任编辑 赵慧亮]
