基于生信分析和动力学模拟鉴定阿尔茨海默病免疫标志物及靶向药食同源中药预测
2024-04-22梁朋朋王雅乐李桂云吴红彦
梁朋朋,王雅乐,黄 海,李桂云,吴红彦
·数据挖掘与循证医学·
基于生信分析和动力学模拟鉴定阿尔茨海默病免疫标志物及靶向药食同源中药预测
梁朋朋,王雅乐,黄 海,李桂云,吴红彦
上海中医药大学深圳医院,广东 深圳 518004
分析阿尔茨海默病(Alzheimer’s,AD)免疫相关的生物标志物、发病机制、免疫浸润水平和潜在的靶向药食同源中药。从GEO数据库中下载GSE5281、GSE132903数据集的表达谱,获得AD差异表达基因(differentially expressed genes,DEGs)。采用加权共表达算法鉴定出AD重要模块基因,再从ImmPortPortal数据库获取免疫相关基因(immune-related genes,IRGs),将这些基因取交集得到免疫重要差异基因;随后应用最小绝对收缩和选择算法(least absolute shrinkage and selection operator,LASSO)及机器学习-支持向量机递归特征消除(support vector machine-recursive feature elimination,SVM-RFE)方法进行分析,筛选出AD共同的免疫相关标志物,并通过基因本体(gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)、基因集富集分析(gene set enrichment analysis,GSEA)探索生物途径。然后,通过受试者工作特征(receiver operator characteristic,ROC)曲线来评估其鉴别能力,并在GSE122063数据集中进行验证。此外,建立临床列线图和曲线进行临床应用评估。基于转录样本中不同细胞类型相对丰度算法(cell-type identification by estimating relative subsets of RNA transcripts,Cibersort)和单样本基因集富集分析(single-sample gene set enrichment analysis,ssGSEA)进行免疫细胞浸润分析。最后,运用Coremine Medical、Herb数据库进行中药和成分分析,并进行分子对接和动力学模拟。共筛选出1 360个DEGs和富半胱氨酸和甘氨酸的蛋白质1(cysteine and glycine rich protein 1,)、胶质纤维酸性蛋白(glial fibrillary acidic protein,)、白细胞介素4受体(interleukin 4 receptor,)、生长抑素(somatostatin,)、人核因子-κB抑制蛋白α(nuclear factor-kappa B inhibitor alpha,)5个生物标志物。GO分析显示AD与神经系统发育和细胞发育的正向调节高度相关;KEGG和GSEA富集结果显示AD与B细胞受体信号通路、糖胺聚糖生物合成途径等通路最为密切。免疫浸润分析显示AD脑组织内巨噬细胞、记忆B细胞、中心记忆CD8 T细胞等比例上升,初始CD4+T细胞、活化的CD8+T细胞、效应记忆CD8+T细胞比例下降,B2M、CD40等检查位点有明显差异。潜在靶向中药有人参、当归、厚朴花等82种,四气五味以温、寒、平、辛、苦、甘为主,归经以肝、肺、脾、胃经为主,功效以清热、活血、补虚居多。分子对接和动力学模拟显示20()-原人参二醇与标志物对接稳定。通过多种方法筛选出了AD的生物标志物,通过富集分析得到了AD相关的生物过程及信号通路,阐释了免疫相关机制,人参、当归、厚朴花等药食同源类中药有望成为AD新药开发的重要来源,为AD发病机制、临床治疗、药物研发提供新的思路。
阿尔茨海默病;加权共表达分析;机器学习;免疫浸润;生物标志物;人参;当归;厚朴花;20()-原人参二醇
阿尔茨海默病(Alzheimer’s disease,AD)又称原发性变性痴呆,常发生于老年人,是一种具有不可逆性和致死性的中枢神经系统退行性病变,常伴有进行性认知障碍、记忆缺陷、人格和行为改变等症状表现,严重影响患者的生活质量[1]。此外,临床上缺乏特异性的诊断标志物,许多AD患者在痴呆发病的前几年一般没有任何症状,无法准确诊断或采取预防措施,延误了诊断和治疗的最佳时机[2-3]。相关研究报告指出,全世界约有5 000万AD患者,到2050年,AD患者的数量将增加到1.52亿,导致高达9亿美元的经济负担,给社会和经济造成了严重的负担[4]。关于AD的确切病理机制尚不清楚,主要认为与老年斑、神经原纤维缠结和神经细胞死亡有关[5]。近年来,越来越多研究发现免疫炎症反应在AD的发生发展中起着重要作用,尤其是小胶质细胞、肥大细胞、巨噬细胞等免疫细胞作用显著[6-7]。小胶质细胞是中枢神经系统中一种特殊的固有免疫细胞,在脑炎症反应中起着主要作用。研究表明[8],M1小胶质细胞具有促炎作用,可分泌促炎因子来加重神经元损伤,如白细胞介素-1β(interleukin-1β,IL-1β)、IL-6和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)。相反,M2小胶质细胞可以通过分泌抗炎因子和特定的神经营养因子来调节脑微环境,促进组织修复,进而调节淀粉样斑块的靶向和清除。此外,大脑中淀粉样蛋白的异常沉积可与免疫细胞表型结合,如CD36、Toll样受体4(toll-like receptor 4,TLR4)和TLR6,也可导致促炎因子和趋化因子产生,激活颅内炎症,导致神经元损伤和AD进展的恶化[9-10]。因此,临床上在清除β-淀粉样蛋白(amyloid β-protein,Aβ)和微管相关蛋白-tau(microtubule-associated protein-tau,MAPT)等病理蛋白的基础上,同时多靶点调节大脑免疫系统有望成为AD治疗的潜在策略之一。当前大量文献证实机体免疫可调节AD,但在这些与AD相关的研究中系统分析核心基因、评估免疫细胞丰度差异、免疫基因和免疫细胞间相关性的研究相对较少。
临床上治疗AD的药物如美金刚胺、多奈哌齐等只能短期改善认知功能,治疗时间久,合并用药多,长期用药会产生头晕、恶心、腹泻、肝肾毒性等不良反应[11-12]。随着国内外治疗AD药物的研发遭遇瓶颈,中药研究给科研工作者提供了全新的思路和研究价值。黄连解毒汤、开心散、黑逍遥散等诸多复方是临床治疗AD的经典方剂,并且组成中药多数以药食同源类为主。研究证实,此类复方可以通过其有效成分改善胆碱能神经功能、减轻氧自由基损伤、抑制氧化应激和神经炎症反应,减少细胞凋亡等途径改善AD患者学习和记忆,高效低毒,具有明显的治疗优势[13-15]。到目前为止,国家已经公布了110种药食同源中药,然而对此类中药及其成分调节免疫改善AD的机制尚不明析,且仍有中药尚未发掘。因此,积极探索具有潜在治疗作用的靶向中药及化合物,归纳用药规律,不仅可以为AD的临床治疗提供更多选择,同时也可进一步发掘此类中药的药食价值。
基于上述认识,本研究利用生物信息学方法,从GEO数据库获取AD患者和正常人群的基因表达数据,采用加权基因共表达网络分析(weighted gene co-expression network analysis,WGCNA)、机器学习筛选免疫相关标志物,通过转录样本中不同细胞类型相对丰度算法(cell-type identification by estimating relative subsets of RNA transcripts,Cibersort)和单样本基因集富集分析(single-sample gene set enrichment analysis,ssGSEA)算法对AD的免疫浸润情况进行评估,最后通过Coremine Medical、Herb数据库预测靶向中药和化合物,并使用分子对接和动力学模拟做进一步验证,以期为AD的预防、治疗及保健食品研发提供参考依据。研究流程见图1。
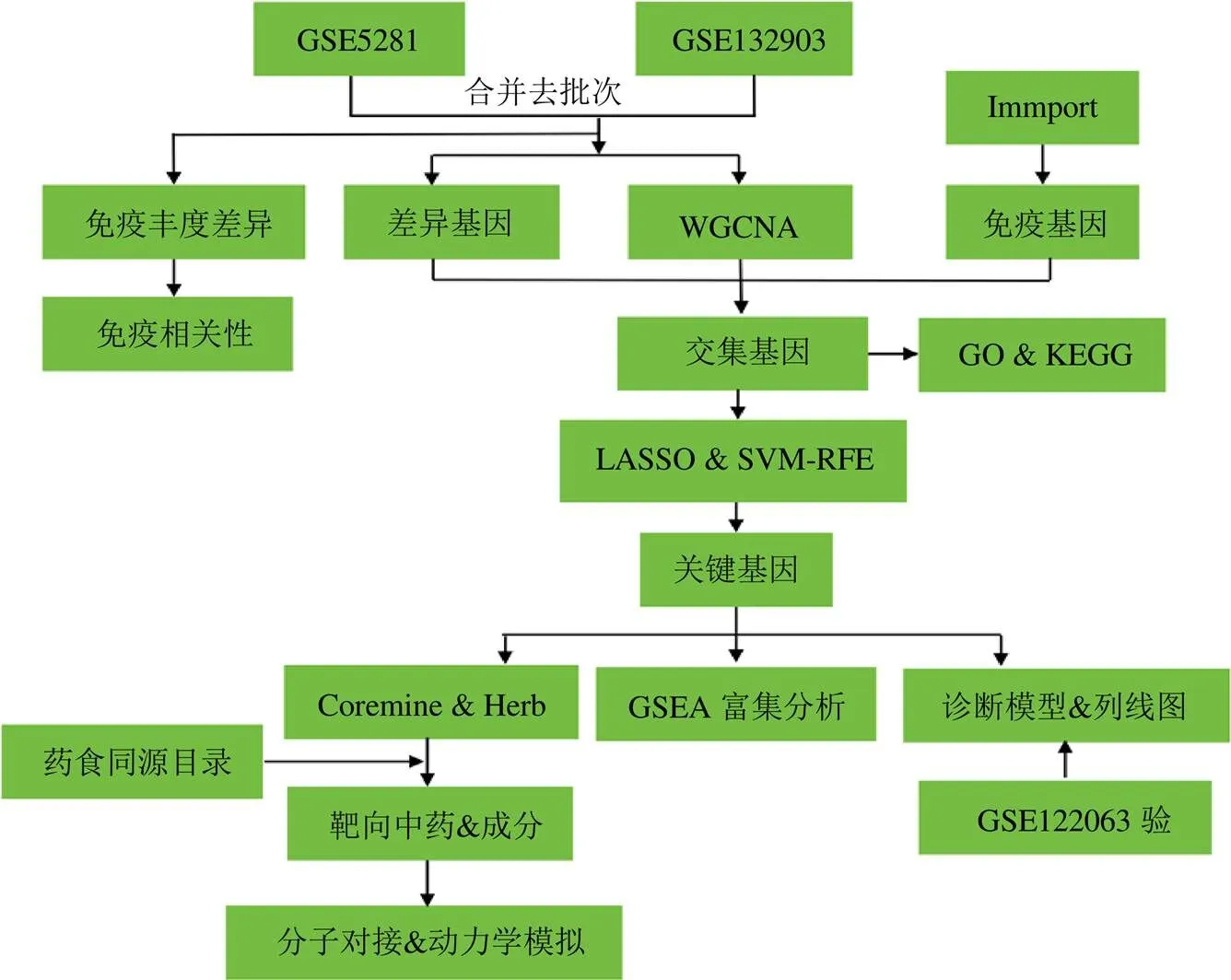
图1 研究流程图
1 材料和方法
1.1 数据的下载和处理
从基因表达综合数据库(Gene Expression Omnibus,GEO)中获得了3个原始数据集(GSE132903[16]、GSE5281[17]和GSE122063[18])。GSE132903基于GPL10558平台,包括97个AD患者和98个正常人(对照)样本;GSE122063基于GPL16699平台,包括56个AD患者和44个对照样本;GSE5281基于GPL570平台,包括87个AD患者和74个对照样本。随后,对每个数据集中的探针进行注释,并根据相应的平台注释文件转换为标准基因名。将GSE5281和GSE132903数据集的表达谱合并为训练集,并利用sva包调整批效应,用于后续的WGCNA和机器学习等分析。另外将GSE122063作为额外数据集用于验证。
1.2 免疫相关基因获取
ImmPort是目前权威较高的人类免疫基因数据库之一,可以下载数据进行有效分析。从ImmPort数据库(https://www.immport.org/home)下载人类免疫基因集,剔除重复基因后获得1 793个免疫相关基因(immune-realated genes,IRGs)。
1.3 差异表达基因(differentially expressed genes,DEGs)的分析
对数据集进行标准化、归一化处理后,使用“limma”R包分析AD和对照样本之间的差异基因。以差异表达倍数的绝对值大于0.5且值小于0.05为筛选标准。使用R软件ggplot2软件包和“复杂热图”分别绘制了火山图和热图,以显示显著调控的重要基因。
1.4 WGCNA
WGCNA是一种常用模块化分析技术,常用于识别和筛选复杂疾病生物标志物或药物靶点,鉴定高度协同变化基因表达矩阵,为研究疾病的潜在机制提供新方向。利用R软件中的“WGCNA”包构建了一个共表达网络[19]。使用合并数据集中方差前5 000个基因构建共表达网络,模块内最小基因数设置为30。随后将邻接矩阵转化为拓拓扑重叠矩阵(topological overlap matrix,TOM),构建多个基因模块及分层聚类树。最后,评估了每个模块与临床特征之间的相关性,计算模块基因显著性(gene significance,GS)以及模块显著性(module membership,MM)用以衡量基因与生物模块和临床信息的相关性、显著性,提取重要模块和基因用于后续分析。
1.5 枢纽免疫相关DEGs的鉴定
为了准确识别重要基因,将DEGs、WGCNA中的模块基因和IRGs取交集,以鉴定免疫枢纽基因集,为确保在两数据集中差异基因均含有枢纽基因,再次进行了交集运算,获取最终免疫枢纽基因,采用Venn图展示结果。随后,对免疫枢纽基因进行基因本体(gene ontology,GO)功能和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)富集分析,以分析相关生物功能和通路。
1.6 对诊断特征基因的机器学习
机器学习是处理高维复杂数据常用的工具之一。使用2种机器学习算法最小绝对收缩和选择算法(least absolute shrinkage and selection operator,LASSO)及机器学习-支持向量机递归特征消除(support vector machine-recursive feature elimination,SVM-RFE)进行特征基因预测。LASSO可以提升正则化来提高预测准确度的回归分析算法。使用R4.2.0软件的“glmnet”软件包开展LASSO回归分析。SVM是一是一种线性分类器,使用基于SVM的最大间隔原理训练样本,不断迭代,最后选出需要的特征数,使用“e1071”R包来识别具有最高鉴别能力的基因。
1.7 评估生物标志物对AD的诊断价值
使用R软件中的pROC包绘制受试者工作特征(receiver operating characteristic,ROC)曲线图,评估已确定的生物标志物的诊断价值。在验证数据集GSE122063中进一步验证候选标记物的表达水平及诊断效能。使用R软件中的“rms”包建立列线图进行综合风险分值评估,然后绘制校准曲线用于评估列线图模型的预测能力,最后使用R软件中的“rmda”包绘制遗传决策曲线和临床影响曲线评估模型的临床决策和效用价值。
1.8 基因集合富集分析
基因集富集分析(gene set enrichment analysis,GSEA)是使用快速GSEA R包来阐明特征基因的生物学意义。为了实现每个分析的标准化富集分数,进行1 000次的基因集排列。错误发现率(false discovery rate,FDR)<0.05为显著富集。
1.9 免疫细胞亚型的丰度及表达差异评价
使用Cibersort反卷积算法和ssGSEA分析免疫浸润细胞的丰度和相关性。Cibersort方法主要依赖于LM22的免疫细胞亚型表达矩阵,使用Ciber Sort R脚本对其矩阵进行定性和定量分析。ssGSEA算法基于TISIDB网站获得28种免疫相关基因集进行丰度计算。通过Wilcoxon秩和检验分析组间免疫细胞的丰度差异及比较37个免疫检查位点差异。基于ssGSEA的分析结果,分析特征基因与免疫细胞种类的相关性,以<0.05为筛选标准,使用corrplot包绘制图形。
1.10 潜在靶向中药预测分析与核心成分鉴定
将核心基因导入Coremine Medical数据库(http://www.coremine.com/medical/),以<0.05为标准筛选具有潜在治疗作用的中药,统计潜在中药的功效、四气、五味、归经,供临床用药参考。以国家卫生健康委员会颁布及后续补充的药食同源中药名单对中药分类后,构建“基因-中药”靶向网络,筛选度(degree)值排名前5的中药作为核心中药进行后续分析。将核心中药导入本草组鉴数据库(http://herb.ac.cn)中查询化学成分,使用Network Analyzer推算拓扑参数分析,参考中心度(betweenness centrality)、紧密中心度(closeness centrality),以节点连接度值(degree)排序前15位成分初筛确定核心成分。导入Swiss ADME数据库(http://www.swissadme.ch)进行类药性评估,以肠道通透性为“High”,类药性五原则至少有2个“Yes”进行再次筛选确定关键成分。
1.11 分子对接和分子动力学模拟
将筛选得到的关键成分与靶点进行分子对接,从PubChem下载关键成分的3D结构。从PDB数据库中获取核心靶点的分子结构,用PyMol软件删除水分子和原配体。对接过程采用AutoDock Tools1.5.6软件对蛋白添加氢,计算电荷。随后采用AutoDock Vina进行分子对接,根据结合能≤−5.5 kJ/mol作为筛选标准,对结果进行排序,选择最佳对接组合进行动力学模拟。将对接结果的蛋白与小分子配体分离,通过Ambertools软件中的antechamber工具生成小分子力场文件,通过acpype软件工具将小分子力场文件转换为gromacs力场文件。小分子采用GAFF力场,蛋白采用AMBER14SB力场和TIP3P水模型,合并蛋白和小分子配体的文件,构建复合物的模拟体系。
采用Gromacs2022程序进行分子动力学(molecular dynamics,MD)模拟,在恒温、恒压以及周期性边界条件下进行。在MD模拟过程中,所有涉及氢键采用线性约束求解器(linear constraint solver,LINCS)算法进行约束,积分步长为2 fs。静电相互作用采用PME(particle-mesh Ewald)方法计算,截断值设为1.2 nm。非键相互作用截断值设为10 Å(1 Å=0.1 nm),每10步更新1次。采用V-rescale温度耦合方法控制模拟温度为298 K,采用Berendsen方法控制压力为1 bar(1 bar=100 kPa)。在298 K下,进行100 ps的恒定原子数、体积、温度(constant atoms,volume,temperature,NVT)系综与恒定原子数、压力、温度(constant atoms,pressure,and temperature,NPT)系综平衡模拟,并对复合物体系进行100 ns的MD模拟,每10 ps保存1次构象。模拟完成后,使用视觉分子动力学(visual molecular dynamics,VMD)软件和pymol对模拟轨迹进行分析,使用g_mmpbsa程序采用分子力学泊松-玻尔兹曼表面积法对蛋白和小分子配体之间进行结合自由能分析。
2 结果
2.1 阿尔茨海默病脑组织中DEGs的鉴定
GSE132903数据集基于GPL10558平台,包含97个AD样本和98个对照样本;GSE5281数据集基于GPL570的平台,包括87个AD样本和74个对照样本。经过预处理并去除批处理效应后,共获得1 360个DEGs,其中AD样本中有612个上调基因,748个下调基因,热图见图2-A,火山图见图2-B。
2.2 共表达网络的构建与模块鉴定
使用R包“WGCNA”构建基因共表达网络分析。首先对样本进行聚类,以保证后续分析的准确性。为保证基因间相互作用最大限度符合无尺度分布,对数据进行软阈值的确定,如图3-A所示,根据R软件计算得到最佳软阈值,确定为3,即此时的图3-A(左)的纵坐标2接近0.9。基于最优软阈值,按照混合动态剪切树算法识别AD不同基因模块(图3-B),将变异排名前5 000个基因聚类并合并为9个共表达模块(图3-C),采用Pearson相关分析,探讨模块特征基因与临床性状的相关性。结果显示,各模块与临床特征相关性一般,其中绿松石模块相比于其他模块相关性较高(cor=0.49,<0.01),见图3-C。此外,绿松石模块基因显著性与模块隶属度分析显示,两者高度关联(cor=0.83,<0.01),因此取该模块为重要模块,共2 552个基因用于后续分析(图3-D)。
2.3 枢纽免疫相关基因的功能富集分析
将WGCNA鉴定的重要基因模块绿松石、DEGs、IRGs取交集,共获取72个基因(IRHUB),为了保证在2个数据集差异基因中均含有关键基因,再次进行了交集运算,共识别出24个枢纽基因用于后续分析,如图4-A所示。生物功能富集显示与神经发生的正向调节(GO:0050769)、神经系统发育的正向调节(GO:0051962)、细胞发育的正向调节(GO:0010720)、神经发生的调节(GO:0050767)有关;分子功能富集主要涉及激素结合(GO:0042562)、受体配体活性(GO:0048018)、信号受体激活物活性(GO:0030546)、激素活性(GO:0005179)、肽结合(GO:0042277)等功能;在细胞成分方面,镁依赖蛋白丝氨酸/苏氨酸磷酸酶复合物(GO:0005963)、Z盘(GO:0030018)、肌膜(GO:0042383)、I带(GO:0031674)、局灶黏附(GO:0005925)等在AD的免疫调控中发挥了重要作用(图4-B)。在KEGG分析中(图4-C),富集通路主要分布在B细胞受体信号通路(hsa04662)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路(hsa04010)、T细胞受体信号通路(hsa04660)等多条通路中,说明免疫调控在AD的发病机制发挥了重要作用,为未来AD的研究提供了潜在的靶点和通路。

A-热图;B-火山图。
2.4 AD中免疫相关诊断特征生物标志物的识别
采用2种机器学习方法LASSO回归和SVM-RFE来探索AD的潜在标志物。LASSO回归方法分析出17个AD特征基因(图5-A、B);SVM-RFE算法分析得到5个AD的特征基因(图5-C、D)。2种算法与24个枢纽基因进行交集运算,最终得到5个共同基因作为AD免疫特征相关的枢纽基因富半胱氨酸和甘氨酸的蛋白质1(cysteine and glycine rich protein 1,)、胶质纤维酸性蛋白(glial fibrillary acidic protein,)、白细胞介素4受体(interleukin 4 receptor,)、生长抑素(somatostatin,)、人核因子-κB抑制蛋白α(nuclear factor-kappa B inhibitor alpha,)(图5-E)。
2.5 诊断标志物的表达水平和诊断意义
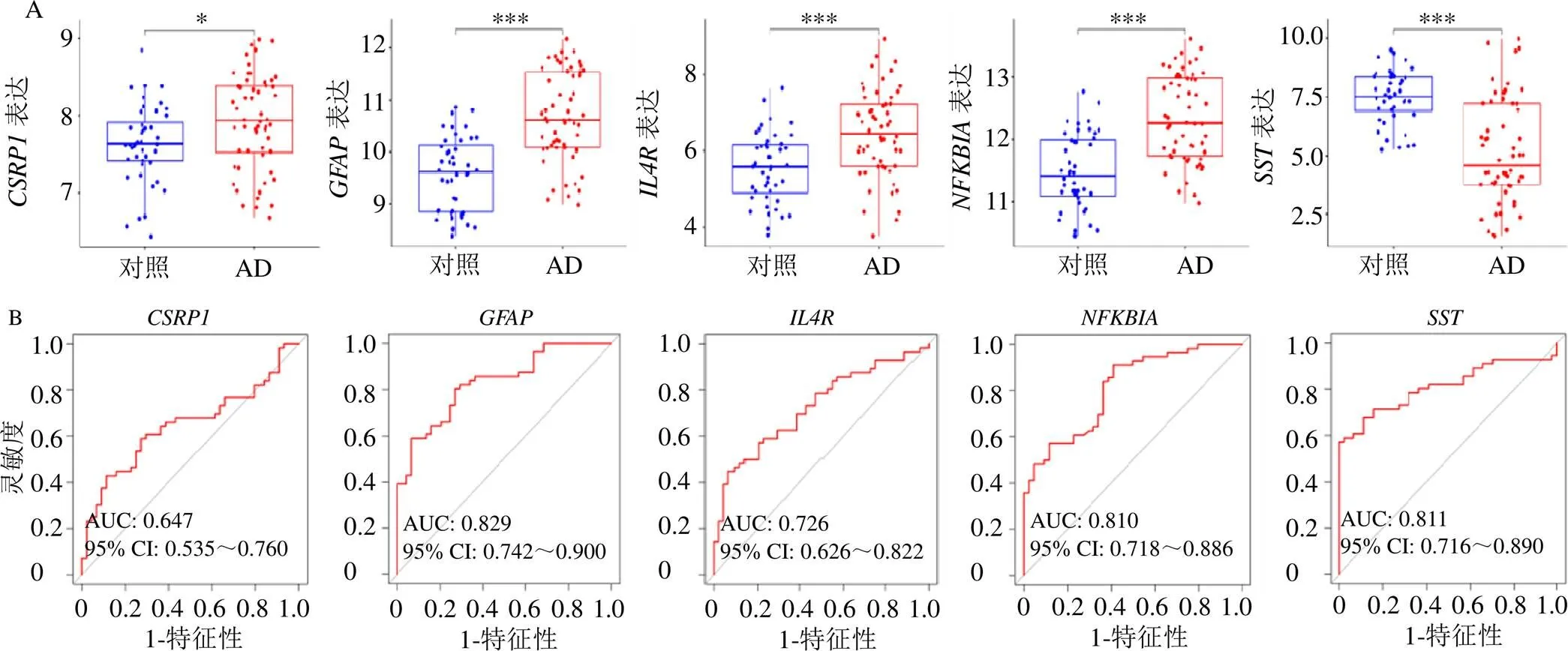
如图6-A所示,通过ROC曲线分析,的曲线下面积(area under urve,AUC)为0.731[95%可信区间(confidence interval,CI)=0.678~0.782],的AUC为0.813(95% CI=0.767~0.856),的AUC为0.695(95% CI=0.644~0.748),的AUC为0.853(95% CI=0.812~0.892),的AUC为0.811(95% CI=0.764~0.855),显示了这5个基因作为AD潜在标志物可靠的诊断效能。此外,与对照组相比,AD患者脑组织样本中、、的表达水平上调,表达水平下调(图6-B)。
2.6 AD潜在生物标志物外部数据集验证
为了验证上述结果的准确性和可靠性,使用外部数据集(GSE122063)对上述5个枢纽基因(、、、、)进行了验证。结果显示,与对照组相比,AD患者的、、、、的表达水平与在训练集基因中观察到的表达趋势一致(图7-A)。此外,诊断模型分析显示(图7-B),5个标志物的AUC均大于0.6,表明具有可靠的诊断价值。
2.7 AD潜在标志物列线图模型预测结果
本研究构建了诊断标志物的列线图模型来预测AD的发病风险。校准曲线、决策曲线和临床效应曲线如图8所示。通过计算模型中特征的总分,可以得出患AD的风险,这为AD的诊断提供了一些新的策略(图8-A)。校准曲线显示了列线图模型预测与理想模型拟合较好,具有良好的可靠性(图8-B)。临床决策曲线中彩色曲线表示的诊断标志物模型远离全部(all)和无(none)曲线,表明基于模型的决策对AD患者有较大的临床益处(图8-C)。此外,临床效应曲线显示了列线图模型具有显著的预测能力(图8-D)。
2.8 枢纽基因的通路分析结果
GSEA富集分析结果显示,这些标志物参与AD发生发展的多条通路,主要涉及免疫排斥反应、氨基酰-tRNA合成酶合成、基础转录因子调控、慢性髓系白血病、糖胺聚糖生物合成途径、Hippo经典信号通路、尼古丁成瘾、Notch信号通路、逆行内源性大麻素记忆信号通路、氧化应激、钙离子调节通路、病毒蛋白-细胞因子串扰、免疫缺陷等多条通路。其中糖胺聚糖生物合成途径、Hippo经典信号通路、尼古丁成瘾等通路均在5个枢纽基因中显著富集,可能在AD免疫调节密切关联(图9)。
2.9 免疫细胞浸润分析
使用Cibersort、ssGSEA评估了AD患者和对照组的免疫丰度,如图10-A、B所示。Cibersort结果显示,AD患者组织中M1巨噬细胞、静息态记忆CD4+T细胞具有较高的比例,而初始CD4+T细胞有所减少。ssGSEA结果显示,AD患者组织中CD56明亮自然杀伤细胞、未成熟B细胞、未成熟的树突状细胞、髓源性抑制细胞、巨噬细胞、肥大细胞、自然杀伤T细胞、中性粒细胞、浆细胞样树突状细胞、滤泡辅助T细胞、辅助性T细胞1、辅助性T细胞17、记忆B细胞、中心记忆CD8+T细胞比例上升,活化的CD8+T细胞、嗜酸性粒细胞、中心记忆CD4+T细胞、效应记忆CD8+T细胞比例下降。
基于Cibersort、ssGSEA 2种方法创建了相关性热图来探索多种免疫细胞之间的差异相关性。如图10-C、D所示,橙色越深代表正相关性越高,蓝色越深代表负相关性越高。基于Cibersort结果,负相关性较高的组合有M0巨噬细胞与M2巨噬细胞、记忆B细胞与初始B细胞、静息自然杀伤细胞与活化自然杀伤细胞等,正相关性较高的组合有M0巨噬细胞与静息肥大细胞、M2巨噬细胞与中性粒细胞、M0巨噬细胞与静息记忆CD4+T细胞等。基于ssGSEA结果,负相关性较高的组合有自然杀伤细胞、自然杀伤T细胞、CD56昏暗自然杀伤细胞与效应记忆CD8+T细胞等。基于ssGSEA的分析结果进一步探索了枢纽基因与免疫细胞之间的相关性(图10-E),结果表明,枢纽基因与多种免疫细胞之间存在较强相关性,、、均与自然杀伤细胞、自然杀伤T细胞、记忆B细胞呈正相关。、、均与效应记忆CD8+T细胞、活化CD4+T细胞呈负相关。与自然杀伤细胞、骨髓来源的抑制性细胞、活化树突状细胞呈正相关,与效应记忆CD8+T细胞呈负相关。然而与效应记忆CD4+、CD8+T细胞和活化CD4+T细胞呈正相关,与自然杀伤细胞、自然杀伤T细胞、记忆B细胞呈负相关。免疫检查位点分析显示(图10-F),AD组脑组织中B2M、CD274、CD28、CD40、CD8A等18个免疫检查位点与对照组具有明显差异,故AD可能与免疫细胞检查位点的激活进而引起炎症反应有关。
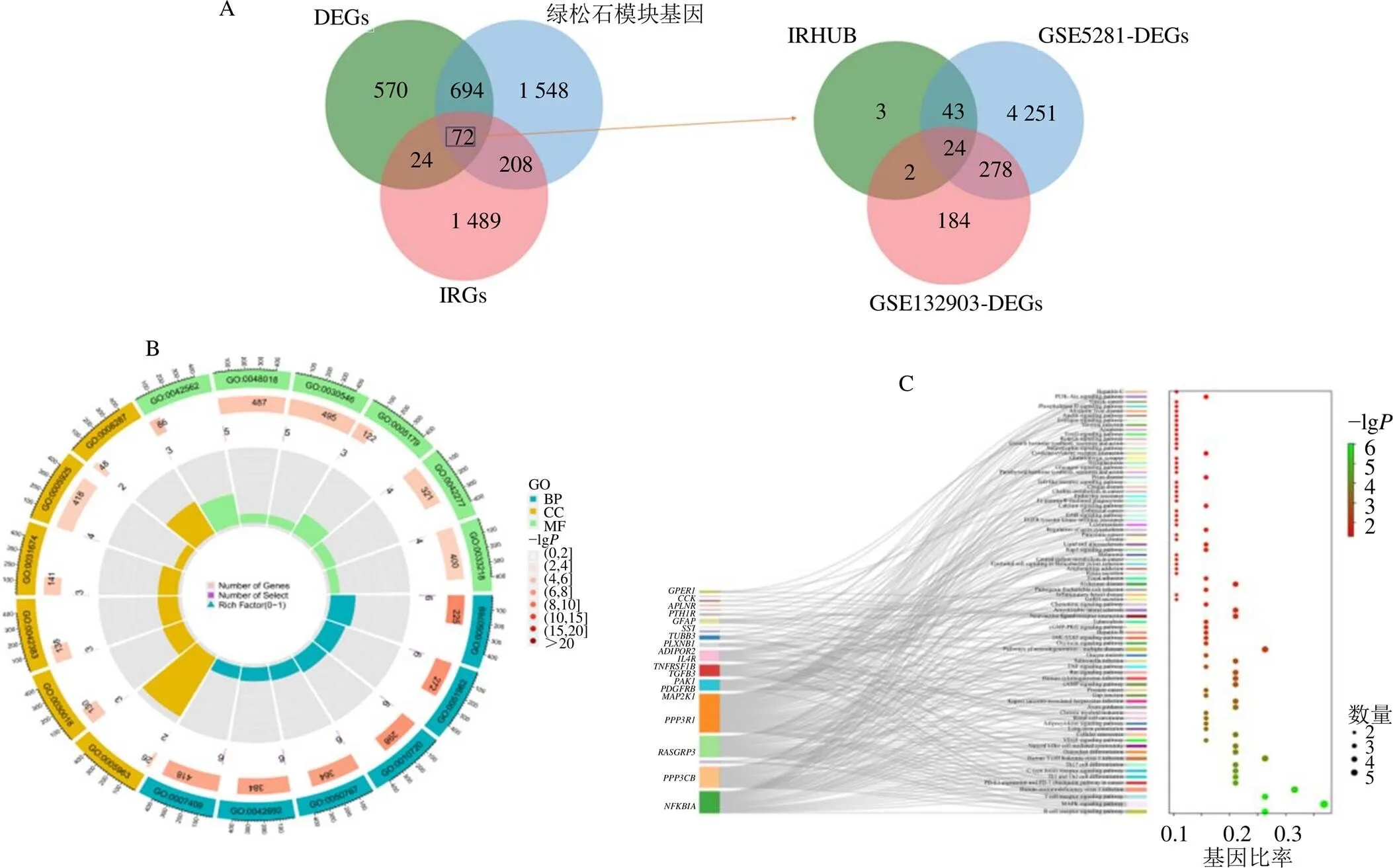
A-免疫基因的筛选;B-GO功能富集分析;C-KEGG通路富集分析。
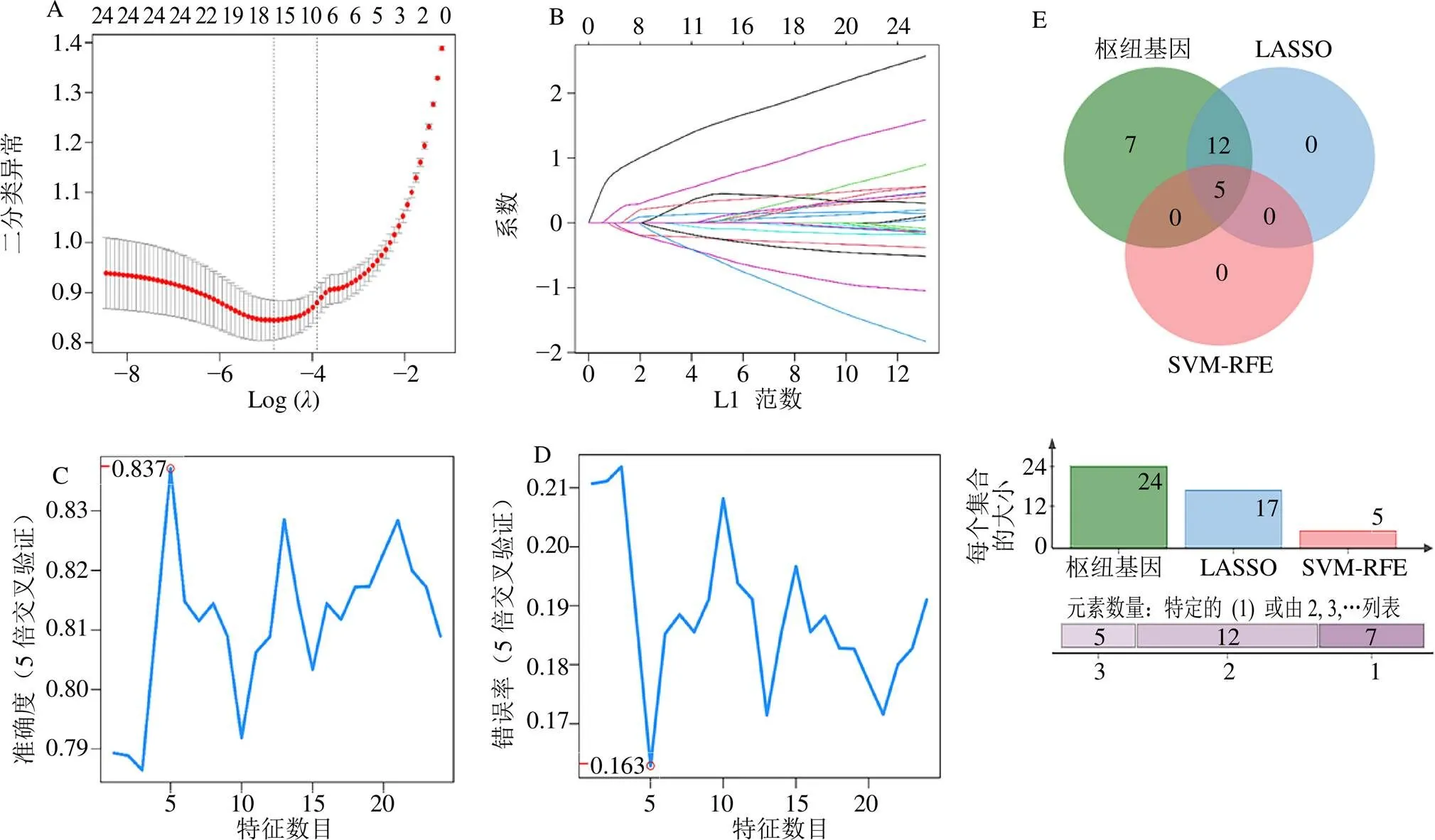
A、B-LASSO回归分析结果;C、D-SVM-RFE分析结果;E-枢纽基因、LASSO、SVM-RFE交集结果。
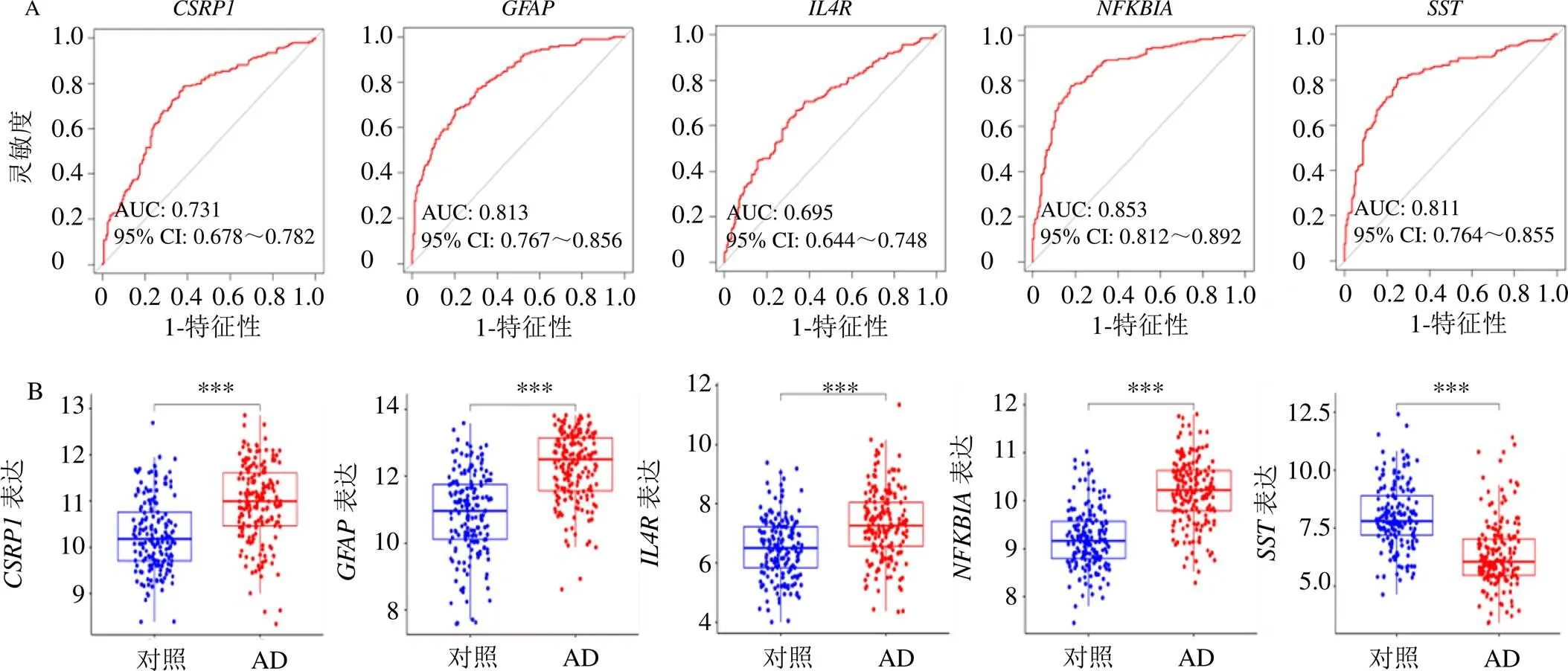
A-5种标志物的受试者工作特征曲线;B-5种标志物的表达水平;***P<0.001。
A-GSE122063中5种标志物的受试者工作特征曲线;B-GSE122063中5种标志物的表达水平;*P<0.05 ***P<0.001。

A-基于5种标志物的列线图模型;B-列线图模型的校正曲线;C-列线图模型的临床决策曲线;D-列线图模型的临床影响曲线。

图9 5个潜在标志物GSEA富集分析结果
2.10 对AD枢纽基因潜在靶向中药的预测与分析
将、、、、5个枢纽基因导入Coremine数据库中,以<0.05筛选潜在的靶向中药(图11),其中匹配到蓖麻子、娑罗子、血竭、石菖蒲、当归等25味中药;匹配到石龙子、木鳖子2味中药;匹配到玉米须、菊苣2味中药;匹配到旋覆花、金沸草、石斛、甘草、泽兰等59味中药;未匹配到中药,查阅Coremine Library中文献发现人参、参芦、参叶、参花对均有一定靶向调控作用,故作为潜在中药纳入分析。查阅《中华本草》及文献对上述中药的功效、四气五味、归经进行分析,潜在靶向中药四气以温、寒、平为主,五味以辛、苦、甘比例较大,功效以清热、活血、补虚为主,归经以肝、肺、脾、胃经居多。参考国家药食同源目录进行分类,药食同源类中药有菊苣、枸杞子、西红花、白果、甘草、夏枯草等12味,保健食品产业可添加的有丹参、厚朴花、银杏叶、川芎、远志、石斛等12味,两者均符合的有当归、人参、玫瑰花3味中药。选取度值(degree)排名前5的中药作为关键中药,最后筛选出人参、当归、厚朴花、远志、玫瑰花5味中药(表1)。
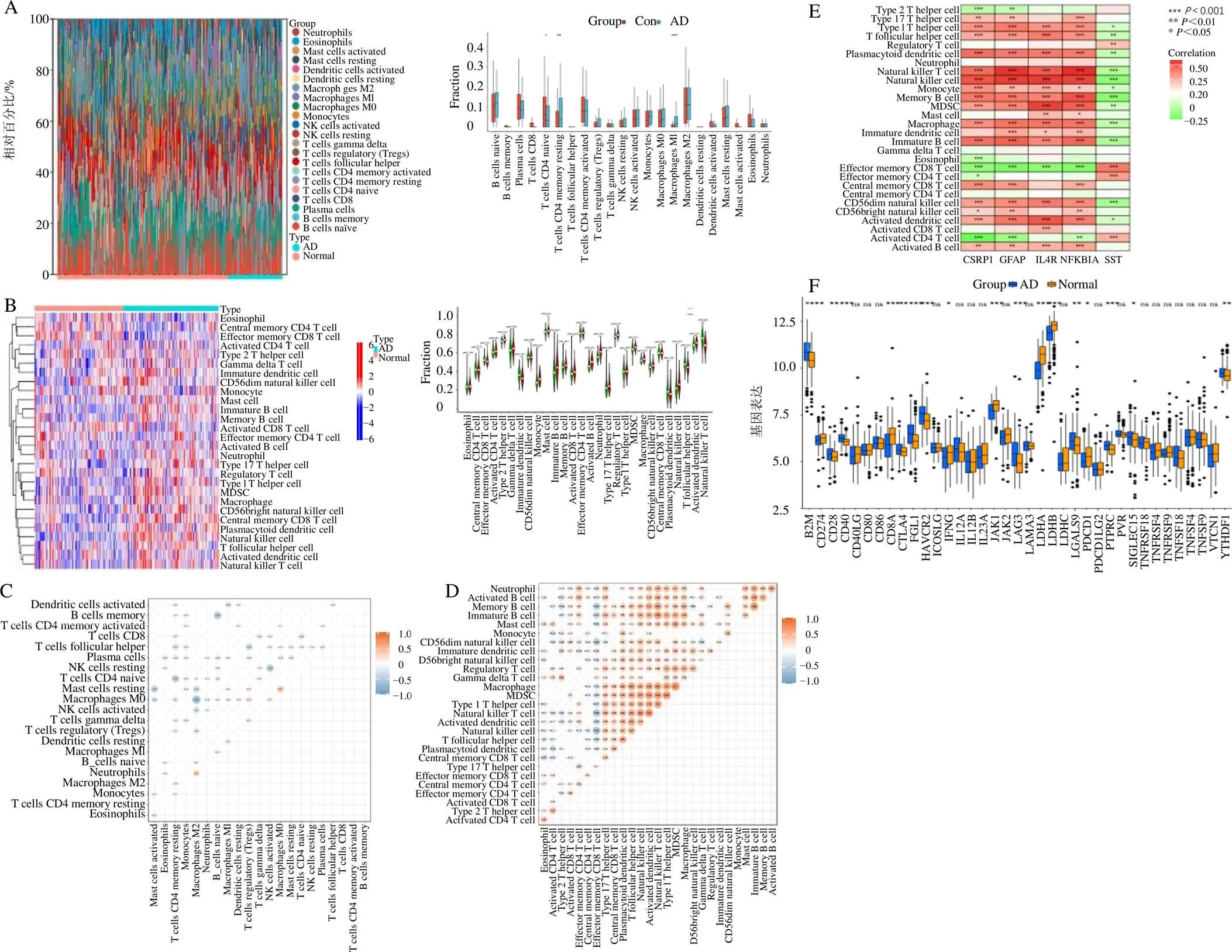
A-基于Cibersort的22种免疫细胞的丰度差异;B-基于ssGSEA的28种免疫细胞的丰度差异;C-基于Cibersort的22种免疫细胞类型相关性分析,橙色表示正相关,蓝色表示负相关;D-基于ssGSEA的28种免疫细胞类型相关性分析,橙色表示正相关,蓝色表示负相关;E-基于ssGSEA的5种标志物与28种免疫细胞相关性分析,红色表示正相关,绿色表示负相关;F-对照组vs AD组37种免疫检查位点分析,*P<0.05 **P<0.01 ***P<0.001。
2.11 分子对接与分子动力学模拟
将核心中药导入本草组鉴中查询化学成分,初步获取939个化合物,经参数标准和Swiss ADME数据库筛选后确定香茅醛(CID:7794)、香芹酚(CID:10364)、异丁香酚(CID:853433)、庚醛(CID:8130)、20()-原人参二醇(CID:11213350)5种成分进行对接(表2)。由图12-A可知,发现20()-原人参二醇、香芹酚、异丁香与枢纽靶点受体之间有较好的结合活性、对接稳定,选择最佳的-20()-原人参二醇进行动力学模拟。由图12-B可知,小分子的均方根偏差(root mean square deviation,RMSD)保持稳定,复合物和蛋白的RMSD初期存在波动,中期逐渐稳定,后期存在较小的波动。此外,小分子与蛋白的距离、小分子与初始结合位点的距离在模拟初期存在较大的波动,然后逐渐保持稳定,这表明复合物逐渐到达稳定状态(图12-C)。由图12-D可知复合物的回转半径(radius of gyration,Rg)逐渐稳定,表明复合物整体结构逐渐紧密稳健。均方根涨落(root mean square fluctuation,RMSF)分析显示前期蛋白柔性稳定,后期稍有波动,可能与蛋白调整构像有关(图12-E)。将两者的模拟构象进行叠合,复合物中的小分子的叠合构象均在初始结合位点附近,叠合程度高,进一步证明小分子与蛋白结构的稳定性,见图12-H。氢键结果显示,小分子与蛋白之间的氢键数量较低,且较为稳定,主要分布在0~2个(图12-F)。复合物中范德华力与静电相互作用在模拟过程中逐渐稳定,这表明小分子与蛋白的稳定结合。选取稳定状态下的复合物轨迹,使用MM-PBSA的方法计算,得到结合能相关能量项,其中ΔEele为小分子与蛋白之间的静电相互作用,值为(−136.118±0.777)kJ/mol。ΔEvdw为范德华相互作用,值为(−11.928±1.906)kJ/mol。ΔEpol为极性溶剂化能,可表示静电势能,值为(74.884±1.690)kJ/mol。ΔEnonpol为非极性溶剂化能,可表示疏水相互作用,值为(−18.333±0.126)kJ/mol。结合能(ΔEMMPBSA)为ΔEele、ΔEvdw、ΔEpol、ΔEnonpol之和,值为(−91.495±0.531)kJ/mol。ΔGbind为ΔEMMPBSA与−TΔS之和,值为(17.914±4.285)kJ/mol。通过分析发现,复合物的范德华力相互作用ΔEvdw远高于静电相互作用能ΔEele和疏水相互作用ΔEnonpol,ΔEvdw为ΔEele的11.4倍,ΔEvdw为ΔEnonpol的7.4倍。范德华力ΔEvdw发挥主要作用,静电相互作用ΔEele和疏水相互作用ΔEnonpol发挥补充作用。小分子与蛋白的结合能高,二者的亲和力高。进一步对ΔEMMPBSA进行分解,获取各氨基酸对整体结合能的贡献,蛋白中对各自结合能贡献较大的残基如图12-I、J所示,蛋白中结合小分子的关键氨基酸有16ILE、10VAL、18THR、62HIE、99ARG、12ASP、64LEU、96VAL、155SER、17SER等。
*ΔGbind=ΔEvdw+ΔEele+ΔEpol+ΔEnonpol−TΔS

A-候选标志物-靶向中药网络;B-中药功效统计分析;C-中药四气统计分析;D-中药五味统计分析;E-中药归经统计分析。
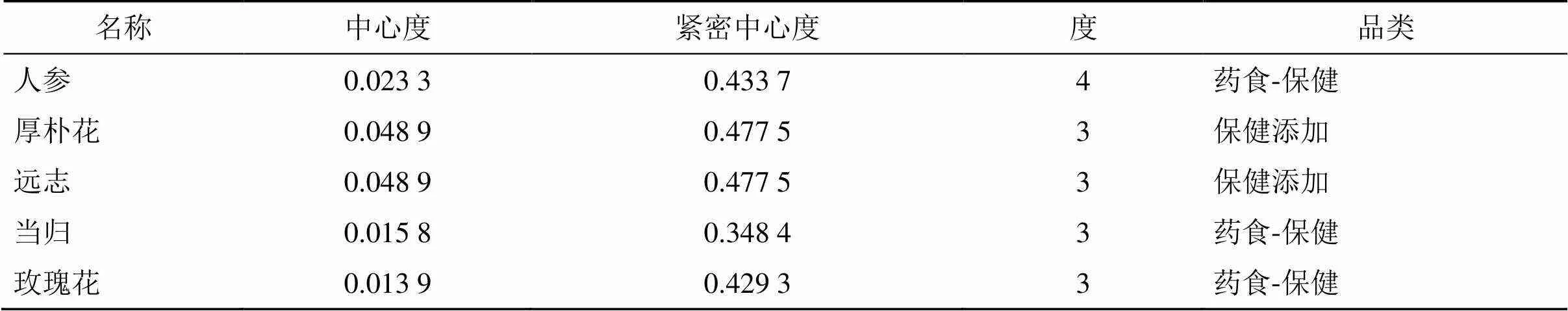
表1 核心中药前5位拓扑参数
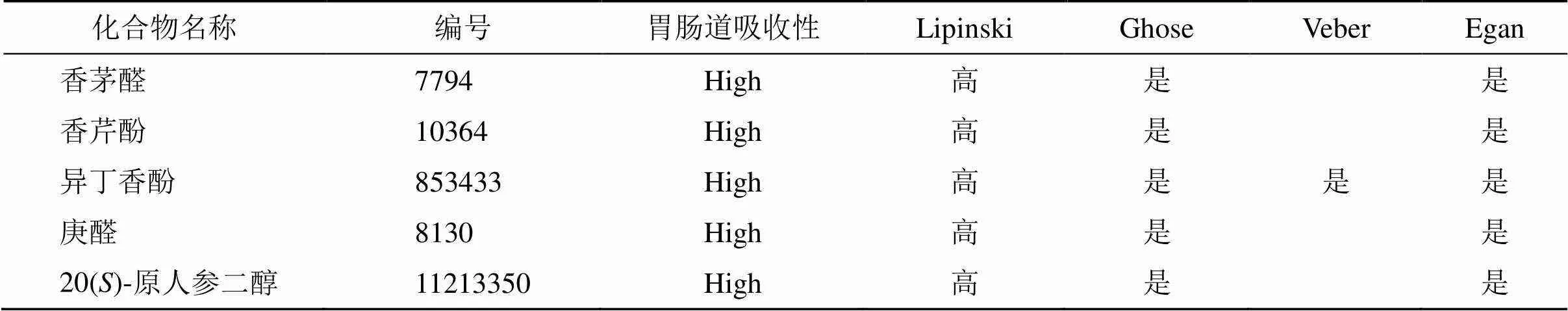
表2 核心化合物ADME参数

A-分子对接;B-RMSD分析;C-质心演变分析;D-Rg分析;E-RMSF分析;F-氢键数量分析;H-小分子结合位点分析;I-结构分析;J-残基贡献分析。
3 讨论
AD是一种以认知功能下降和记忆能力减退为主要临床表现的一种神经退行性疾病,目前发病机制仍不清楚。免疫机制与AD的发生及发展密切相关。然而,当前在AD研究领域中,关于免疫相关基因的潜在标志物及对应治疗中药方面的报道相对较少,故本研究采用生物信息学方法、机器学习、分子对接、动力学模拟4种方法综合分析了AD中免疫相关的诊断标志物、浸润模式、生物途径、靶向中药及核心成分预测。
3.1 CSRP1、GFAP、SST、IL4R及NFKBIA是AD免疫相关机制中的核心分子
本研究识别出AD患者5个与对照组具有表达差异的免疫标志物CSRP1、GFAP、SST、IL4R及NFKBIA,与AD的发生发展具有密切关系。因此对其功能与相关调控机制的深入探索有助于加强对AD免疫相关机制的理解,为AD的治疗带来新方向。
研究表明,CSRP1是半胱氨酸和甘氨酸富含蛋白质家族的成员,在细胞结构、细胞黏附、增殖、运动中发挥了重要作用[20]。目前关于CSRP1与AD发病机制的报道较少,郭晨旭等[21]研究发现,CSRP1可以影响肿瘤患者的免疫浸润进而影响机体免疫稳态。因此靶向CSRP1进而调控AD患者的免疫微环境改善病情有望成为潜在的治疗策略。GFAP是一种主要存在于大脑星形胶质细胞中的结构蛋白,是胶质细胞活化和脑损伤或疾病中的重要标志物[22]。临床研究显示,患者血液中检测到高水平GFAP,脑内病理性Tau蛋白会经历更严重的发展,可以作为AD临床确诊前的判断依据,这与本研究研究结果是一致的[23]。SST是一种广泛分布于人类中枢神经系统和外周组织的抑制性激素。Han等[24]发现生长抑素遇到铜、Aβ和金属-Aβ复合物时,会产生大量聚集,以减弱金属-Aβ复合物的毒性和聚集为主,进而减轻大脑毒性损害。IL4R是是一种受体蛋白,能够与IL4结合,激活信号传导通路,从而调节脑内多种免疫细胞的功能。有研究报道IL4主要在神经元和小胶质细胞/巨噬细胞中响应Aβ-42而被激活,并通过神经干/祖细胞(neural stem/progenitor cell,NSPC)中的IL4受体进而诱导信号转导-转录活化因子6(signal transducers and activators of transcription 6,STAT6)磷酸化增加NSPC可塑性,可作为AD的药物治疗的候选靶点进一步研究[25]。NFKBIA是一种转录因子,可与核因子-κB(nuclear factor-κB,NF-κB)形成复合物,阻止NF-κB进入细胞核,进而影响免疫反应、凋亡、增殖等生物过程,介导AD的进展。此外,NFKBIA接受沉默信息调节因子1(silent information regulator 1,SIRT1)的调控,进而形成抗衰老的调控网络,延缓AD等退行性疾病的进展[25]。
3.2 免疫通路及炎症反应是AD发病机制中的重要环节
根据Cibersort和ssGSEA 2种免疫浸润结果及相关性分析,发现AD患者组织中M1巨噬细胞、静息态记忆CD4+T细胞、记忆B细胞、未成熟的树突状细胞、活化的CD8+T细胞、嗜酸性粒细胞、中心记忆CD4+T细胞、效应记忆CD8+T细胞等多种免疫类型细胞与AD生物过程密切相关,表明免疫细胞浸润在AD的发展过程中具有重要作用。据以往研究[26-27]报道,上述免疫细胞大多在AD中处于异常状态,可导致神经元退行性病变和AD病理状态的进一步恶化。此外,Aβ也会激活巨噬细胞,产生大量炎性细胞因子和毒性介质,形成神经炎症,并参与Tau蛋白的聚集和扩散[28]。本研究中的CD4+亚型Th1和Th17效应T细胞被证实可通过下调周围神经系统和中枢神经系统内调节性T细胞的作用,促进胶质细胞激活和神经炎症加剧导致AD的病理学发生改变,加重记忆障碍[29]。此外,Machhi等[30]发现相对于对照组,AD患者中初始B细胞比例下降,记忆B细胞增加,活化B细胞释放的高水平肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)促进AD脑内斑块的形成,与本研究免疫浸润结果较为一致。查阅归纳目前文献,发现近年对AD免疫因素的研究主要集中在T细胞、B细胞、星形胶质细胞、炎性因子等[31-32],这说明免疫浸润分析结果的可靠性与一致性,提示未来靶向关键基因、调控机体免疫稳态,进而改善AD的策略值得深入探索。本研究还对AD患者的37个免疫检查位点情况进行了分析,B2M、CD40、CD8A等多个免疫检查位点具有明显差异。目前关于靶向免疫检查位点治疗AD的文献相对较少,未来研究可进一步挖掘潜在标志物、显著免疫细胞及检查位点的关联价值。
富集分析发现免疫细胞的生物功能在B细胞、T细胞及神经发育等通路中显著富集,也揭示了免疫细胞趋化激活对AD发病及脑内神经元产生了重要的影响。GSEA结果发现尼古丁成瘾等通路、糖胺聚糖生物合成途径、Hippo经典信号通路与这些标志物密切关联。尼古丁成瘾通路被认为是AD药物的重要通路,通路中的乙酰胆碱受体可以控制乙酰胆碱的释放,发挥调节大脑中认知功能,拮抗Aβ毒性等作用[33],可能是治疗神经退行性疾病的新策略。糖胺聚糖合成途径产生的糖胺聚糖既可以与淀粉样前体蛋白(amyloidprecursor protein,APP)结合,促进APP的β分泌酶代谢途径,增加Aβ的含量;又可促进蛋白激酶对Tau蛋白的磷酸化修饰,从而诱导Aβ和Tau蛋白的累积与沉淀[34]。Hippo信号通路是哺乳动物中高度保守的通路,与组织和器官大小及细胞增殖、分化和凋亡密切相关。Wang等[35]发现调节Hippo通路中巨噬细胞刺激蛋白1(macrophage stimulating 1,MST1)可以直接抵抗和改善AD病理特征和临床症状,不需要依赖于清除Aβ。本研究发现5种标志物均与Hippo通路有关,后续可深入研究这些标志物与基因之间的调控关系,以期为AD防治提供新靶点。
3.3 预测的靶向中药及化合物为调节免疫治疗AD提供了参考依据
中医将AD归属于“痴呆”“健忘”“呆病”等范畴。近几年,由于中医药的临床和基础研究不断深入,中医药受到了众多科研工作者的关注。本研究对预测出的靶向中药进行药性分析后发现,四气以温、寒、平为主,五味以辛、苦、甘比例较大,功效以清热、活血、补虚为主,归经以肝、肺、脾、胃经居多。表明这些中药对关键基因的影响可能更为显著,这不仅与中医从扶正固本、调和脏腑出发,兼以化痰、祛瘀、补虚治疗AD一致[36-37],也与本研究团队前期基于肝脾论治AD相关研究吻合[38]。最终经参数筛选出人参、当归、厚朴花、远志、玫瑰花5味核心中药。
经过查阅文献,发现上述中药治疗AD已经得到了证实。研究报道指出,人参中已确定多种皂苷可以改善退行性疾病的学习和记忆,其中人参皂苷Rg1可能通过抑制核苷酸结合寡聚化结构域样受体蛋白1(nucleotide-binding oligomerization domain-like receptor protein 1,NLRP1)炎症体和自噬功能障碍来缓解Aβ沉积和AD进展[39]。叶长青等[40]研究表明,当归主要活性成分西托糖苷、β-谷甾醇、豆甾醇可能与蛋白激酶B1(protein kinase B1,Akt1)、前列腺素内-过氧化物合酶2(prostaglandin-endoperoxide synthase 2,PTGS2)、丝裂原活化蛋白激酶(mitogen-activated protein kinase 14,MAPK14)等关键靶点结合发挥抗AD的作用。厚朴花中的主要成分是厚朴酚、和厚朴酚[41],可以抑制活性氧生成、细胞内Ca2+浓度升高和半胱天冬酶活性,对抗β-淀粉样蛋白诱导的PC12细胞死亡,产生神经保护作用[42]。远志中的皂苷能够通过调节磷脂酰肌醇-3-羟激酶(phosphatidylinositol-3-hydroxykinase,PI3K)/Akt信号通路显著提高和延长转Tau基因果蝇AD模型的生存时间[43]。玫瑰花总黄酮能明显调控PI3K/Akt信号通路和内质网应激(endoplasmic reticulum stress,ERS)途径抑制神经细胞凋亡,发挥神经保护作用[44]。从诸多药理研究中不难发现这些中药均有靶向治疗AD的作用,因此临床上此类中药既可组方配伍,又可作为“援药”进行化裁,提高临床疗效[45]。企业及科研机构还可以基于“治未病”与“精准营养”[46]的思想,大力挖掘其中的药食价值,加强成果转化,开发多种形式产品,保障人民健康,发挥中医药优势。分子对接显示,(20)-原人参二醇与5个生物标志物对接稳定,具有良好的结合能力。将最佳对接结果IL4R-(20)-原人参二醇进行了动力学模拟验证,发现在模拟过程中,小分子与蛋白形成的氢键数量少而稳定,亲和力好,关键氨基酸有16ILE、10VAL、18THR、62HIE、99ARG、12ASP、64LEU、96VAL、155SER、17SER等,对接结合能高,范德华力相互作用远高于静电相互作用和疏水相互作用,范德华力发挥主要作用,静电相互作用和疏水相互作用发挥补充作用。相关研究[47-48]证实(20)-原人参二醇可以通过刺激分泌性糖蛋白(wingless/integrated,Wnt)/糖原合酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)/β-连环蛋白(β-catenin)通路,促进增强海马神经再生,抑制氧化应激,上调海马中早期生长反应因子(early growth responsive gene-1,Egr-1)、FBJ骨肉瘤癌基因(c-Fos)和Jun原癌基因(Jun proto-oncogene,c-Jun)等多种途径来改善AD模型小鼠的记忆障碍。上述模拟结果和文献报道说明(20)-原人参二醇与标志物相互作用良好,且具有较强的药效作用,可作为AD免疫标志物的靶向药物进一步研究,为AD的免疫治疗提供了新证据。
4 结论
本研究利用多种技术分析了AD免疫相关的标志物和浸润模式,通过关键基因富集分析得到了AD相关的生物过程及信号通路,为免疫调控AD提供了一定的依据,进一步明确了AD的发病机制。最后通过潜在标志物和药食同源目录,预测得到了药食同源中药及核心成分,对其药性功效进行了分析,丰富了中医药从微观机制治疗AD的理论内涵,为临床工作者及相关药企进一步研究AD的分子机制、药物设计、保健食品研发提供一定的参考依据。但本研究仍然存在以下不足:(1)初步合并了AD芯片对AD免疫相关基因进行了探索,后续工作应注重AD患者脑区分类,以期筛选更精确的标志物;(2)中药化合物数据库使用单一,后续可扩大数据库种类,以获得更为丰富的化合物数量进行预测筛选;(3)本研究基于生物数据库和模拟计算,故结果仍需实验及临床观察进一步验证。
利益冲突 所有作者均声明不存在利益冲突
[1] Sh Y, Liu B L, Zhang J H,. Application of artificial intelligence modeling technology based on fluid biopsy to diagnose Alzheimer’s disease [J]., 2021, 13: 768229.
[2] 张莹莹, 周义锋. 不同剂量多奈哌齐联合美金刚治疗阿尔茨海默病行为、精神失智有效性研究 [J]. 河北北方学院学报: 自然科学版, 2023, 39(8): 48-51.
[3] 金洪, 彭永, 饶桂兰, 等. 阿尔茨海默病药物治疗的研究进展 [J]. 国际神经病学神经外科学杂志, 2023, 50(1): 87-92.
[4] Cummings J, Zhou Y D, Lee G,. Alzheimer’s disease drug development pipeline: 2023 [J]., 2023, 9(2): e12385.
[5] 贾建平, 王舒衡. 阿尔茨海默病发病机制及治疗进展 [J]. 中风与神经疾病杂志, 2023, 40(5): 387-390.
[6] 张巍. 阿尔茨海默病与神经免疫炎症 [J]. 中国医刊, 2021, 56(1): 5-8.
[7] 陈凡, 王娜, 何夏萍. 炎性免疫参与阿尔茨海默病发病机制的研究进展 [J]. 神经疾病与精神卫生, 2022, 22(6): 452-456.
[8] 付海鑫, 王慧影, 张良, 等. 神经变性疾病与神经炎症:小胶质细胞和星形胶质细胞的作用 [J]. 中风与神经疾病杂志, 2023, 40(9): 859-864.
[9] Hampel H, Hardy J, Blennow K,. The amyloid-β pathway in Alzheimer’s disease [J]., 2021, 26(10): 5481-5503.
[10] Trudler D, Nazor K L, Eisele Y S,. Soluble α-synuclein–antibody complexes activate the NLRP3 inflammasome in hiPSC-derived microglia [J]., 2021, 118(15): e20250847.
[11] Wang T, Kuang W H, Chen W,. A phase II randomized trial of sodium oligomannate in Alzheimer’s dementia [J]., 2020, 12(1): 110.
[12] 王亚兵, 袁跃彬, 张艳丽. 养血清脑颗粒联合多奈哌齐治疗阿尔茨海默病伴失眠临床观察 [J]. 实用中医药杂志, 2022, 38(4): 616-618.
[13] 董秤均, 曹蠡馨, 屈艳秦, 等. 黄连解毒汤对阿尔茨海默病大鼠海马NLRP3炎症通路的影响 [J]. 中药药理与临床, 2021, 37(6): 7-13.
[14] 单晓晓, 周乐乐, 李大伟, 等. 经典名方开心散治疗阿尔茨海默病的机制研究进展 [J]. 中草药, 2023, 54(11): 3685-3695.
[15] 王虎平, 米彩云, 吴红彦. 逍遥散系列经典名方防治阿尔茨海默病的研究进展[J]. 世界科学技术—中医药现代化, 2021, 23(12): 4419-4425.
[16] Piras I S, Krate J, Delvaux E,. Transcriptome changes in the Alzheimer’s disease middle temporal gyrus: Importance of RNA metabolism and mitochondria-associated membrane genes [J]., 2019, 70(3): 691-713.
[17] Liang W S, Dunckley T, Beach T G,. Altered neuronal gene expression in brain regions differentially affected by Alzheimer’s disease: A reference data set [J]., 2008, 33(2): 240-256.
[18] McKay E C, Beck J S, Khoo S K,. Peri-infarct upregulation of the oxytocin receptor in vascular dementia [J]., 2019, 78(5): 436-452.
[19] 卓桂锋, 陈炜, 朱健敏, 等. 血管性痴呆铜死亡关键差异基因的生物信息学分析及防治中药筛选 [J]. 中草药, 2023, 54(21): 7120-7129.
[20] Kadrmas J L, Beckerle M C. The LIM domain: From the cytoskeleton to the nucleus [J]., 2004, 5(11): 920-931.
[21] 郭晨旭, 李发展, 刘斌, 等. 基于生物信息学分析CSRP1基因在胃癌中的表达及其与免疫细胞浸润的关系[J]. 河南医学研究, 2022, 31(14): 2506-2511.
[22] 曹艳, 李恒希, 李佳丽, 等. 创伤性脑损伤大鼠不同脑区胶质纤维酸性蛋白表达的变化 [J]. 安徽医科大学学报, 2023, 58(11): 1828-1832.
[23] Benedet A L, Milà-Alomà M, Vrillon A,. Differences between plasma and cerebrospinal fluid glial fibrillary acidic protein levels across the Alzheimer disease continuum [J]., 2021, 78(12): 1471-1483.
[24] Han J, Yoon J, Shin J,. Conformational and functional changes of the native neuropeptide somatostatin occur in the presence of copper and amyloid-Β [J]., 2022, 14(9): 1021-1030.
[25] Bhattarai P, Thomas A K, Cosacak M I,. IL4/STAT6 signaling activates neural stem cell proliferation and neurogenesis upon amyloid-β42 aggregation in adult zebrafish brain [J]., 2016, 17(4): 941-948.
[26] 聂桂元, 张楚洁, 吴佳, 等. 基于网络药理学方法探究药对人参-熟地黄抗衰老的作用及分子机制 [J]. 中医临床研究, 2021, 13(10): 1-10.
[27] 孟凡巍, 姚丽芬. T细胞免疫浸润在阿尔茨海默病中的作用研究进展 [J]. 中国临床神经科学, 2021, 29(2): 213-216.
[28] 李铭麟, 崔檬, 王佳贺. 巨噬细胞与阿尔茨海默病相关性的研究进展 [J]. 实用老年医学, 2022, 36(1): 95-99.
[29] 米彩云, 王虎平. 阿尔茨海默病免疫炎症机制的研究进展 [J]. 中国老年学杂志, 2022, 42(11): 2837-2841.
[30] Machhi J, Yeapuri P, Lu Y M,. CD4+effector T cells accelerate Alzheimer’s disease in mice [J]., 2021, 18(1): 272.
[31] 刘海萍, 王斌, 张蓓, 等. 适应性免疫在阿尔茨海默病中的作用 [J]. 中国免疫学杂志, 2022, 38(15): 1913-1917.
[32] 刘娟, 肖青青, 李会, 等. 阿尔茨海默病神经免疫病机及治疗研究进展 [J]. 医学综述, 2021, 27(21): 4199-4203.
[33] Dong Y, Bi W C, Zheng K,. Nicotine prevents oxidative stress-induced hippocampal neuronal injury through α7-nAChR/Erk1/2 signaling pathway [J]., 2020, 13: 557647.
[34] 杜晓光, 李静, 辛现良, 等. 糖胺聚糖衍生物在阿尔茨海默病治疗中的前景 [J]. 中国药学杂志, 2008, 43(23): 1761-1764.
[35] Wang H, Shang Y C, Wang E L,. MST1 mediates neuronal loss and cognitive deficits: A novel therapeutic target for Alzheimer’s disease [J]., 2022, 214: 102280.
[36] 李佳明, 马玉滢, 张博, 等. 基于燕赵医学“温补脾肾”理论探讨阿尔茨海默病病因病机 [J]. 河北中医药学报, 2023, 38(2): 61-65.
[37] 李星, 张宏, 陶吉明. 阿尔兹海默病本虚标实病机的现代神经生物学探讨 [J]. 时珍国医国药, 2023, 34(2): 398-400.
[38] 吴红彦, 李海龙, 顾静, 等. 黑逍遥散对阿尔茨海默病大鼠海马基因表达谱的影响 [J]. 中国中西医结合杂志, 2016, 36(11): 1345-1351.
[39] 韩文静, 侯丽慧, 王乐, 等. 人参有效成分改善老年性记忆力减退和阿尔茨海默病的研究进展 [J]. 中国老年学杂志, 2023, 43(11): 2811-2815.
[40] 叶长青, 罗洪斌, 詹杰, 等. 基于网络药理学探讨当归治疗阿尔茨海默病的机制 [J]. 湖北民族大学学报: 医学版, 2022, 39(4): 7-13.
[41] 杨红兵, 杨佳, 石磊, 等. 厚朴花药材的指纹图谱研究 [J]. 湖北农业科学, 2022, 61(3): 134-139.
[42] 张明发, 沈雅琴. 厚朴及其有效成分防治阿尔茨海默病和帕金森病的药理作用及机制研究进展 [J]. 药物评价研究, 2023, 46(9): 2054-2060.
[43] 任佳慧, 宋明容, 刘莹, 等. 远志皂苷对转Tau基因果蝇AD模型PI3K/AKT信号通路的影响 [J]. 中医药学报, 2022, 50(12): 28-31.
[44] 张景荣, 于秀石, 高瑞娟, 等. 玫瑰花总黄酮对脑缺血/再灌注损伤大鼠PI3K/AKT通路和内质网应激凋亡的影响 [J]. 中国药理学通报, 2023, 39(5): 896-902.
[45] 李鑫, 王栋先, 刘伟, 等. “援药理论”现代中医临床应用思辨 [J]. 天津中医药, 2020, 37(12): 1327-1333.
[46] 陈晨, 李岩, 季佳子, 等. 精准营养的代谢相关指标 [J]. 卫生研究, 2023, 52(4): 681-684.
[47] Lin K L, Sze S C W, Liu B,. 20(S)-protopanaxadiol and oleanolic acid ameliorate cognitive deficits in APP/PS1 transgenic mice by enhancing hippocampal neurogenesis [J]., 2021, 45(2): 325-333.
[48] Lu C, Dong L, Lv J,20(S)-protopanaxadiol (PPD) alleviates scopolamine-induced memory impairment via regulation of cholinergic and antioxidant systems, and expression of Egr-1, c-Fos and c-Jun in mice [J]., 2018, 279: 64-72.
Identification of immune-related biomarkers of Alzheimer’s disease and prediction of medicine-food homology traditional Chinese medicines based on bioinformatics analysis and dynamic simulation
LIANG Pengpeng, WANG Yale, HUANG Hai, LI Guiyun, WU Hongyan
Shenzhen Hospital, Shanghai University of Traditional Chinese Medicine, Shenzhen 518004, China
To analyze the immune-related biomarkers, pathogenesis, levels of immune infiltration and potential homology herbs in Alzheimer’s disease (AD).The expression profiles of GSE5281 and GSE132903 were downloaded from GEO database to obtain AD differentially expressed genes (DEGs). The relevant module genes of AD were identified using a weighted co-expression algorithm, and the immune-related genes were subsequently obtained from the ImmPortal database. The intersection of the above mentioned genes was used to obtained to obtain the set of essential immune differential genes. The analysis was then performed using least absolute shrinkage and selection operator (LASSO) and support vector machine - recursive feature elimination (SVM-RFE) methods to screen for common immune biomarkers of AD. Biological pathways were explored through gene ontology (GO) and Kyoto encyclopedia of genes and genomes (KEGG), and gene set enrichment analysis (GSEA). The receiver operator characteristic (ROC) curve was used to evaluate the diagnostic capability of these candidate markers, and validated them in GSE122063 dataset. Besides, we established clinical nomograms and curves for clinical application evaluation. The cell-type identification by estimating relative subsets of RNA transcripts(Cibersort) and single-sample gene set enrichment analysis (ssGSEA) were used to analyze immune cell infiltration in the samples. Finally, Coremine Medical and Herb databases were used to analyze traditional Chinese medicines (TCMs) and components, and molecular docking and kinetic simulation were carried out.A total of 1 360 differential genes and five biomarkers including cysteine and glycine rich protein 1 (), glial fibrillary acidic protein (), interleukin 4 receptor (), somatostatin (), and nuclear factor-kappa B inhibitor alpha () were screened. GO analysis shows that AD is strongly correlated with positive regulation of neural development and cell development. The KEGG and GSEA enrichment results indicated that AD is most closely related to the B-cell receptor signaling pathway and the glycosaminoglycan biosynthesis pathway. Immune infiltration analysis showed that the proportion of macrophages, memory B cells and central memory CD8+T cells in AD brain tissue was increased, while the proportion of initial CD4+T cells, activated CD8+T cells and effector memory CD8+T cells decreased, and there were significant differences in B2M, CD40 and other examination sites. There were 82 potential TCMs, including Renshen (et), Danggui () and Houpohua (). Moreover, their four properties and five flavors are mainly warm, cold, flat, bitter, and sweet, and belong to the liver, lung, spleen, and stomach passages, with the effect of clearing heat, promoting blood, and tonifying deficiency. Molecular docking and kinetic simulation showed that 20()-protopanaxadiol was stable in docking with markers.The biomarkers and immune-related mechanisms of AD were screened and explained through various methods. Medicine-food homologous TCMs such aset,andare expected to be a significant source for AD drug development. This study sheds new light on the pathogenesis, clinical treatment, and novel drugs for AD.
Alzheimer’s disease; weighted coexpression analysis; machine learning; immune infiltration; biomarkers;et;;; 20()-protopanaxadiol
R285
A
0253 - 2670(2024)08 - 2667 - 17
10.7501/j.issn.0253-2670.2024.08.017
2023-11-20
深圳市“医疗卫生三名工程”项目(SZZYSM202201007);罗湖区软科学研究计划项目(LX20210101);罗湖区软科学研究计划项目(LX202302101)
梁朋朋(1996—),男,博士研究生,研究方向中医药治疗心脑血管疾病研究。E-mail: l17864190755@163.com
通信作者:吴红彦(1963—),男,教授,博士研究生导师,从事中医老年病研究。E-mail: wu.hy@163.com
[责任编辑 潘明佳]
