载芒果苷的氨基修饰介孔二氧化硅纳米粒的制备及口服药动学评价
2024-04-22杨丽萍王海军李伟宏王风云方晓东
杨丽萍,王海军,李伟宏,王风云*,方晓东
•药剂与工艺·
载芒果苷的氨基修饰介孔二氧化硅纳米粒的制备及口服药动学评价
杨丽萍1,王海军2,李伟宏1,王风云1*,方晓东3
1. 河南应用技术职业学院,河南 郑州 450042 2. 新乡医学院,河南 新乡 453000 3. 河南大学,河南 开封 475001
优化芒果苷的氨基修饰介孔二氧化硅纳米粒(mangiferin-amino-modified mesoporous silica nanoparticles,MF-NH2-MSNs)处方,并进行口服药动学评价。采用溶剂挥发法制备MF-NH2-MSNs。单因素考察结合Box-Behnken设计-效应面法筛选MF-NH2-MSNs处方,测定包封率、载药量、粒径、多分散指数(polydispersity index,PDI)和ζ电位。X粉末衍射法分析芒果苷在MF-NH2-MSNs粉末中的存在状态,考察MF-NH2-MSNs在模拟胃肠液中的释药行为,并拟合体外释药模型。SD大鼠ig给予MF-NH2-MSNs粉末后采血,测定血药浓度,考察口服药动学行为并计算主要药动学参数。MF-NH2-MSNs最佳处方为NH2-MSNs与芒果苷比例1.7∶1,芒果苷质量浓度为0.54 mg/mL,搅拌时间为11.28 h。MF-NH2-MSNs包封率为(92.34±1.04)%,载药量为(33.76±0.17)%,平均粒径为(204.18±8.66)nm,PDI值为0.120±0.014,ζ电位为(11.47±0.81)mV。芒果苷在MF-NH2-MSNs粉末中以无定型状态存在,在模拟胃肠液中体外释药具有缓释特征,释药过程符合Weibull模型:lnln[1/(1-M/M)]=1.032 0 ln-1.625。口服药动学显示,MF-NH2-MSNs半衰期(1/2)增加至(4.19±0.87)h,血药浓度(max)增加至(1 506.77±404.80)ng/mL,相对口服生物利用度提高至4.02倍。MF-NH2-MSNs增加了芒果苷累积释放度,显著促进口服吸收。
芒果苷;介孔二氧化硅纳米粒;Box-Behnken设计-效应面法;缓释特征;Weibull模型;口服药动学
芒果苷又称芒果素或知母宁,属于双苯吡酮类化合物,在漆树科芒果属植物芒果L.、水龙骨科石韦属植物光石韦Ching以及百合科知母属植物知母Bge.等植物中均可提取得到[1]。芒果苷具有抗肿瘤、降血糖、镇痛、抗氧化、镇咳平喘等活性[2-3],毒性极低[4],具备较高的研究开发价值及临床使用价值。芒果苷在水中溶解度为123 μg/mL[5],较强的疏水性可能影响药物的溶出度,油水分配系数仅为−0.153[5],属于生物药剂学分类系统IV类药物[3,5]。芒果苷在肠道中易被代谢[6],首关效应明显,也容易受各种外排蛋白影响[7],绝对口服生物利用度仅约1.2%[8],导致芒果苷药效大打折扣,不利于临床使用。目前关于芒果苷纳米制剂报道有纳米结构脂质载体[9]、自微乳[10]、固体脂质纳米粒[11]、脂质体[12]等,但载药量均较低。
介孔二氧化硅纳米粒(mesoporous silica nanoparticles,MSNs)孔径一般小于50 nm,具有制备工艺简单、载药量高等优势。MSNs表面存在丰富的硅羟基极易被修饰或改性,在新型纳米制剂研究中颇受关注[13-15]。纳米粒表面性质对跨膜转运、稳定性、生物利用度等均存在较大影响[16-18],但MSNs表面不含协助跨膜转运的基团,且缓释效果不明显,导致相对生物利用度的提高幅度受到一定限制。据报道[19-20],采用硅烷偶联剂对MSNs表面进行氨基修饰制备成氨基改性介孔二氧化硅纳米粒(amino-modified mesoporous silica nanoparticles,NH2-MSNs)后,可使表面荷正电,并与胃肠道黏膜表面荷负电的黏蛋白发生静电作用,进而促进跨膜转运,增加吸收;氨基修饰后的NH2-MSNs可使药物释放缓释特征更为明显,利于进一步提高生物利用度。本研究首先制备NH2-MSNs材料,单因素考察结合Box-Behnken设计-响应面法(Box-Behnken design-response surface methodology,BBD-RSM)优化载芒果苷的氨基修饰介孔二氧化硅纳米粒(mangiferin-amino-modified mesoporous silica nanoparticles,MF-NH2-MSNs)处方工艺,并与载芒果苷介孔二氧化硅纳米粒(mangiferin-mesoporous silica nanoparticles,MF-MSNs)比较粒径、ζ电位、体外释药及口服药动学行为等,为芒果苷新型制剂研发提供实验参考。
1 仪器与材料
1.1 仪器
Quintix型电子天平,德国赛多利斯仪器公司;1200型高效液相色谱仪器,美国Agilent公司;L-220型磁力搅拌器,北京来亨科技有限公司;KH-300DE型超声仪,北京通世华港设备有限公司;CTFD-18PT型真空冷冻干燥机,青岛永合创信电子科技有限公司;Nano-ZS90型粒度分析仪,英国马尔文公司;SU8600型扫描电子显微镜(scanning electron microscope,SEM),日立科学仪器有限公司;CF-5424型高速离心机,杭州佑宁仪器有限公司;DW-86L578J型超低温冰箱,海尔生物医疗股份有限公司;UDT-818A-8型溶出仪,东南科仪有限公司;UGC-12MF型氮吹仪,北京优晟联合科技有限公司。
1.2 试药
对照品芒果苷(批号111607-211605,质量分数98.6%)、葛根素(批号110752-201816,质量分数95.4%),中国食品药品检定研究院;芒果苷原料药,批号211120,质量分数98.0%,成都彼样生物科技有限公司;正硅酸四乙酯(批号20201007)、十六烷基三甲基溴化铵(批号20201025)、三乙醇胺(批号20210108)均购自国药集团化学试剂有限公司;3-氨丙基三乙氧基硅烷,批号20210115,上海阿拉丁生化科技股份有限公司;模拟胃液(批号20211022,pH 2.0)、模拟肠液(批号20210914,pH 6.8),东莞信恒科技有限公司。
SD大鼠,6周周龄,体质量为(200±20)g,雌雄兼用,购自河南省动物实验中心,许可证号:SCXK(豫)2020-0001。所有动物实验遵循河南应用技术职业学院有关实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 NH2-MSNs粉末的制备及表征
2.1.1 NH2-MSNs制备过程[20]称取0.5 g十六烷基三甲基溴化铵至240 mL蒸馏水中,于80 ℃下搅拌至溶解,加入1.8 mL浓度为2 mol/L氢氧化钠溶液,逐滴加入1.5 mL正硅酸四乙酯,600 r/min磁力搅拌30 min,缓慢加入3-氨丙基三乙氧基硅烷1 mL,2 h后静置12 h,14 500 r/min高速离心15 min(离心半径6.8 cm,温度4 ℃)。收集白色沉淀,分别用蒸馏水和无水乙醇洗涤3次,置于100 ℃烘箱干燥即得白色粉末,分散至体积为100 mL、质量浓度为10 mg/mL的硝酸铵乙醇溶液中,于80 ℃回流12 h除去十六烷基三甲基溴化铵,14 500 r/min高速离心20 min(离心半径6.8 cm,温度4 ℃),收集白色沉淀,置于60 ℃干燥箱中过夜,即得NH2-MSNs粉末。
2.1.2 NH2-MSNs的表征 分别取NH2-MSNs粉末和溴化钾粉末使两者质量比约1∶100,研磨均匀,压成透明薄片,置于红外光谱仪上进行扫描(温度25 ℃,相对湿度35%),扫描范围为400~4 000 cm−1,分辨率为4 cm−1,扫描次数为16次。MSNs粉末同法测定,结果见图1,其中1 078、796、462 cm−1处吸收峰归属于Si-O-Si的骨架振动峰,是介孔二氧化硅特征峰。在NH2-MSNs红外图谱中出现2 931、2 858 cm−12处吸收峰,推断为N-H伸缩振动峰,证明氨基已修饰至MSNs,成功合成了NH2-MSNs。
2.2 MF-NH2-MSNs制备工艺
据文献报道[5],芒果苷在50%乙醇中溶解度相对最大,故使用50%乙醇作为制备溶剂,采用溶剂挥发法制备MF-NH2-MSNs。取20 mg芒果苷置于圆底烧瓶,加入50%乙醇50 mL,于30 ℃下磁力至溶解澄清。加入处方量NH2-MSNs粉末,30 ℃下磁力搅拌一定时间(转速为800 r/min),过0.45 μm微孔滤膜,即得带蓝色乳光的MF-NH2-MSNs混悬液。取MF-NH2-MSNs混悬液分装至西林瓶中,−35 ℃预冻2 d,置于−35℃冻干机中2 d,即得MF-NH2-MSNs粉末。同法制备空白NH2-MSNs(不含芒果苷)和MF-MSNs粉末。

图1 NH2-MSNs和MSNs的红外光谱图
2.3 HPLC法测定MF-MSNs和MF-NH2-MSNs中药物含量
2.3.1 色谱条件 色谱柱为Waters C18柱(150 mm×4.6 mm,5 μm);柱温为35 ℃;流动相为0.1%甲酸水溶液-甲醇(40∶60);检测波长为365 nm;体积流量为1.0 mL/min;进样量10 μL;理论塔板数以芒果苷计不低于6 000。
2.3.2 线性关系考察 精密称取芒果苷对照品50.0 mg至100 mL量瓶中,加入四氢呋喃超声3 min溶解,并用四氢呋喃稀释定容,得0.5 mg/mL芒果苷对照品储备液。使用流动相为稀释液,稀释成质量浓度分别为10.00、5.00、2.50、1.00、0.20、0.05 μg/mL系列芒果苷对照品溶液,按“2.3.1”项下色谱条件测定不同芒果苷质量浓度()的峰面积()。以值对做线性回归,得回归方程=21.357 8+0.115 7,=0.999 7,结果表明芒果苷线性浓度范围为0.05~10.00 μg/mL。
2.3.3 MF-MSNs和MF-NH2-MSNs供试品溶液的制备 取MF-NH2-MSNs粉末10 mg,加入甲醇约30 mL超声(功率250 W)10 min,14 500 r/min离心20 min(离心半径6.8 cm、温度4 ℃),再重复提取2次,合并提取液用甲醇定容至100 mL,摇匀。取1 mL至10 mL量瓶中,加入流动相稀释定容,即得MF-NH2-MSNs供试品溶液。MF-MSNs供试品溶液同法配制。
2.3.4 专属性考察 取空白辅料、芒果苷对照品、MF-MSNs和MF-NH2-MSNs样品溶液,分别按“2.3.1”项下色谱条件进样测定,色谱图见图2,辅料未干扰芒果苷色谱峰,表明专属性较高。
2.3.5 精密度考察 取高(10.00 μg/mL)、中(2.50 μg/mL)、低(0.05 μg/mL)质量浓度芒果苷对照品溶液,连续测试6次,计算得芒果苷高、中、低质量浓度峰面积的RSD分别为0.23%、0.34%、0.18%,结果表明仪器精密度良好。
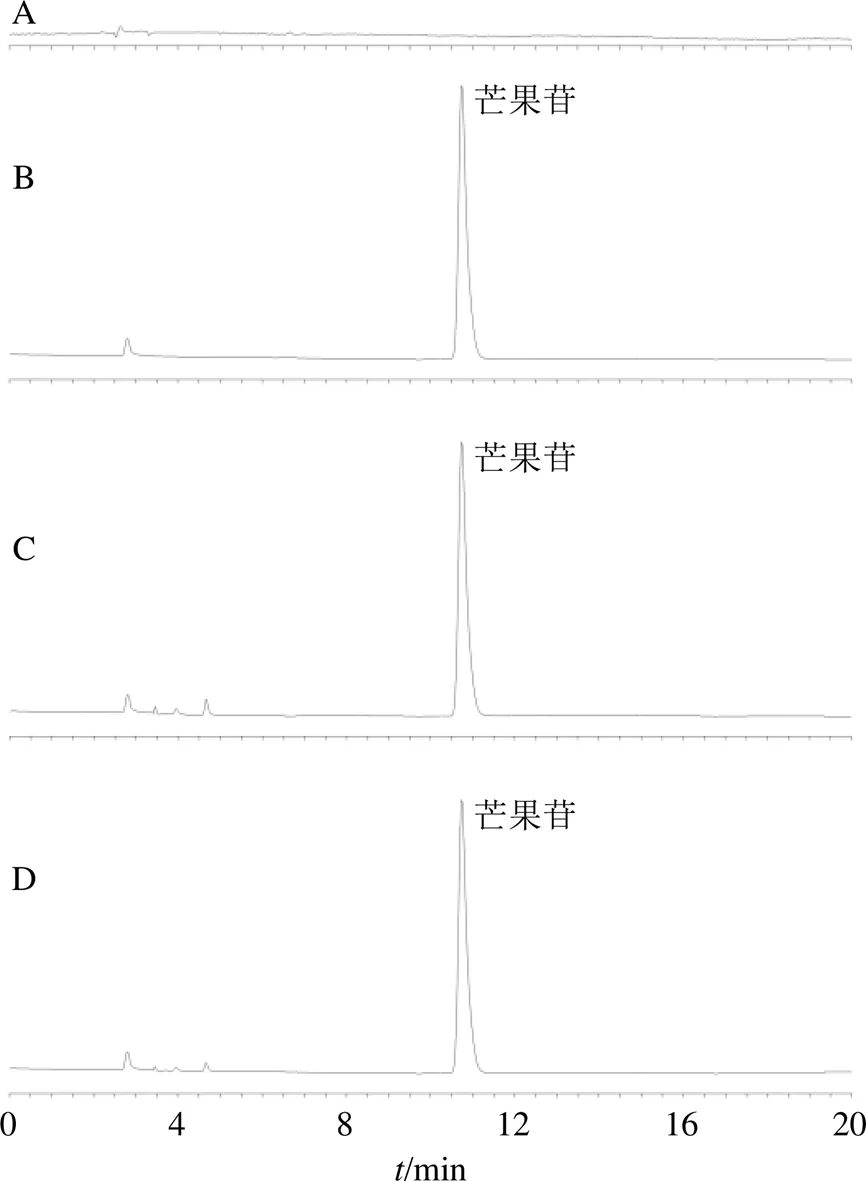
图2 空白辅料(A)、芒果苷对照品(B)、MF-MSNs (C) 和MF-NH2-MSNs (D) 样品溶液的HPLC图
2.3.6 稳定性考察 取MF-MSNs和MF-NH2-MSNs供试品溶液,分别于制备后0、2、4、8、12、24 h进样测定,计算得芒果苷峰面积的RSD分别为0.43%和0.82%,结果表明供试品溶液在24 h内稳定性较好。
2.3.7 重复性考察 按“2.3.3”项方法平行配制MF-MSNs和MF-NH2-MSNs供试品溶液各6份,进HPLC测定峰面积,计算得芒果苷质量分数的RSD分别为1.30%和1.77%,结果表明方法重复性良好。
2.3.8 加样回收率考察 精密取MF-NH2-MSNs粉末5 mg,共9份,分为高、中、低3组,分别加入质量浓度为0.5 mg/mL芒果苷对照品溶液7.5 mL(高)、6.0 mL(中)、4.5 mL(低),按“2.3.3”项下方法操作,进样测定芒果苷含量,计算得芒果苷低、中、高质量浓度的平均加样回收率为100.58%,RSD为1.22%。同法测得MF-MSNs高、中、低质量浓度的平均加样回收率为99.84%,RSD为0.64%,表明该方法准确度较高。
2.4 包封率、载药量、粒径及ζ电位的测定
精密取MF-NH2-MSNs混悬液2 mL至离心管中,置于腔体温度为4 ℃的高速离心机中,14 500 r/min离心(离心半径6.8 cm,温度4 ℃)30 min,取上清液,测定游离芒果苷量(游离)。取MF-NH2-MSNs混悬液2 mL,按“2.3.3”项下方法测定总芒果苷量(总药量)。取MF-NH2-MSNs混悬液2 mL,预冻2 d后置于−35 ℃冻干机中冷冻2 d,称定质量(总),计算MF-NH2-MSNs的包封率和载药量。
包封率=(总药量-游离)/总药量
载药量=(总药量-游离)/总
取MF-NH2-MSNs混悬液,稀释50倍后于粒度分析仪上测定粒径、PDI值和ζ电位。MF-MSNs同法测定。
2.5 MF-NH2-MSNs处方工艺单因素考察
2.5.1 NH2-MSNs与芒果苷比例的考察 芒果苷投药量为20 mg,质量浓度为0.5 mg/mL,搅拌时间为12 h条件下考察NH2-MSNs与芒果苷比例的影响,结果见表1。随着NH2-MSNs用量的增加,MF-NH2-MSNs包封率逐渐增加后趋稳,载药量呈先增加后减少趋势。NH2-MSNs与芒果苷比例大于2.5∶1后粒径急剧增大,可能是NH2-MSNs用量过多时导致纳米粒聚集,进而也导致PDI值增大,粒径分布不均匀,表明NH2-MSNs与芒果苷比例对MF-NH2-MSNs影响较大。

表1 NH2-MSNs与芒果苷比例的考察(, n = 3)
2.5.2 芒果苷质量浓度的考察 芒果苷投药量为20 mg,NH2-MSNs与芒果苷比例为2∶1,搅拌时间为12 h条件下考察芒果苷质量浓度影响,结果见表2。随着芒果苷质量浓度的增加,MF-NH2-MSNs包封率和载药量均呈先增加后趋稳情况,溶液中药物主要以被动扩散形式进入NH2-MSNs孔道内,质量浓度越高易被孔道吸附[21],但NH2-MSNs吸附能力有限,达到一定质量浓度后包封率和载药量不再继续增加。但芒果苷质量浓度过大时,容易使MF-NH2-MSNs聚集,进而导致粒径和PDI值增大,表明芒果苷质量浓度对MF-NH2-MSNs影响较大。
2.5.3 搅拌时间的考察 芒果苷投药量为20 mg,NH2-MSNs与芒果苷比例为2∶1,质量浓度为0.5 mg/mL条件下考察搅拌时间的影响,结果见表3。随着搅拌时间的延长,MF-NH2-MSNs的包封率和载药量均先增加后下降,可能是由于适当的搅拌时间利于NH2-MSNs吸附药物,使包封率和载药量增加。但由于芒果苷热稳定性不高[22],过长的搅拌时间可能导致药物降解,使包封率和载药量下降。PDI值随着搅拌时间延长呈先下降后增大趋势,表明搅拌时间对MF-NH2-MSNs影响较大。

表2 芒果苷质量浓度的考察(, n = 3)

表3 搅拌时间的考察(, n = 3)
2.6 BBD-RSM优化MF-NH2-MSNs处方工艺
2.6.1 试验方案设计与结果 据“2.5”项下考察结果表明,NH2-MSNs与芒果苷比例(1)、芒果苷质量浓度(2)和搅拌时间(3)对MF-NH2-MSNs包封率(1)、载药量(2)和PDI值(3)影响较大,故选择1、2和3为自变量,1、2和3为因变量。期望MF-NH2-MSNs具有较高的包封率和载药量,同时PDI值较小(即粒径均一),故将包封率、载药量和PDI值转换为归一值(overall desirability,OD)进行评价。
包封率和载药量计算公式为max=(M-min)/ (max-min),M为实际值,max为最大值,min为最小值;PDI值为min=(max-M)/(max-min);归一值OD值计算公式为OD=(123)1/3。
设计BBD-RSM优化MF-NH2-MSNs处方工艺,自变量水平、试验方案设计与结果见表4。
2.6.2 数学模型与方差分析 根据表4实验数据,得OD二次多元回归方程为1=0.90-0.0551+0.0692-0.0833+0.04012+0.1313-3.79×10−423-0.5112-0.1622-0.2632,其中2=0.959 0,adj2=0.906 3。该数学模型值=0.000 5,具极显著性差异(<0.01);而失拟值=0.082 5,无显著性差异(>0.05),可见建立的OD数学模型可用于MF-NH2-MSNs处方工艺研究,未知因素干扰可忽略。方程分析见表5,对OD二次多项式统计检验发现,3、13、22具显著性差异(<0.05),12、32均具显著性差异(<0.01)。
2.6.3 效应面优化与预测 固定1、2和3因素之一,使用Design Expert V10.0.3软件绘制两两因素对归一值OD的三维曲面图,结果见图3。随着两两因素的增加,OD值均呈现先增大后减小趋势,表明使用BBD-RSM优化MF-NH2-MSNs处方工艺是必要的。选择OD值最大值为优化目标,区间设置为0~1,得到MF-NH2-MSNs最佳处方工艺为NH2-MSNs与芒果苷比例1.7∶1,芒果苷质量浓度为0.54 mg/mL,搅拌时间为11.28 h。预测包封率为92.92%,载药量为34.06%,PDI值为0.117。

表4 BBD-RSM试验设计与结果(n = 3)
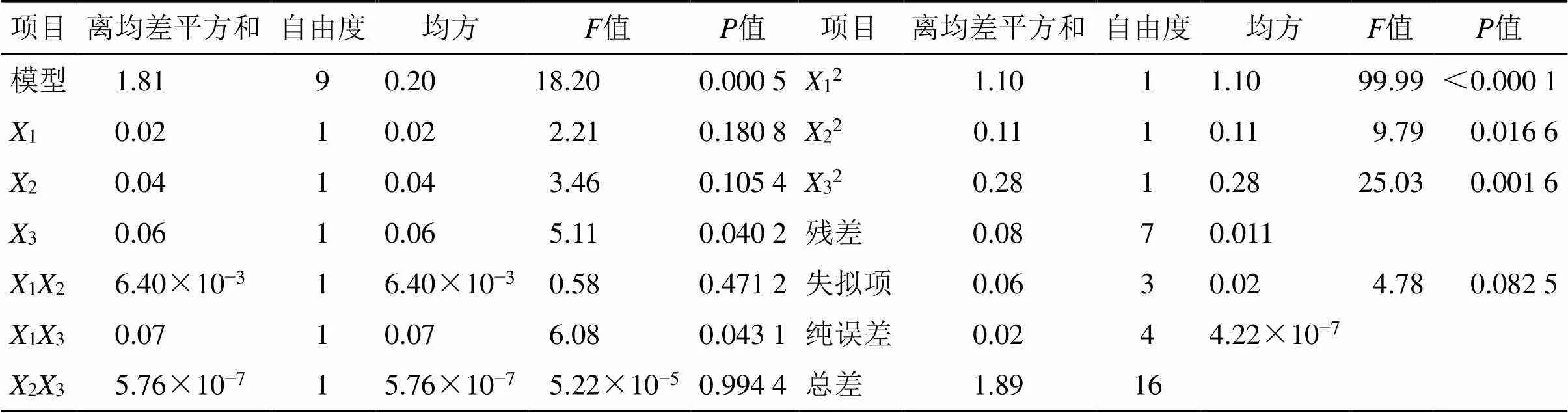
表5 方差分析结果
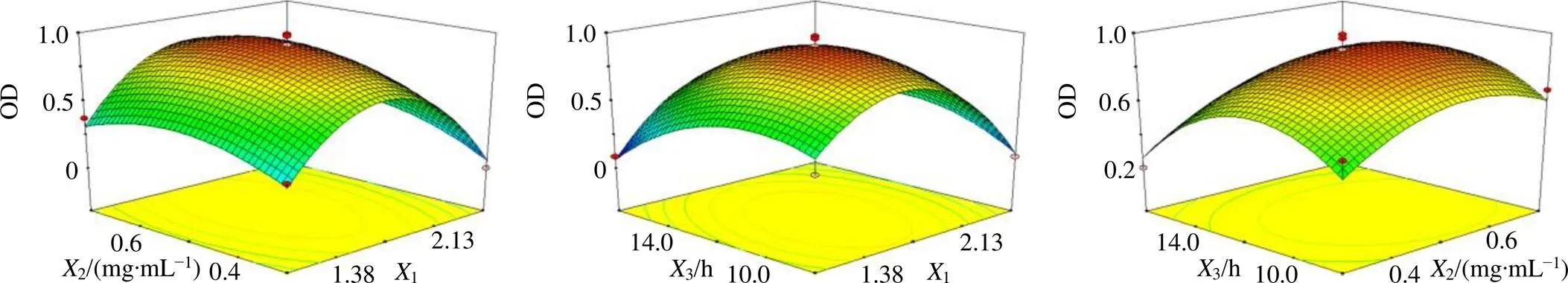
图3 各因素与响应值的三维图
2.7 MF-NH2-MSNs最佳工艺确认及偏差计算
按“2.5.3”项下确定的MF-NH2-MSNs最佳处方工艺,平行制备3批样品(图4),分别测定包封率、载药量和PDI值,计算各个指标相对偏差,结果见表6,MF-NH2-MSNs的包封率、载药量和PDI值相对偏差绝对值均小于3%,说明该数学模型具有较高的指导意义。另测得MF-NH2-MSNs的平均粒径为(204.18±8.66)nm,ζ电位为(11.47±0.81)mV。

图4 MF-NH2-MSNs混悬液(A)及粉末(B)外观
相对偏差=(实测值-预测值)/预测值

表6 相对偏差结果(, n = 3)
2.8 MF-MSNs的制备
按MF-NH2-MSNs最佳处方工艺,采用MSNs材料制备MF-MSNs粉末,按“2.4”项下方法测得MF-MSNs平均包封率为(90.07±0.96)%,载药量为(31.90±0.21)%,平均粒径为(173.50±6.97)nm,PDI为0.104±0.011,ζ电位为(−24.02±0.71)mV。MF-MSNs和MF-NH2-MSNs的粒径分布和ζ电位分布见图5。
2.9 MF-MSNs与MF-NH2-MSNs的SEM观察
分别取MF-MSNs和MF-NH2-MSNs混悬液,蒸馏水稀释50倍,摇匀,滴至铜胶带上(经无水乙醇冲洗3次),晾干后喷金1 min。SEM条件:电压5.0 kV,视距为14.01 mm,结果见图6。MF-MSNs和MF-NH2-MSNs的微观形貌均为球形或椭圆形。
2.10 MF-NH2-MSNs冻干粉晶型分析
X射线粉末衍射法(XRPD)扫描条件:扫描速度为4°/min,Cu-Kα靶,扫描范围(2)为3°~45°。取芒果苷原料药、空白NH2-MSNs粉末、物理混合物(芒果苷+NH2-MSNs粉末,比例同MF-NH2-MSNs粉末)、MF-MSNs粉末和MF-NH2-MSNs粉末适量,扫描结果见图7。芒果苷在10.5°、12.0°、13.7°、16.1°、17.1°、18.1°、20.0°、21.2°、24.2°、25.1°、27.4°等出现特征晶型峰,空白NH2-MSNs粉末XRPD图谱提示该材料为无定型物质,在物理混合物的XRPD图谱中仍可观察到芒果苷特征晶型峰,可能由于芒果苷未高度分散填充进入NH2-MSNs孔道内,仅以晶型状态与NH2-MSNs粉末混合,故晶型状态未发生改变。MF-NH2-MSNs粉末的XRPD图谱与物理混合物XRPD存在较大差别,芒果苷特征晶型峰均消失,证明MF-NH2-MSNs粉末是不同于物理混合物的一种物质。
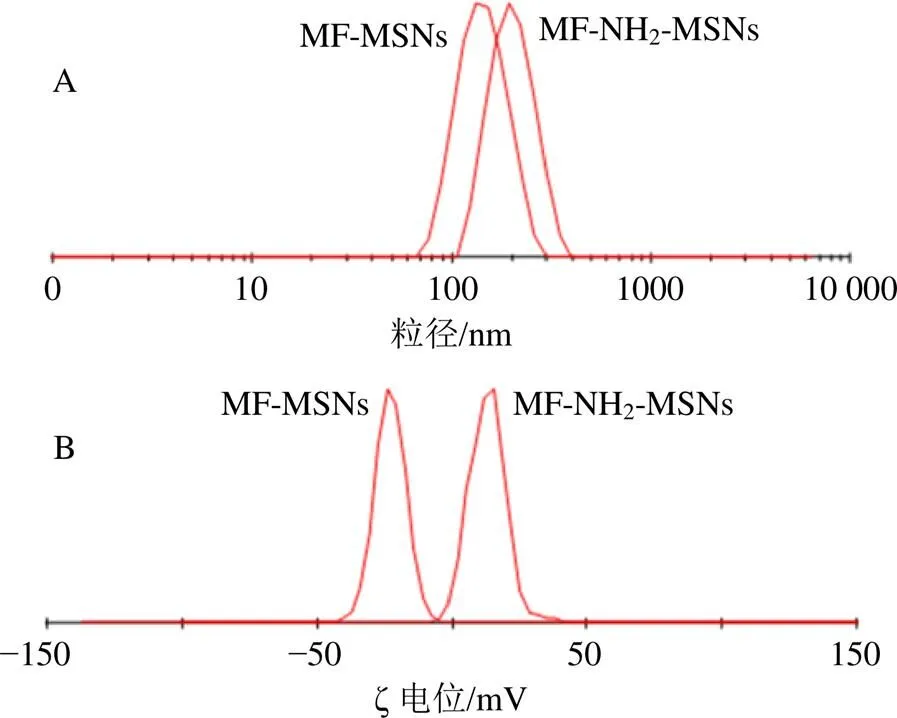
图5 MF-MSNs和MF-NH2-MSNs的粒径分布(A)和ζ电位分布(B)

图6 MF-MSNs (A) 和MF-NH2-MSNs (B) 的SEM观察结果
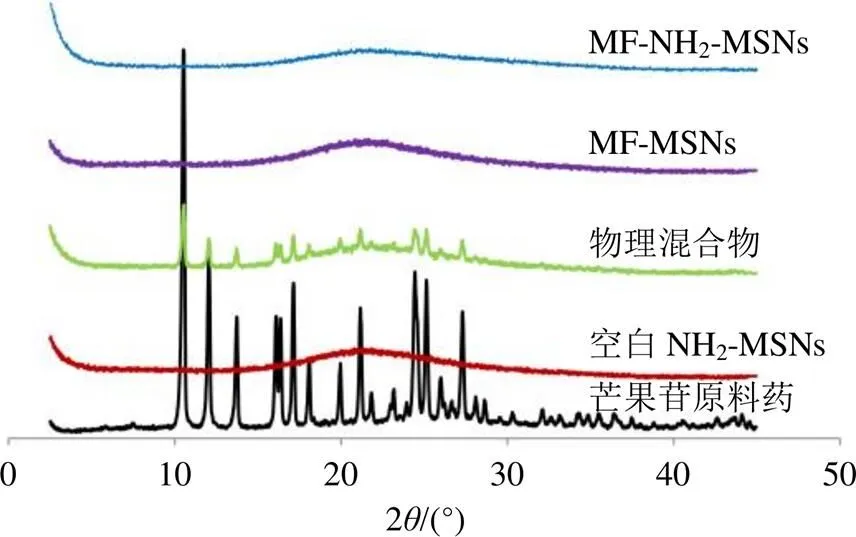
图7 XRPD结果
2.11 MF-MSNs和MF-NH2-MSNs模拟胃肠液释药考察
取芒果苷原料药、物理混合物(芒果苷+NH2-MSNs粉末,比例同MF-NH2-MSNs粉末)、MF-MSNs粉末和MF-NH2-MSNs粉末(芒果苷含量均为20 mg),加入5 mL蒸馏水制备混悬液,密封于经活化处理的透析袋(截留相对分子质量为8 000~12 000)中。释药介质为1 000 mL模拟胃液(pH 2.0,含胃蛋白酶),于温度37 ℃、转速75 r/min条件下进行试验,取样点为0.5、1.0、1.5、2.0 h,取样体积为5 mL,每次取样后立即补加5 mL蒸馏水。2 h后立即将释药介质更换为1 000 mL模拟肠液(pH 6.8,含胰蛋白酶),取样点为3、4、6、8、10、12 h。样品经14 500 r/min离心(半径6.8 cm,温度4 ℃)20 min后取上清液测定,计算各点累积释放率,结果见图8。芒果苷原料药和物理混合物12 h累积释放率分别为16.86%和20.73%,MF-MSNs粉末和MF-NH2-MSNs粉末分别将累积释放率提高至96.15%和92.80%。MF-NH2-MSNs各点累积释放率均低于MF-MSNs,可能是氨基修饰后对药物释放具有一定的阻滞作用所致[20]。MF-MSNs和MF-NH2-MSNs体外释药均与Weibull模型拟合度最高(表7),说明释药过程呈现双相动力学特征[23]。

图8 模拟胃肠液中释药曲线(, n = 6)
2.12 MF-MSNs和MF-NH2-MSNs稳定性考察
取MF-MSNs和MF-NH2-MSNs密封置于恒温恒湿箱(湿度65%,温度25 ℃),分别于0、3、6月取样,进行XRPD试验,测试条件同“2.9”项下,结果见图9。在储存6月后MF-MSNs和MF-NH2-MSNs均未出现芒果苷特征晶型峰,证明未发生析晶现象,表明MF-MSNs和MF-NH2-MSNs粉末储存稳定性良好。

表7 药物释放模型和相关系数
为时间,∞为¥时累积释放度,M为时间累积释放度,M/∞为时间累积释放百分率
is stand for time,∞is accumulative drug-release at time¥,Mis accumulative drug-release at time,M/Mis accumulative release rate at time
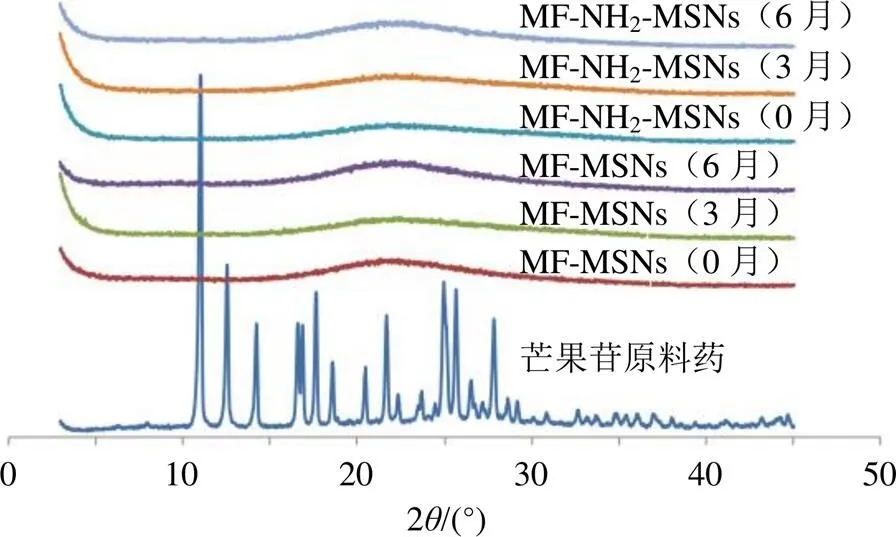
图9 稳定性考察
2.13 药动学研究
2.13.1 实验方案 取芒果苷原料药、MF-MSNs和MF-NH2-MSNs粉末,使用0.5%的CMC-Na水溶液配制混悬液。取18只SD大鼠禁食12 h,随机分为3组,记录各只大鼠体质量,均按30 mg/kg剂量(以芒果苷计)ig,计时,原料药组于0、0.5、1.0、1.5、2.0、2.5、3.0、4.0、6.0、8.0 h于眼眶后静脉丛采血,MF-MSNs和MF-NH2-MSNs组于0、0.5、1.0、2.0、2.5、3.0、4.0、5.0、6.0、8.0、10.0、12.0 h采血。血样4 000 r/min离心(离心半径6.8 cm,温度4 ℃)3 min,取上层淡黄色血浆,冷冻保存。
2.13.2 血浆的处理 精密取葛根素对照品,用甲醇稀释配制至1 200 ng/mL,作为药动学研究用内标溶液。取100 μL血浆、50 μL内标溶液和2 mL甲醇,密封后涡旋5 min。取上层混悬液,6 500 r/min离心20 min(半径6.8 cm,温度4 ℃),弃去沉淀,将有机相使用37 ℃氮气吹干,使用100 μL甲醇复溶残渣,即得血浆样品。
2.13.3 标准曲线的绘制 取质量浓度分别为2 400、1 600、800、200、100、50 ng/mL芒果苷对照品溶液,各质量浓度分别取100 µL,使用37 ℃氮气吹除有机溶剂得残渣,加100 μL空白血浆复溶,得 2 400、1 600、800、200、100、50 ng/mL芒果苷血浆对照品溶液。后续按“2.12.2”项下操作,按“2.3.1”项下色谱测定芒果苷与内标峰面积,计算两者峰面积并作为纵坐标(),芒果苷质量浓度为横坐标(),得方程为=0.647 5+0.089 1,=0.994 2,结果表明芒果苷的线性范围为50~2 400 ng/mL。
2.13.4 专属性考察 取空白血浆溶液、芒果苷原料药ig 2 h血浆样品和芒果苷质量浓度为100 ng/mL的血浆对照品溶液,按“2.3.1”项下色谱条件进样,结果见图10,结果表明该色谱条件专属性高。
2.13.5 稳定性考察 取MF-MSNs ig 4 h的血浆样品,分别于0、2、4、8、12、24 h进样测定,结果芒果苷和内标峰面积比值的RSD为4.37%,表明血浆样品稳定性良好。
2.13.6 精密度考察 取50、800、2 400 ng/mL血浆对照品溶液,分别连续测定6次,芒果苷和内标峰面积比值的RSD分别为4.40%、7.16%、5.13%,表明日内精密度良好;取该样品连续进样测定6 d,每天1次,结果芒果苷和内标峰面积比值的RSD分别为6.69%、3.08%、4.62%,表明日间精密度良好。
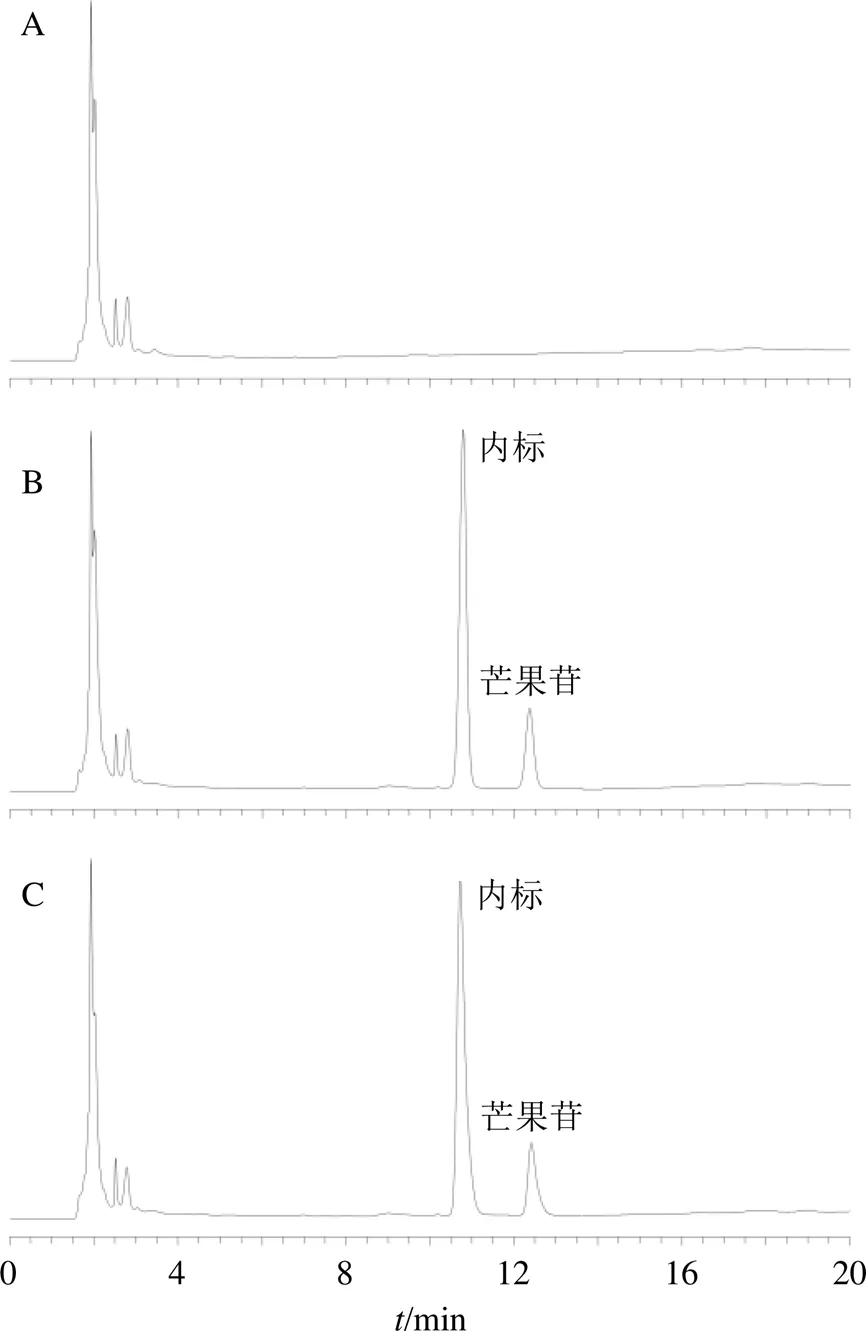
图10 空白血浆(A)、血浆样品(B)、血浆对照品溶液(C) 的HPLC图
2.13.7 重复性考察 取血浆样品,按“2.12.2”项下方法平行处理6份,分别进样,测定芒果苷和内标峰面积,计算得峰面积比值的RSD为4.81%,表明该实验重复性良好。
2.13.8 加样回收率考察 取2 400 ng/mL(高)、800 ng/mL(中)、50 ng/mL(低)芒果苷对照品溶液,按“2.12.2”项下方法进行处理,按“2.3.1”项下色谱条件测定芒果苷与内标峰面积,计算芒果苷测得质量浓度,与配制质量浓度对比,计算芒果苷的加样回收率,结果芒果苷的平均加样回收率为96.33%,RSD为5.79%,表明该实验准确度较高。
2.13.9 口服药动学考察结果 芒果苷原料药、MF-MSNs和MF-NH2-MSN的药-时曲线见图11。使用DAS 2.0软件计算芒果苷原料药、MF-MSNs和MF-NH2-MSNs的药动学参数,结果见表8。与芒果苷原料药相比,MF-MSNs和MF-NH2-MSN的max均有延后(<0.05),1/2均有延长(<0.05),max、AUC0~t和AUC0~¥均得到极显著性增加(<0.01)。MF-MSNs和MF-NH2-MSN相对口服吸收生物利用度分别提高至2.68倍和4.02倍,表明MF-MSNs和MF-NH2-MSN均可促进芒果苷口服吸收。与MF-MSNs相比,MF-NH2-MSN的max、AUC0~t和AUC0~¥存在显著性差异(<0.05),证明MF-NH2-MSN可进一步促进芒果体内吸收。

图11 药-时曲线(, n = 6)

表8 主要药动学参数(, n = 6)
与芒果苷混悬液相比较:*<0.05**<0.01;与MF-MSNs相比较:#<0.05。
*< 0.05**< 0.01mangiferin suspension;#< 0.05MF-MSNs.
3 讨论
脂质类纳米制剂存在普遍缺陷是制备工艺复杂、辅料种类多、研发成本高等,需借助冻干保护剂才可形成固体粉末,导致制剂载药量较低。而MSNs制备工艺简单、载药量高、无需添加冻干保护剂等,有效解决了脂质纳米制剂的不足。本研究制备的MF-MSNs和MF-NH2-MSNs包封率均大于90%,载药量均大于30%,可直接冻干即可制备成粉末,具有较高的实用价值和推广意义。
MF-NH2-MSNs粒径大于MF-MSNs主要是由于表面修饰的3-氨丙基三乙氧基团增大了MF-NH2-MSNs粒径所致,并且该基团的存在也使MF-NH2-MSNs荷正电,电荷性质的改变会对体内吸收产生较大影响[20]。体外释药结果显示,MF-MSNs前期存在一定的突释效应,可能是由于吸附在MSNs表面或浅表面药物快速释放所致。经氨基修饰制备成MF-NH2-MSNs后,减少了药物在NH2-MSNs表面的吸附,使药物更易被吸附于NH2-MSNs内部[20],从而缓释效应更为明显。
在MF-MSNs和MF-NH2-MSNs的XRPD中均未观察到芒果苷特征晶型峰,表明芒果苷以非晶体状态分散填充至NH2-MSNs和MSNs孔道中[24],达到纳米级分散状态,利于改善药物的溶解度、溶出度等。MF-NH2-MSNs包封率及载药量高于MF-MSNs,可能是氨基修饰后封堵孔道[15],阻止了药物扩散所致。氨基与芒果苷分子之间是否存在某种作用力,从而使MF-NH2-MSNs包封率及载药量增大,仍需进一步研究。MF-MSNs和MF-MSNs的储存稳定性良好,这是由于MSNs本身是一种稳定性良好的无机纳米载体,储存过程中不易发生氧化、降解、聚集等。
葛根素和芒果苷均属于黄酮类化合物,性质相近,且两者HPLC分离度高,故选择葛根素作为测定芒果苷血药浓度时内标物质。口服药动学显示MF-MSNs和MF-NH2-MSNs药动学行为发生了很大变化,max均发生显著性延后,可能与2种MSNs缓释效果有关;芒果苷在胃肠道中易被降解,2种MSNs降低了芒果苷降解几率,增加了后期进入血液循环的量,因而使max发生显著性延后,同时也对1/2产生了较大影响。2种MSNs的max得到极显著性增加,可能与芒果苷溶解度和溶出度增加、胃肠道降解率下降有关。2种MSNs相对口服相对生物利用度均得到显著性提高,可能是由于纳米级别的MSNs极大提高了芒果溶解度和溶出度;纳米药物与胃肠道接触更充分,利于药物跨膜吸收进入血液循环;芒果苷吸附于MSNs孔道内,从而提供了保护作用,降低了降解几率,增加了吸收量;2种MSNs均使芒果苷由晶型状态转变为无定型状态,而无定型药物更易吸收[25];MSNs结构稳定性较高,可在具有淋巴结构的派伊尔淋巴集结中聚集,通过M细胞进入体循环,实现高效吸收[26-27]。
与MF-MSNs相比,MF-NH2-MSNs的max和口服吸收生物利用度均有显著性增加,这是由于氨基修饰后的NH2-MSNs比未修饰MSNs具有更高的跨膜转运能力[20];MF-NH2-MSNs表面荷正电,可与胃肠道表面荷负电荷黏蛋白静电结合,从而延长MF-NH2-MSNs体内滞留时间,增强吸收。综上,本研究完成了MF-NH2-MSNs处方优化、晶型分析、储存稳定性及口服药动学等评价,发现MF-NH2-MSNs包封率、载药量较高,芒果苷在MF-NH2-MSNs中以无定型状态存在,缓释特征明显,储存稳定性高,能进一步提高芒果苷口服吸收,为芒果苷口服给药新剂型提供了新策略,值得进一步研究。
利益冲突 所有作者均声明不存在利益冲突
[1] 关丽, 杨翠倩, 李瑞佳, 等. 芒果苷的研究进展 [J]. 当代化工, 2021, 50(2): 478-481.
[2] 陈煜, 张雪映, 王烁今, 等. 芒果苷的药理作用研究进展 [J]. 海峡药学, 2019, 31(6): 31-33.
[3] 王梦迪. 新型芒果苷纳米递送系统的构建及其在靶向治疗1型糖尿病中的应用 [D]. 青岛: 青岛大学, 2022.
[4] 林华, 候亮, 高丽辉, 等. 芒果苷与别嘌醇长期毒性比较研究 [J]. 中国民族民间医药, 2020, 29(16): 16-22.
[5] 益慧慧. mPEG-PLGA-芒果苷纳米粒的制备及药代动力学研究 [D]. 西安: 西北大学, 2018.
[6] 黄慧学, 谭珍媛, 邓家刚, 等. 人肠道菌群对芒果苷体外代谢转化的研究 [J]. 中国中药杂志, 2011, 36(4): 443-445.
[7] 何倩梅, 李丹, 邱昆成, 等. 单向在体肠灌流模型研究P-gp和MRP2抑制剂对芒果苷肠吸收的影响 [J]. 中药药理与临床, 2016, 32(4): 35-38.
[8] Li Y J, Sui Y J, Dai Y H,. LC determination and pharmacokinetics study of mangiferin in rat plasma and tissues [J]., 2008, 67(11): 957-960.
[9] Khurana R K, Bansal A K, Beg S,. Enhancing biopharmaceutical attributes of phospholipid complex-loaded nanostructured lipidic carriers of mangiferin: Systematic development, characterization and evaluation [J]., 2017, 518(1/2): 289-306.
[10] 王亚静, 轩肖玉, 张伟玲, 等. 磷脂复合物自微乳给药系统对芒果苷药动学性质的改善作用 [J]. 中药材, 2014, 37(1): 108-111.
[11] 吕东霞, 禹瑞, 屈战果, 等. 芒果苷固体脂质纳米粒的制备及其体内药动学研究 [J]. 中成药, 2020, 42(11): 2835-2839.
[12] Thiengkaew P, Thanitwatthanasak S, Srisala S,. Response surface optimization of microfluidic formulations of nanobilosomes for enhancement of aqueous solubility, digestive stability, and cellular antioxidant activity of mangiferin [J]., 2021, 351: 129315.
[13] 李伟宏, 郑伟, 王风云, 等. 金丝桃苷磷脂复合物及其介孔二氧化硅纳米粒的制备和口服药动学研究 [J]. 中草药, 2023, 54(13): 4157-4167.
[14] 刘盼盼, 陈文. 单分散性介孔二氧化硅的制备及靶向性评价 [J]. 中国医院药学杂志, 2020, 40(12): 1339-1344.
[15] 盛晓丹, 刘臻, 罗砚曦, 等. 聚多巴胺修饰的载榄香烯介孔二氧化硅纳米粒的制备及其靶向抗肿瘤活性研究 [J]. 中草药, 2020, 51(10): 2745-2754.
[16] 周敬, 郑宝玉, 李阳杰, 等. 聚乙二醇修饰高良姜素纳米结构脂质载体处方优化及口服药动学评价 [J]. 中草药, 2023, 54(14): 4455-4466.
[17] 杨金枝, 崔晓鸽, 郝海军. TPGS表面修饰岩白菜素固体脂质纳米粒的制备与口服生物利用度研究 [J]. 中草药, 2023, 54(13): 4144-4156.
[18] 闫秋丽, 章勇, 刘耀, 等. 以泊洛沙姆188或聚乙二醇8000为载体制备槲皮素晶体分散体系的表征及体外溶出行为研究 [J]. 药物评价研究, 2023, 46(1): 100-107.
[19] 唐涛, 臧巧真, 龙凯花, 等. 载穿心莲内酯的氨基修饰介孔二氧化硅纳米粒的制备及其初步药效学评价 [J]. 中国医药工业杂志, 2015, 46(11): 1186-1191.
[20] 张蓉蓉, 王国伟, 徐骏军, 等. 载白藜芦醇的氨基修饰介孔二氧化硅纳米粒的制备及体内体外评价 [J]. 中国药学杂志, 2015, 50(5): 413-419.
[21] 黎哲. 共载紫杉醇/丹参酮IIA叶酸修饰脂质包覆介孔二氧化硅递药系统的构建及抗肿瘤研究 [D]. 上海: 上海中医药大学, 2019.
[22] 陈毅平, 牛晓静, 陈双英. 芒果苷的稳定性及其影响因素 [J]. 华西药学杂志, 2008, 23(3): 359-361.
[23] 卢慧芳, 刘艳美, 王荷香, 等. 穿心莲内酯甲氧基聚乙二醇-聚乳酸-羟基乙酸纳米粒处方优化及体外释药考察 [J]. 中国医院药学杂志, 2022, 42(19): 2034-2039.
[24] 李娜, 林燕喃, 蓝志良, 等. 姜黄素介孔二氧化硅纳米粒载药系统的制备及其载药性能 [J]. 福建医科大学学报, 2018, 52(1): 19-23.
[25] 张伟利, 李晓婷, 决利利, 等. 柠檬苦素磷脂复合物制备及其体内药动学研究 [J]. 中成药, 2023, 45(4): 1051-1057.
[26] 李伟宏, 王风云. 白藜芦醇mPEG-PLGA纳米粒的制备及其体内药动学、抗肿瘤活性研究 [J]. 中成药, 2022, 44(11): 3409-3415.
[27] 董丹丹, 焦红军, 郝海军, 等. 吴茱萸碱纳米结构脂质载体处方优化和SD大鼠体内口服药动学研究 [J]. 中草药, 2022, 53(1): 60-70.
Formulation optimization of mangiferin-amino-modified mesoporous silica nanoparticles and oral pharmacokinetics evaluation
YANG Liping1, WANG Haijun2, LI Weihong1, WANG Fengyun1, FANG Xiaodong3
1. Henan Vocational College of Applied Technology, Zhengzhou 450042, China 2. Xinxiang Medical University, Xinxiang 453000, China 3. Henan University, Kaifeng 475001, China
To optimize prescriptions of mangiferin-amino-modified mesoporous silica nanoparticles (MF-NH2-MSNs), and carry out oral pharmacokinetics evaluation.Solvent evaporation method was employed to prepare MF-NH2-MSNs. Single factor investigation combined with Box-Behnken response-surface design method was used to investigate the optimal prescriptions of MF-NH2-MSNs. Entrapment efficiency, drug loading, particle size, PDI value and ζ potential of MF-NH2-MSNs were determined. Existence of mangiferin in MF-NH2-MSNs powder was analyzed by X-ray powder diffraction (XRPD).release behavior of MF-NH2-MSNs powder in simulated gastrointestinal fluid was also investigated, and the release model was fitted. SD rats were administered intragastrically of MF-NH2-MSNs powder and blood samples were collected, oral pharmacokinetic behavior was investigated and the main pharmacokinetic parameters were calculated.Optimal prescriptions of MF-NH2-MSNs: ratio of NH2-MSNs to mangiferin was 1.7:1, concentration of mangiferin was 0.54 mg/mL and the stirring time was 11.28 h. Envelopment efficiency, drug loading, particle size, PDI value and ζ potential were (92.34 ± 1.04)%, (33.76 ± 0.17)%, (204.18 ± 8.66) nm, 0.120 ± 0.014 and (11.47 ± 0.81) mV, respectively. Mangiferin existed in an amorphous state in MF-NH2-MSNs powder. Drug releasehas obvious sustained-release characteristics in simulated gastrointestinal fluid, and release process conformed to Weibull model: lnln [1/(1-M/M)] = 1.032 0 ln-1.625. The1/2of MF-NH2-MSNs was increased to (4.19 ± 0.87) h,maxwas enhanced to (1 506.77 ± 404.80) ng/mL and oral relative bioavailability of MF-NH2-MSNs was increased to 4.02-fold.MF-NH2-MSNs increased the cumulative release of mangiferin and significantly promoted its oral absorption.
mangiferin; mesoporous silica nanoparticles; Box-Behnken response-surface design method; sustained-release characteristics; Weibull model; oral pharmacokinetics
R283.6
A
0253 - 2670(2024)08 - 2542 - 11
10.7501/j.issn.0253-2670.2024.08.005
2023-08-08
河南省高等学校重点科研项目计划(23B320013);河南应用技术职业学院“青年骨干教师”(2022-GGJS-H002);河南应用技术职业学院“首席技师”(2022-SXJS-HL01)
杨丽萍(1984—),女,硕士,讲师,研究方向为临床药学。Tel: (0371)67673862 E-mail: yanglp2023@126.com
通信作者:王风云(1973—),女,硕士,教授,研究方向为临床药学及妇科肿瘤研究。Tel: (0371)67673862 E-mail: wangfengyun1973@126.com
[责任编辑 郑礼胜]
