装载人参皂苷Rh2外泌体的制备及其对肝癌细胞株Huh7、PLC半数抑制浓度测算
2024-04-21李美乐赵梓粤金凯唐婷黄俊期王戈睿谢裕安
李美乐,赵梓粤,金凯,唐婷,黄俊期,王戈睿,谢裕安,,4
1 广西医科大学附属肿瘤医院实验研究部,南宁 530021;2 广西医科大学第一附属医院消化内科;3 广西中医药大学研究生院;4 广西壮族自治区妇幼保健院
肝细胞癌(HCC)是最常见的恶性肿瘤之一,发病率和死亡率都非常高[1]。中医药是防治恶性肿瘤的有效手段之一,在产生抗肿瘤效应的同时,还能够有效改善患者的临床症状,减轻放化疗不良反应,逆转耐药,提高生活质量[2]。人参皂苷Rh2(Ginsenoside Rh2,G-Rh2)是人参中重要生物活性物质之一,具有丰富的药理作用,包括抗炎、抗肿瘤及改善心脏功能等[3]。因抗癌效果优异,G-Rh2被认为是未来癌症治疗的新方向,但由于其生物利用度低,直接应用于人体不能发挥其显著的抗癌作用[4]。外泌体(Exos)是具有完整膜结构的细胞外囊泡,直径30~200 nm,主要负责细胞间的物质运输和信息传递[5]。随着近年来对Exos的研究,有学者[6-7]发现Exos可作为一种天然的纳米级药物载体,且与传统药物递送系统相比,Exos具有免疫原性低、递送效率高、可跨过多种生物屏障等优点,还能改善一些药物稳定性差、溶解度低、生物利用度不足和毒性较高的缺点。因此,Exos成为药物递送载体具有巨大的潜力。2022年5月—2023年10月,我们制备了装载G-Rh2的外泌体Exos@G-Rh2,并测算其对肝癌细胞株Huh7、PLC的半数抑制浓度(IC50),现报告如下。
1 材料与方法
1.1 G-Rh2、细胞、试剂与仪器 G-Rh2购于北京索莱宝科技有限公司,分子式:C36H62O8,分子量:622.87,高效液相色谱法检测纯度HPLC≥98%。肝癌细胞株Huh7及PLC均购自中国科学院昆明细胞库。DMEM高糖培养基购自美国GBICO公司;PBS磷酸缓冲盐溶液、0.25%胰蛋白酶-EDTA消化液、抗荧光衰减封片剂(含DAPI)购自北京索莱宝科技有限公司;青链霉素混合液、胎牛血清(FBS)购自BI生物公司。外泌体提取试剂盒及红色荧光标记染料购自上海宇玫博公司。Calnexin抗体、CD9抗体、CD63抗体、TSG101抗体购自美国Abcam公司。CR21N高速离心机、CP80NX超速离心机及超速离心管均购自日本日立公司;纳米颗粒跟踪分析仪购自德国Particle Metrix公司;LC-20A高效液相色谱仪及高效液相色谱柱购自日本岛津公司;NEPA21电转仪及EC-002S电击杯购自日本NEPA GENE公司;DYCZ-24DN电泳仪购自北京六一生物有限公司;倒置显微镜及荧光显微镜购自德国蔡司公司。
1.2 Huh7细胞中Exos的提取及纯化 取适量胎牛血清置于超速离心管中,在4 ℃下,以100000 g/min超速离心16 h,收集上清液并用0.45 μm滤膜过滤,即得无Exos的胎牛血清,置于-80 ℃冰箱保存备用。Huh7细胞培养于含10%无Exos胎牛血清、1%双抗的DMEM高糖培养液中,放置于37 ℃、5% CO2的恒温培养箱中进行常规培养,待细胞状态较好且细胞密度达80%左右时,收集细胞上清,使用外泌体提取纯化试剂盒分离提取Huh7细胞培养上清液中的Exos,具体步骤如下:将细胞上清液在4 ℃下以3000 g离心10 min去除杂质,然后取上清液与试剂盒中的外泌体浓缩液(Exosome Concentration Solution,ECS)按4∶1比例混匀,放置于4 ℃冰箱过夜,次日取出在4 ℃下以10000 g离心60 min,离心结束后弃上清,用适量PBS重悬管底沉淀后转至1.5 mL离心管中,在4 ℃下以12000 g再次离心2 min,取上清,转入外泌体纯化柱(Exosome Purification Filter,EPF),在4 ℃以3000 g离心10 min,EPF柱管底的液体即为纯化后的Exos溶液;按照BCA法用BCA蛋白定量试剂盒对其蛋白进行定量后放置-80 ℃冰箱备用。
1.3 Exos@G-Rh2的制备 采用电穿孔[8]法。将适量纯化的Exos与G-Rh2按质量比为2∶3轻轻混匀,取100 μL上述混合液液添加到2 mm电穿孔比色杯中,用NEPA21 Type Ⅱ进行电穿孔(穿孔脉冲两次,100 v、5 ms;传输脉冲五次,20 v、50 ms),37 ℃温育30 min以恢复外泌体膜,最后将上述混合液转移至100 KDa超滤管中离心(4 ℃,4000g,15 min),弃掉超滤管下管中的液体,加入适量PBS至超滤管中含滤膜的内管,反复吹打内管壁及底部,重悬Exos@GRh2,获得纯化的Exos@G-Rh2,BCA法测量其蛋白浓度后放置-80℃冰箱备用。
1.4 Exos@G-Rh2形态、粒径、载药量观察
1.4.1 Exos@G-Rh2、Exos形态观察 用移液枪吸取适量Exos@G-Rh2及Exos悬液分别滴加于碳覆膜铜网上,静置2 min,取适量2%磷钨酸溶液滴加到铜网上,然后用滤纸沥干,室温负染5 min,晾干后置于透射电子显微镜下观察Exos及Exos@G-Rh2形态并拍照。
1.4.2 Exos@G-Rh2、Exos粒径测算 分别取适量Exos及Exos@G-Rh2混悬液以超纯水稀释至合适浓度后,轻轻吹打使其分散完全,0.22 um微孔滤膜过滤后,取滤液注入纳米颗粒跟踪分析仪进行分析。
1.4.3 Exos@G-Rh2载药量的测定 采用高效液相色谱(High performance liquid chromatography,HPLC)法,参照文献[9-10]报道的方法,做适量修改。精密称取G-Rh2对照品20 mg,用DMSO溶解,定容成浓度为20 mg/mL的储备液。取适量G-Rh2储备液,加入甲醇,制成0.2、0.5、2、5、20、50、200 μg/mL的G-Rh2溶液。色谱柱:采用Inertsustain C18柱(250 mm×4.6 mm,5 μm),流动相:乙腈-水(60∶40),流速为1.0 mL/min;柱温30 ℃;检测波长203 nm;进样量20 μL。按照上述色谱条件进样测定,以G-Rh2对照品溶液浓度为横坐标(x),每个浓度对应的峰面积为纵坐标(y)绘制标准曲线。将Exos@G-Rh2溶液与适量的色谱甲醇充分混匀,超声破膜,13000 g/min离心10 min,去除杂质,取出上清液,转入进样瓶中,按照标准曲线色谱条件进样测定该溶液中G-Rh2含量,并计算Exos@G-Rh2载药量。Exos@G-Rh2载药量=Exos@G-Rh2中G-Rh2含量/Exos的蛋白含量×100%。
1.5 Exos@G-Rh2对Huh7细胞、PLC细胞的IC50测算
1.5.1 Huh7细胞、PLC细胞对Exos@G-Rh2的摄取情况观察 采用PKH-26荧光染色法。按照外泌体红色荧光标记染料(PKH-26)说明书配制染料工作液,根据Exos蛋白定量结果在Exos中加入适量的染料工作液,通过涡旋振荡器混匀后室温下避光孵育20 min,加入适量PBS,转至EPF柱离心(4 ℃,3000 g,10 min)去除多余染料,再次获取Exos即为PKH-26标记外泌体,待细胞贴壁后,将PKH-26标记的外泌体与适量完全培养基混匀,分别加入Huh7细胞、PLC细胞,孵育24 h后,4%多聚甲醛固定15 min, PBS清洗后用含DAPI的封片剂进行封片,使用荧光倒置显微镜观察Huh7细胞、PLC细胞对Exos@G-Rh2的摄取情况。显微镜下,PKH-26标记的外泌体显示为红色荧光。
1.5.2 Exos@G-Rh2、游离G-Rh2对Huh7细胞、PLC细胞的IC50测算 采用CCK-8法。将Huh7和PLC细胞分别以5000个/孔的密度接种至96孔常规培养,次日待细胞贴壁后更换为含游离G-Rh2及Exos@G-Rh2的培养基(G-Rh2浓度分别为0、5、10、15、20、25、30、35和40 μg/mL),培养48 h后,将CCK-8溶液与DMEM培养基按1∶9比例混匀配制CCK-8工作液,随后以细胞换液方式加入96孔板,每孔100 μL,在37 ℃下避光培养2 h,采用酶标仪测定各孔450 nm处的吸光度值,计算细胞存活率。细胞存活率=(实验孔吸光度值-空白孔吸光度值)/(对照孔吸光度值-空白孔吸光度值)×100%。使用GraphPad Prism软件计算药物半数抑制浓度(Half maximal inhibitory concentration, IC50)。
1.6 统计学方法 采用Graph Pad Prism统计软件。计量资料呈正态分布时以±s表示,比较用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Exos@G-Rh2的形态、粒径、载药量
2.1.1 Exos@G-Rh2、Exos形态比较 透射电镜下Exos及Exos@G-Rh2形态见图1,Exos及Exos@G-Rh2在电镜下均可见经典的茶托状结构,且有质膜包裹,形态无显著差异。
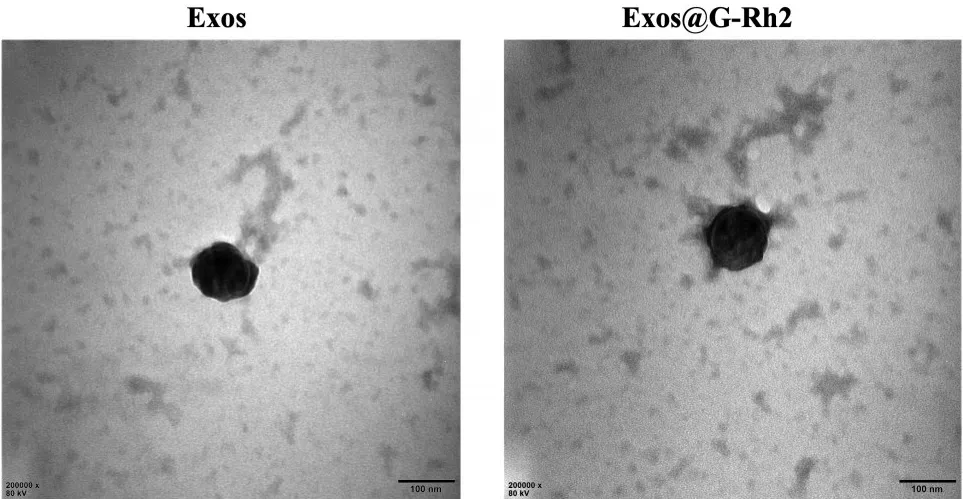
图1 透射电镜下Exos及Exos@G-Rh2形态
2.1.2 Exos@G-Rh2、Exos粒径比较 Exos@G-Rh2、Exos粒径分别为(156.90 ± 10.23)nm、(143.47 ±8.62)nm,两者相比,P>0.05。
2.1.3 Exos@G-Rh2载药量 G-Rh2标准曲线方程为:y=11963×x-12868(R2=0.9997),Exos@G-Rh2载药量为24.25% ± 0.27%。
2.2 Exos@G-Rh2对Huh7细胞、PLC细胞的IC50测算结果
2.2.1 Huh7细胞、PLC细胞对Exos@G-Rh2的摄取情况 荧光显微镜下观察到,在Huh7细胞、PLC细胞中,红色荧光清晰可见,主要在细胞质中,说明PKH-26标记的Exos@G-Rh2可以被Huh7细胞、PLC细胞摄取。
2.2.2 Exos@G-Rh2、游离G-Rh2对Huh7细胞、PLC细胞的IC50比较 在Huh7细胞中,游离G-Rh2的IC50值为(34.96 ± 1.37)μg/mL,而Exos@G-Rh2的IC50值为(29.74 ± 2.83)μg/mL,两者相比,P<0.05;在PLC细胞中,游离G-Rh2的IC50值为(33.41 ± 1.47)μg/mL,而Exos@G-Rh2的IC50值为(30.08 ± 1.12)μg/mL,两者相比,P<0.05;以上结果均提示相同浓度下Exos@G-Rh2对Huh7细胞、PLC细胞活力的抑制效果强于游离G-Rh2。
3 讨论
HCC是肝脏最常见的原发性恶性肿瘤,死亡率很高[11]。HCC常见治疗方法包括化疗、放疗、手术、分子靶向治疗等,目前手术仍是治疗肝癌的主要手段。但由于HCC起病隐匿、病程发展迅速及易转移复发等特点,导致大多数患者确诊时已属中晚期,无法手术治疗,生存率大大降低,预后并不理想[12]。同时中晚期的HCC患者身体机能严重下降,多脏器功能衰竭,并出现转移灶,故应选择不良反应小的抗肿瘤药物进行辅助治疗,尽量延长患者生存期,减少死亡率,提高生活质量。中草药除抗肿瘤作用外,还能改善患者免疫功能,逆转肿瘤耐药、减轻放化疗不良反应,已经成为我国防治恶性肿瘤的有效手段之一。
G-Rh2是人参中的有效活性成分,具有诱导肿瘤细胞周期阻滞、逆转耐药及抑制肿瘤细胞的增殖、迁移及侵袭等作用[13]。但因其水溶性较差,难溶于水,治疗效果并不理想。近年来,利用药物载体传递GRh2的研究逐渐受到关注,顾倩等[14]采用离子交联的方法制备壳聚糖纳米粒子包载人参皂苷Rh2,结果表明该载药纳米粒子分布均一、性能稳定,能够被A549细胞摄取,且较游离药物抑制A549细胞的增殖作用增强。XIA等[15]采用薄膜分散法制备了人参皂苷Rh2-混合胶束体系(Rh2-M),并通过体内、体外实验证明,Rh2-M不仅可以提高G-Rh2的溶解度、增加G-Rh2在肿瘤部位的浓度和滞留时间,还能增强G-Rh2对肺癌的抑制作用。尽管以聚合物胶束、纳米粒、脂质体等作为载体可以解决药物溶解度差及生物利用度低等难题,但也存在成本高、毒性高、缺乏靶向性等不足。
Exos是具有完整膜结构的细胞外囊泡,直径为30~200 nm,不仅存在于细胞内,还广泛分布于血液、尿液、唾液、母乳、羊水、腹水及胆汁等多种体液中[16]。作为一种新型的药物递送载体,Exos可以在细胞间进行物质和信息传递,能将其包被的治疗药物、基因等“货物”靶向递送给特定的细胞或组织[17]。现有的载药方法可分为内源性载药和外源性载药两大类。内源性装载是通过对亲本细胞进行基因修饰使其产生具有目的药物的Exos,外源性装载需要先分离提纯Exos,再将药物载入其中,常用的方法包括使用电穿孔、挤出、超声和冻融循环等[18]。作为一种新型的天然药物递送载体,Exos具有免疫原性低、递送效率高和生物相容性好等优势。
综上所述,我们选用Exos作为载体递送G-Rh2,通过电穿孔法成功制备了Exos@G-Rh2,并在体外考察了其对肝细胞癌活力的影响,结果显示Exos负载G-Rh2前后形态结构无明显变化,相较于游离G-Rh2,Exos@G-Rh2在体外对肝癌细胞的活力具有更强的抑制效果,提示Exos作为药物载体递送人参皂苷Rh2增强其抗肿瘤效果可行,这为进一步探讨Exos作为药物载体的潜在价值及G-Rh2的抗肿瘤作用奠定基础。
