酸性、中性及碱性痕量气体在SO3+CH3OH大气反应中的催化机制研究
2024-04-20李荣荣卫书琴李泽尧张田雷
李荣荣, 丁 超, 罗 琴, 卫书琴, 李泽尧, 张田雷
陕西理工大学 化学与环境科学学院, 陕西 汉中 723000
作为大气中硫氧化物转化的关键物种之一,三氧化硫(SO3)是二氧化硫(SO2)最主要的氧化产物,可导致酸雨和大气气溶胶的形成[1-3],对大气环境质量、人类健康以及区域气候变化有着重要影响[4-6]。已有研究表明,SO3的主要消耗途径是通过其与大气中浓度较大的水分子发生水解反应进行的[7-8]。此外,SO3与大气中诸如RCOOH、R2COO和甲醇(CH3OH)等物种发生的反应在区域污染地区也是不可忽视的[9-14]。CH3OH作为对流层中含氧挥发性有机化合物的主要成分之一,是仅次于甲烷(CH4)的第二大挥发性有机化合物[15]。因此,研究SO3与CH3OH的反应对甲醇污染区域中SO3的消耗具有重要的意义。
近年来,国内外课题组对SO3+CH3OH反应进行了实验和理论研究。张秀辉教授课题组[16]采用CCSD(T)-F12/cc-pVDZ-F12//M06-2X/6-311++G(3df,3pd)方法研究了SO3+CH3OH直接反应,发现其反应能垒为20.93 kcal/mol,在298 K时反应的速率常数为1.20×10-19cm3/(molecules·s),表明SO3+CH3OH直接反应在实际大气环境下较难发生。基于此,该课题组研究了CH3OH对SO3+CH3OH反应的影响,发现CH3OH的加入使反应能垒降低至3.06 kcal/mol,在298 K时反应的速率常数为5.23×10-12cm3/(molecules·s),这与SHEN G L等[17]采用荧光法得到SO3+CH3OH反应的速率常数值[(1.17±0.16)×10-13cm3/(molecules·s),(295±2) K)]接近。然而有关大气中浓度较大的酸性(H2SO4)、中性(H2O)和碱性(NH3)痕量气体对SO3+CH3OH反应未曾研究。已有研究表明,水分子对CH2OO中间体异构化反应[18]以及HO2分别与HO2[19]、HO[20]抽氢反应,均起着明显的促进作用。此外,近期的研究发现H2SO4和NH3比H2O具有更为明显的催化作用。例如昆明理工大学宁平教授课题组[21]发现在COS水解反应中H2SO4的催化效果明显优于H2O,其原因可能是相比于H2O而言,H2SO4的存在不仅更有利于C(COS)…O(H2O)键的形成,同时更有利于氢原子(或质子)的转移。吉林大学刘靖尧教授课题组[22]采用CCSD(T)/aug-cc-pVDZ//MP2/aug-cc-pVDZ方法研究了NH3对SO2水解反应的影响,发现NH3的存在能将SO2水解反应能垒降低至1.89 kcal/mol,且与H2O参与SO2水解相比,NH3催化反应具有更为明显的催化效果。因而H2O、H2SO4、NH3是否在SO3+CH3OH反应中表现出明显的催化效果是本文的主要研究目标。
基于此,本文采用量子化学方法CCSD(T)-F12a/cc-pVDZ-F12//M06-2X/6-311+G(2df,2pd)系统地研究不同催化剂X(X=H2O、H2SO4、NH3)存在下SO3+CH3OH的反应机理。在此基础上,结合主方程(ME/RRKM)理论计算X参与SO3+CH3OH反应的有效速率常数,用以评估大气痕量气体X对SO3+CH3OH反应的影响效果。
1 计算方法
1.1 电子结构计算
M06-2X泛函[23-24]不仅可以可靠地描述非共价相互作用,而且可以准确地评估许多大气反应的几何构型和零点能(ZPE)。基于此本文采用Gaussian 09[25]程序中的M06-2X泛函和6-311+G(2df,2pd)基组对所有反应物、前中间体(IM)、后中间体(IMF)、过渡态(TS)和产物的几何构型进行优化。反应物、中间体及产物均为实频,过渡态有且仅有一个虚频。采用内禀反应坐标(IRC)[26-27]确保过渡态(TS)与相应反应的前后中间体的连接性。为获得较为准确的能量信息采用ORCA程序[28]中的CCSD(T)/aug-cc-pVTZ方法计算各驻点几何构型的单点能。
1.2 速率常数计算
首先通过使用Polyrate 2017软件中的VRC-VTST[29]计算有、无X参与下SO3+CH3OH反应的高压极限(HPL)[30]速率常数。基于获得的HPL速率常数,通过使用多势阱主方程求解器(MESMER)[31],计算有、无X参与下SO3+CH3OH反应的双分子速率常数。具体而言,通过拉普拉斯逆变换(ILT)方法[32]计算反应物到前中间体复合物的无势垒步骤。从前中间体经过过渡态到后中间体的过程则采用于Rice-Ramsperger-Kessel-Marcus(RRKM)理论[33]进行计算,ILT方法和RRKM理论分别用公式(1)和(2)表示:
(1)
(2)
其中,σ和σ≠分别表示反应物和过渡态的旋转对称数;m和m≠分别表示反应物和过渡态的光学异构体数;ge和g≠分别代表反应物和过渡态的电子态简并度;E0表示反应的临界能;E×(E-E0)为过渡态能量之和;ρ(E)是反应物态密度,Q(β)是相应的正则配分函数。在以N2为浴气,采用〈ΔEdown〉=250.0×(T/298)0.8指数降模型的温度相关指数计算了能量碰撞传递过程[34]。该过程使用Lennard-Jones(L-J)参数ε/kB=71.4 K和σ=3.798 Å用于N2,而ε/kB=218.1 K和σ=3.13 Å用于SO3。
2 结果与讨论
通道中的前中间体、过渡态和后中间体分别用IM、TS和IMF表示。H2O、H2SO4和NH3存在下的各驻点物种分别用后缀WM、SA和AM表示。
2.1 有、无H2O参与SO3+CH3OH反应
为了得到H2O、H2SO4和NH3的实际催化效果,采用CCSD(T)/aug-cc-pVTZ//M06-2X/6-311+G(2df,2pd)方法对SO3+CH3OH反应机理进行研究计算。如图1(a)所示,当前的研究结果与张秀辉教授课题组[16]的研究结果非常吻合,因此,我们采用的计算方法是合理的,可以进一步研究计算H2O、H2SO4或NH3对SO3+CH3OH反应的影响。
图1(a)给出了SO3+CH3OH反应的势能曲线。SO3+CH3OH反应首先会形成一个稳定化能为2.0 kcal/mol的四元环状前中间体IM,之后经由过渡态TS形成后中间体IMF。由于其反应能垒高达21.2 kcal/mol,因此在实际大气条件下该反应不易发生。
图1(b)给出了H2O参与SO3+CH3OH反应的势能曲线。由图可知,从反应物SO3+CH3OH+H2O出发,主要有三种反应方式,分别是SO3…CH3OH+H2O、SO3…H2O+CH3OH和CH3OH…H2O+SO3,由于SO3…CH3OH较SO3…H2O和CH3OH…H2O的稳定化能大了2.5 kcal/mol和5.0 kcal/mol,因而H2O催化SO3+CH3OH反应主要以SO3…CH3OH+H2O方式进行。H2O可以作为“桥梁”促进氢原子转移,进而对SO3+CH3OH反应具有明显的促进作用。具体来说,H2O的加入不仅能够增加前中间体稳定性(0.5 kcal/mol),而且能显著降低反应能垒(14.9 kcal/mol)。与SO3+CH3OH反应(Channel R)的速率常数(kR)相比,在213~320 K温度范围内,H2O参与SO3+CH3OH反应(Channel WM)的速率常数(kWM)增大了8个数量级,见表1。表明H2O对SO3+CH3OH反应具有明显的促进作用。
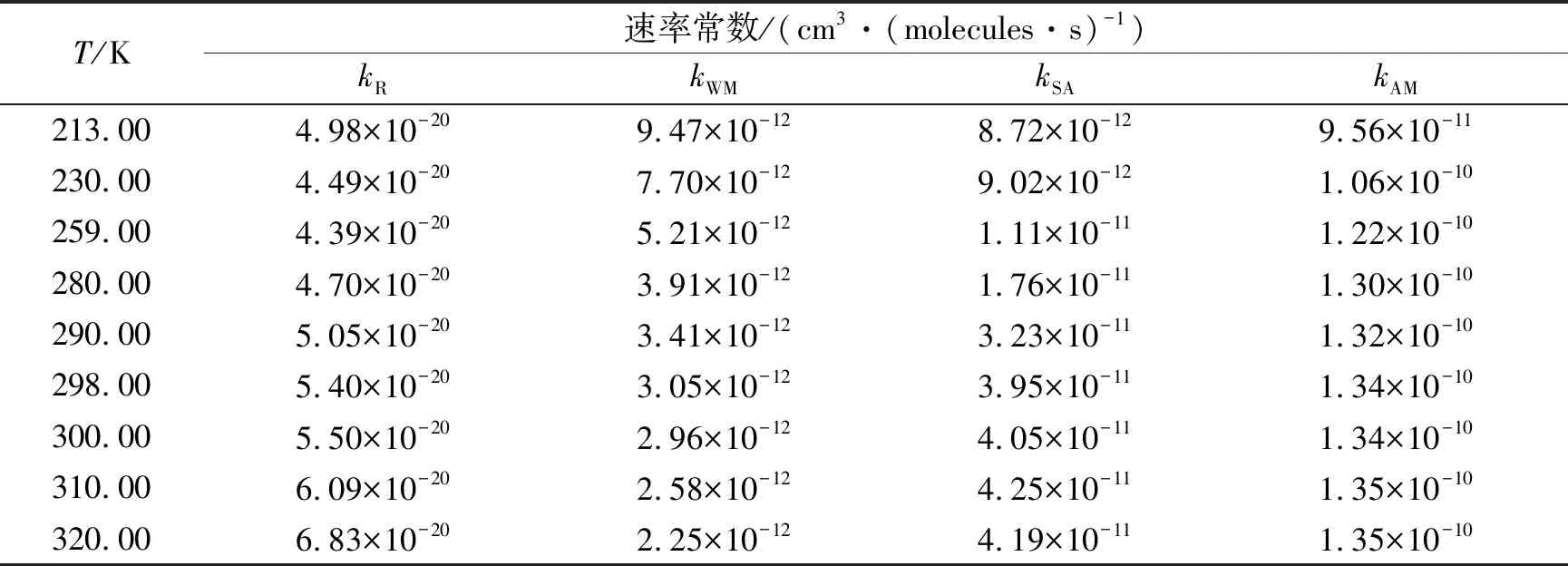
表1 有、无H2O、H2SO4、NH3参与SO3+CH3OH反应的速率常数
2.2 H2SO4参与SO3+CH3OH反应
图2给出了H2SO4参与SO3+CH3OH反应的势能曲线。与H2O参与SO3+CH3OH反应类似,从反应物CH3OH+SO3+H2SO4出发,SO3先与CH3OH发生碰撞形成SO3…CH3OH复合物,随后SO3…CH3OH与H2SO4碰撞形成稳定化能为9.3 kcal/mol的前中间体IM_SA。中间体IM_SA为八元环状稳定结构,其稳定化能比中间体IM_WM的对应值增加了6.8 kcal/mol。从中间体IM_SA开始,反应通过过渡态TS_SA形成后中间体IMF_SA,反应能垒为2.2 kcal/mol。过渡态TS_SA经过双氢原子转移反应机制,其中H2SO4充当H原子从CH3OH转移到SO3中O原子的桥梁。如表1所示,在213~320 K温度范围内,Channel SA的速率常数(kSA)比Channel WM的速率常数(kWM)增大了1个数量级,表明相比于H2O参与反应而言,H2SO4具有更明显的催化效果。

图2 本文方法中H2SO4参与SO3+CH3OH反应的势能曲线
2.3 NH3参与SO3+CH3OH反应
NH3参与SO3+CH3OH反应主要通过加成抽氢反应机制完成。具体而言,CH3OH的H原子经由NH3转移到SO3的O原子上,剩下的CH3O基团直接加成到SO3的S原子上。图3给出了NH3参与SO3+CH3OH反应的势能曲线。NH3参与SO3+CH3OH反应(Channel AM)起始于CH3OH+SO3+NH3,先形成复合物SO3…CH3OH,之后再与第三种反应物NH3发生碰撞,得到由一个范德华力(S…O1,1.88 Å)和两个氢键(N…H4,1.49 Å和O4…H1,2.58 Å)相互作用构成的六元环状前中间体(标记为IM_AM)。与前中间体IM_WM中O1…H3键和IM_SA中O4…H3键长相比,前中间体IM_AM中的N…H4键的键长缩短了0.1 Å和0.02 Å,表明碱性气体NH3较中性气体H2O和酸性气体H2SO4更容易从CH3OH中得到H原子。从前中间体IM_AM出发,经由无势垒过程到达过渡态TS_AM后形成后中间体IMF_AM。与Channel R、Channel WM和Channel SA相比,NH3的加入可以使反应成为无势垒过程。此外表1中速率常数计算结果表明,在213~320 K温度范围内,Channel AM的速率常数(kAM)比Channel WM(kWM)和Channel SA(kSA)的速率常数值增大了1~2个数量级,表明与H2O和H2SO4相比,NH3的催化效果更好。

图3 本文方法中NH3参与SO3+CH3OH反应的势能曲线
2.4 H2O、H2SO4和NH3参与SO3+CH3OH反应的有效速率常数

(3)
(4)
(5)

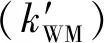

表2 计算所得H2O、H2SO4、NH3浓度与SO3+CH3OH反应的有效速率常数
3 结论
本文采用CCSD(T)-F12a/cc-pVDZ-F12//M06-2X/6-311+G(2df,2pd)量子化学方法结合主方程(ME/RRKM)理论对H2O、H2SO4、NH3存在下SO3+CH3OH反应机理和速率常数进行了研究。结论如下:
1)从能垒角度而言,SO3+CH3OH直接反应的能垒高达21.2 kcal/mol,反应不容易发生。H2O、H2SO4和NH3的加入使得前、后中间体的稳定化能分别增加0.5~7.3 kcal/mol和0.3~5.8 kcal/mol,在不同程度上降低了SO3+CH3OH反应的能垒,能垒的降低程度顺序为NH3>H2SO4>H2O。
2)有效速率常数计算表明,在0~15 km的高度范围内,H2O参与SO3+CH3OH反应的有效速率常数比H2SO4和NH3参与反应的有效速率常数大了3~8个数量级,说明酸性催化剂H2SO4和碱性催化剂NH3不能与中性催化剂H2O相竞争。
