CD41单克隆抗体建立慢性免疫性血小板减少症小鼠模型失败的初步分析
2024-04-20张珺朱瑞芳吕亚茹李若兰张淑文力娜宋凯曾靖晖韩世范
张珺 朱瑞芳 吕亚茹 李若兰 张淑文 力娜 宋凯 曾靖晖 韩世范

基金項目 山西医科大学第一医院博士启动基金项目,编号:YB2203;山西省基础研究计划项目,编号:202203021221251
作者简介 张珺,硕士研究生在读
通讯作者 韩世范,E?mail:shifan.han@sxmu.edu.cn
引用信息 张珺,朱瑞芳,吕亚茹,等.CD41单克隆抗体建立慢性免疫性血小板减少症小鼠模型失败的初步分析[J].护理研究,2024,38(7):1139?1145.
Preliminary analysis of CD41 monoclonal antibody failed to establish a mouse model of chronic immune thrombocytopenia
ZHANG Jun, ZHU Ruifang, LYU Yaru, LI Ruolan, ZHANG Shuwen, LI Na, SONG Kai, ZENG Jinghui, HAN Shifan
Shanxi Medical University, Shanxi 030001 China
Corresponding Author HAN Shifan, E?mail: shifan.han@sxmu.edu.cn
Abstract Objective:CD41 monoclonal antibody(MWReg30) was injected into Balb/c mice at different times and doses to investigate whether this method can construct a stable model of chronic Immune thrombocytopenia(ITP).After the modeling,the extract of Codonopsis pilosula was used to intervene the mice,in order to clarify its adjustment effect on abnormal platelet count of model mice.Methods:Firstly,chronic ITP model was established in Balb/c mice using MWReg30,and the effect of Codonopsis pilosula's extract on the model mice was investigated after antibody injection.Subsequently,different groups of mice were given a second injection and a double dose of MWReg30 to determine whether the increase in the number of injections and dose was conducive to the establishment of chronic ITP model.Results:It was confirmed that the method of injecting MWReg30 into mice could not keep the platelet number of Balb/c mice at a low level for a long time,so the method could not establish a stable chronic ITP model,and it was difficult to achieve this purpose by increasing the number and dose of antibody injection. However,second and double dose injections of MWReg30 resulted platelet count antibody rebound to higher levels within 7 days and 14 days after the end of the injection,and the low dose of Codonopsis pilosula extract could decrease the abnormal platelet count of the model mice.Conclusion:The intraperitoneal injection of MWReg30 in mice could not reproduce stable chronic ITP models,and whether this method can be an ideal way to construct chronic ITP models remains to be further confirmed.Increasing the injection dose of MWReg30 can prolong the maintenance time of low platelet count in model mice,and low dose of Codonopsis pilosula extract may correct the abnormal elevated platelet count in model mice.
Keywords chronic immune thrombocytopenia; CD41 monoclonal antibody; Codonopsis pilosula; model construction; platelet count
摘要 目的:通过向Balb/c小鼠腹腔注射不同次数和不同剂量CD41单克隆抗体(MWReg30),探究该方法能否构建出一种稳定的慢性免疫性血小板减少症(ITP)模型,并在造模结束后采用党参提取液干预此模型小鼠,以明确其对造模小鼠异常血小板计数的调整作用。方法:首先,使用MWReg30的常用剂量对Balb/c小鼠建立慢性ITP模型,并在抗体注射结束后探究党参提取液对造模小鼠的影响;随后,分别对不同组别的小鼠进行MWReg30的2次注射和2倍剂量注射,明确注射次数和剂量的增加是否有助于建立慢性ITP模型。结果:向小鼠体内注射MWReg30的造模方式不能使Balb/c小鼠血小板数量长期维持低水平,并且通过增加抗体注射次数和剂量的方法也难以实现此目的。但是,MWReg30的2次注射和2倍剂量注射分别使小鼠血小板计数在抗体注射结束7 d内和14 d内反弹升高至较高水平,且低剂量党参提取液干预造模小鼠可使其异常升高的血小板数量呈现下降趋势。结论:对小鼠腹腔注射MWReg30的造模方法無法复制出稳定的慢性ITP模型,此方法能否成为一种理想的慢性ITP模型建立方式仍有待进一步证实。而增加MWReg30的注射剂量能够延长模型小鼠血小板计数低水平的维持时间;且低剂量的党参提取液可能会对造模小鼠异常升高的血小板数量起纠正作用。
关键词 慢性免疫性血小板减少症;CD41单克隆抗体;党参;模型构建;血小板计数
doi:10.12102/j.issn.1009-6493.2024.07.002
长期以来,人类疾病发生发展的复杂性致使其发生机制及防治机制的研究十分困难,且单纯以人为研究对象所存在的局限性无疑会使人类疾病研究的困难程度加剧[1]。因而,寻找并建立起稳定性好、可重复且具有高度特异性的人类疾病动物模型不仅能为动物福利提供保障,而且有利于高度匹配地应用于临床试验,从而为促进人类健康带来极大的益处[2?3]。免疫性血小板减少症(immune thrombocytopenia,ITP)是一种临床较为常见且发病复杂的自身免疫性疾病,目前能够应用于该疾病研究中的ITP动物模型构建方法多样,主要包括主动自发模型和被动免疫模型[4]。其中,体内注射CD41单克隆抗体(MWReg30)的ITP模型建立方式是学术界普遍认可且符合慢性ITP病人临床表现的造模方式[5]。然而,相关报道曾指出,此方式构建的ITP动物模型的血小板数量可能随着时间的推移出现反弹[6?7]。因此,本研究采用对Balb/c小鼠腹腔注射MWReg30的方法,以明确该方法能否复制出慢性ITP小鼠模型,并进一步探究增加MWReg30的注射次数和剂量是否有助于慢性ITP模型的建立,意图为未来该种模型的构建和相关的动物实验提供实践依据。
党参作为一种起源于我国古潞州的桔梗科党参属植物,自古以来,就被发现其具有养血生津的功效,因而至今仍常应用于血液疾病的防治和食养中。研究表明,党参不仅能够明显升高血虚证小鼠的血小板数量[8],且在抑制冠心病血淤症病人血小板聚集方面发挥着重要作用[9]。此外,研究表明,党参中的多种成分在机体免疫方面表现出了巨大的调节潜能,如党参多糖能够通过调节淋巴细胞和细胞因子含量的方式增强免疫调节活性[10],党参中的黄酮类化合物木犀草素能通过调节相关的信号通路起到维持机体Th17/Treg免疫平衡的作用[11]。且自2018年以来,党参开始被列入既是食品又是中药材的物质(食药物质)中进行管理和开展全国各省的试点工作[12]。伴随着我国一系列鼓励政策的出台和颁布,研究党参作为食药物质的功效和作用已成为学界的热点和重点话题。而ITP作为一种免疫性出血性疾病,以血小板过度减少和巨核细胞功能障碍为特点[13]。因此,本研究选用对血液疾病和免疫疾病均具有良好疗效的党参,探索其对MWReg30体内注射所构建的模型小鼠的食疗作用,从而为今后ITP病人的科学食疗和护理提供实验依据。
1 材料与方法
1.1 材料
实验动物为无特定病原体(SPF)级雌雄各半Balb/c小鼠,6~8周,体质量为18~28 g,由北京华阜康科技生物股份有限公司提供。饲养条件满足12 h昼夜节律交替,温度(22±2)℃,湿度50%~70%。本研究所有涉及动物的实验均按照《动物实验伦理原则和指南》进行。实验所需试剂包括MWReg30(美国Bilolegend,16?0411?38);小鼠CD3εAPC流式试剂(美国Bilolegend,1000312);小鼠CD4FITC流式试剂(美国Bilolegend,100510);小鼠CD8aPE流式试剂(美国Bilolegend,100708);小鼠CD19PE/Cynine7流式试剂(美国Bilolegend,115520)。
1.2 实验分组及ITP小鼠模型的构建
首先,按照随机数字表法将50只Balb/c小鼠随机分为模型1组、对照1组、党参低剂量组、党参中剂量和党参高剂量组5组,每组10只。其中,模型1组和党参低、中、高剂量组的小鼠采用MWReg30的常用剂量构建ITP模型[14],在第1天和第2天注射抗体剂量为68 ?g/kg,第3天注射102 ?g/kg,第4天~第8天每天注射136 ?g/kg[15]。随后,采用2次注射抗体的方式探究MWReg30对Balb/c小鼠的影响,即在首次实验的流式细胞术检测结束后,对造模未成功剩余的5只模型1组小鼠于首次抗体注射结束的第30天进行第2次ITP模型的建立,且抗体的注射时间和剂量与首次造模完全一致。此外,本实验还探究了双倍常规剂量的MWReg30对Balb/c小鼠的影响,将12只Balb/c小鼠随机分为2组,分为模型2组和对照2组,各6只,模型2组小鼠MWReg30的注射剂量为模型1组的2倍,在第1天和第2天注射的抗体剂量为136 ?g/kg,第3天注射204 ?g/kg,第4天到第8天每天注射272 ?g/kg。通过腹腔注射的方法,将由磷酸盐缓冲液(PBS,PH为7.2)稀释而成的200 μL MWReg30注入需造模的模型1组、党参低、中、高剂量组以及模型2组小鼠体内。在模型1组和模型2组构建ITP模型期间,对照1组和对照2组的小鼠则直接每日腹腔注射200 μL PBS溶液。
1.3 党参提取液的制备
购自山西和仁堂中药饮片有限责任公司的党参根粉碎,浸泡1 h,3倍水煎煮1.5 h。纱布过滤,药液备用,药渣加2.5倍水煎煮1 h。过滤,合并2次滤液,常压浓缩至2.56 mL党参水煎液相当于原药材1 g,将所得的党参提取液放入-20 ℃冰箱保存。
1.4 给药
根据《中国药典》中党参的使用剂量为0~30 g/d,以15 g/d为低剂量组,中、高剂量以此加倍,通过实验动物与人体表面积等效量换算比率 “小鼠剂量=人体用量(g)/70(kg)×9.1”计算得党参生药给药剂量。经计算得党参低、中、高剂量组的小鼠每日党参生药给药剂量分别为1.95、3.90、7.80 g/kg,并换算得党参低、中、高剂量组的小鼠每日党参提取液给药量分别为0.1、0.2、0.4 mL。模型1组和对照1组的小鼠则每日予0.2 mL生理盐水灌胃。各组小鼠每日给药1次,连续灌胃28 d,观察治疗效果。
1.5 评价指标
1.5.1 小鼠血小板计数的检测
所有小鼠均在抗体注射前(造模前)、抗体注射期间第2天(造模2 d)、第4天(造模4 d)、第6天(造模6 d)、第8天(造模8 d)以及抗体注射后第7天(造模后7 d)、第14天(造模后14 d)、第21天(造模后21 d)和第28天(造模后28 d)经尾静脉取血,使用全自动血细胞分析仪进行血小板计数检测。
1.5.2 小鼠体质量的检测
所有小鼠均在抗体注射前、抗体注射期间以及抗体注射后每隔7 d使用电子秤进行称重。
1.5.3 小鼠脾脏T细胞亚群及B细胞流式细胞术检测
模型1组和对照1组在第2次抗体注射前,随机各取5只处死,采用流式细胞术检测T细胞亚群及B细胞。采取颈椎脱臼处死小鼠后,无菌操作取出小鼠脾脏并制备脾脏单细胞悬液。小鼠脾脏研磨后加入1 mL PBS冲洗,收集脾细胞悬液,1 000 rpm/min离心5 min弃去上清,加入红细胞裂解液,混悬后静置8 min;300目滤网过滤悬液,1 000 rpm/min离心5 min弃去上清,获得的白色沉淀PBS清洗2次,使用1 mL PBS重悬细胞后计数,并调整细胞浓度为1×106/mL,加入APC anti?mouse CD3ε 5 μL、FITC anti?mouse CD4 0.5 μL、PE anti?mouse CD8a 1.25 μL以及PE/Cynine7 anti?mouse CD19 1.25 μL,同时设空白对照管和同型对照管,混匀后避光染色30 min,800 rpm/min离心10 min弃去上清,用300 μL的PBS重悬细胞,于流式细胞仪上机检测小鼠脾脏T淋巴细胞亚群和B细胞比例。
1.6 统计学方法
采用SPSS 21.0进行数据统计分析。所有实验结果数据均符合正态分布,采用均数±标准差(x±s)表示,并应用Microsoft Office Excel 2019进行折线图的绘制。多组间比较采用单因素方差分析(One?Way ANOVA),多组数据方差齐时选用ordinary ANOVA检验,方差不齐时选用Brown Forsythe and Welch ANOVA检验。两组间比较时,两组数据方差齐时选用非配对t检验,方差不齐时选用Welch's 校正非配对检验。以P<0.05为差异有统计学意义。
2 结果
2.1 常规剂量MWReg30首次腹腔注射小鼠的血小板计数、体质量及脾脏淋巴细胞亚群变化
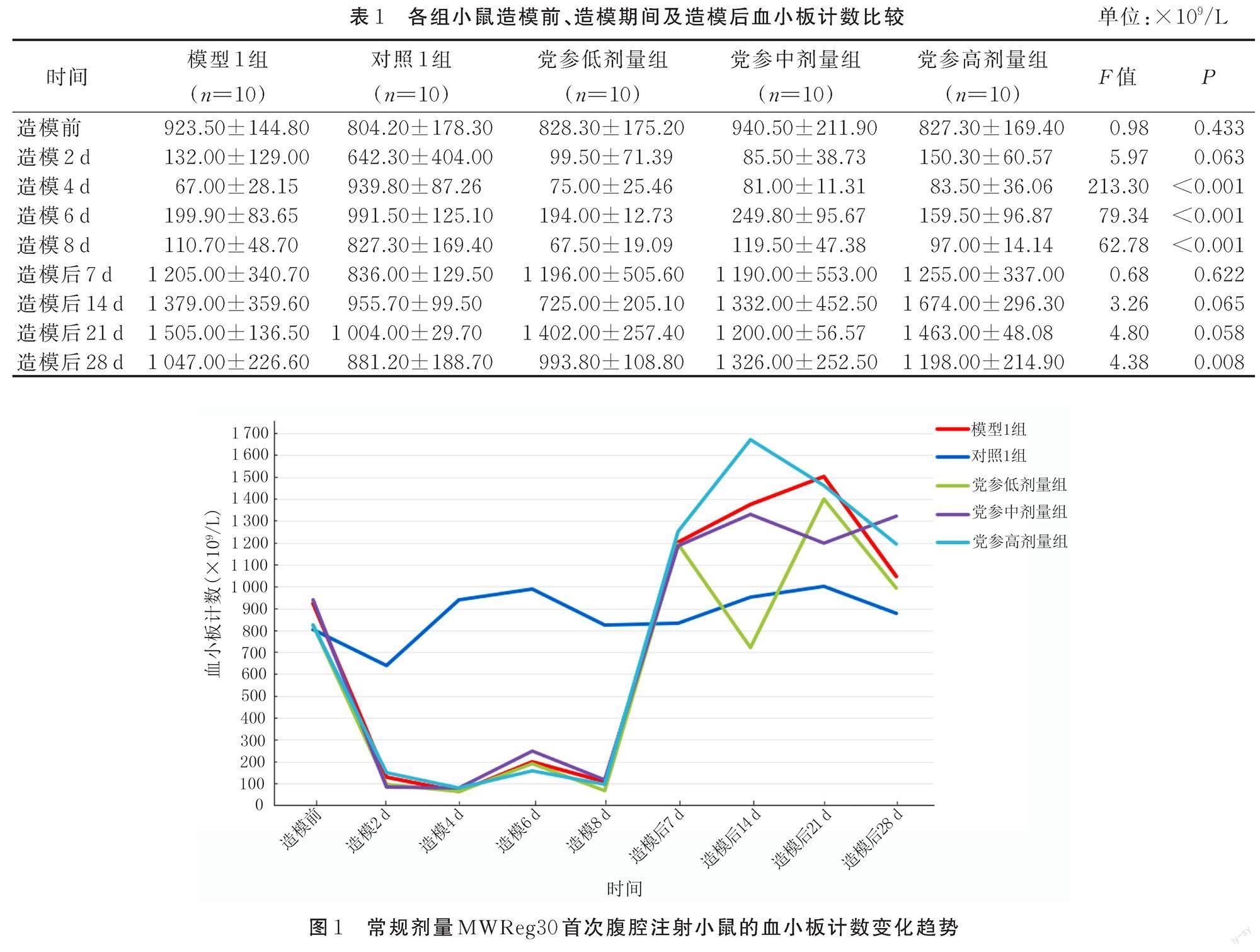
模型1组、对照1组和党参低、中、高剂量组小鼠的血小板计数比较见表1,血小板计数变化见图1,体重比较见表2,淋巴细胞比例比较见表3。
2.2 常规剂量MWReg30 2次腹腔注射小鼠的血小板计数及体质量变化
重新造模的模型1组和对照1组小鼠的血小板计数比较见表4,血小板计数变化趋势见图2以及体质量比较见表5。
2.3 双倍常规剂量MWReg30腹腔注射小鼠的血小板计数及体质量变化
模型2组和对照2组小鼠的血小板计数比较见表6,血小板计数变化折线图见图3以及体重比较见表7。
3 讨论
ITP作为一种自身免疫性出血性疾病,发生的主要原因是机体产生的血小板膜糖蛋白自身抗体与血小板膜糖蛋白结合所导致的外周血小板减少。其中,起重要作用的血小板膜糖蛋白为GPⅡb/Ⅲa,也被称作CD41/CD61[16?17]。CD41是在巨核细胞和血小板表面特异性表达的膜糖蛋白[18],能够与CD61相结合形成血小板膜糖蛋白复合物GPⅡb/Ⅲa[19]。在ITP的发生发展过程中,该复合物不仅起着调节血小板的黏附、聚集和活化功能的作用,而且能够反映体内血小板的功能和状态[20]。MWReg30是大鼠抗小鼠血小板膜糖蛋白GPⅡb/Ⅲa单克隆抗体,是通过免疫大鼠获得的免疫球蛋白IgG1[21],通过与小鼠CD41发生反应,起到影响血小板功能和状态的作用,最终导致外周血中血小板破坏增加。研究表明,采用MWReg30建立的ITP模型在未经干预的情况下可维持长达4~7周的时间[22]。另有文献报道,MWReg30对C57BL/6小鼠血小板的破坏作用与其静脉注射的剂量成正比,即MWReg30能够呈剂量依赖性诱导小鼠的血小板减少[23]。因而,本研究通过对Balb/c小鼠体内注射不同次数和不同剂量的MWReg30,探究此抗体对小鼠体质量、血小板计数以及T淋巴细胞亚群和B细胞多项指标产生的影响。首先,根据3次MWReg30注射前、注射期间及注射后小鼠的血小板计数变化,发现该抗体在注射期间能够使血小板数量出现显著下降,并可在注射期间达到ITP模型建立成功所要求的血小板数值[24?25]。但值得注意的是,MWReg30注射结束后,小鼠血小板计数低水平的状态无法长时间维持。常规剂量MWReg30首次注射小鼠的血小板计数在造模后7 d已经反弹至高于正常水平,而双倍常规剂量MWReg30注射小鼠的血小板计数在造模后14 d升高至高于对照组水平。其次,从MWReg30对小鼠体重的影响来看,该抗体对体质量的影响较小。除常规剂量MWReg30的首次注射期间及注射后7 d,小鼠体质量呈现出明显的下降趋势,而常规剂量MWReg30的2次注射和双倍常规剂量MWReg30的体内注射建立ITP模型期间,小鼠体质量未出现明显的变化。最后,T细胞亚群及B细胞的流式细胞术检测结果显示,相较于对照组,腹腔注射MWReg30能够使模型组小鼠脾脏CD3+细胞比例升高(P<0.05);CD4+細胞比例、CD8+细胞比例和CD4+/CD8+细胞比值虽有升高趋势,CD19+细胞比例虽呈下降趋势,但差异均无统计学意义(P>0.05)。
此外,本研究基于党参对机体血液功能和免疫系统所表现出的强大调节作用[26],探究党参提取液对小鼠异常血小板计数的影响。经统计和分析MWReg30注射结束后7~28 d内各组小鼠的血小板计数,发现低剂量的党参提取液能够使造模小鼠异常升高的血小板计数更加接近于正常水平,此期间该组小鼠的血小板计数虽有较大幅度的波动,但明显低于模型组小鼠的血小板数量;同样,在MWReg30注射后7~21 d中,党参中剂量组小鼠的血小板计数也持续低于模型组,但在随后的21~28 d该组小鼠的血小板计数却出现了赶超模型组的现象;然而,与以上结果相反的是,在造模后7~28 d党参高剂量组小鼠的血小板计数远高于模型1组。因此,认为适宜剂量的党参提取液干预能够使小鼠异常升高的血小板计数接近或恢复正常水平,而过高剂量的党参提取液灌胃则会导致相反的效果出现。遗憾的是,以MWReg30腹腔注射构建模型小鼠后,造模后7~12 d党参低、中、高剂量组、模型1组和对照1组血小板数量比较的统计学差异并不显著。因此,未来仍需进行更加深入的研究以明确党参提取液对机体异常血小板计数的明确影响。
4 小结
总之,通过对MWReg30不同次数和不同剂量体内注射所获得的数据进行总结和分析,认为体内注射MWReg30的造模方式无法复制出血小板数量能够维持稳定低水平的慢性ITP模型。但是本研究发现,增加MWReg30的注射剂量能够延长小鼠血小板数量低水平的持续时间,且适宜剂量的党参提取液能够对MWReg30注射所导致的小鼠异常升高的血小板计数起到调节作用,从而使其更加接近于正常水平。
参考文献:
[1] TONG A,SCHOLES-ROBERTSON N,HAWLEY C,et al.Patient-centred clinical trial design[J].Nature Reviews Nephrology,2022,18(8):514-523.
[2] GARNER J P.The significance of meaning:why do over 90% of behavioral neuroscience results fail to translate to humans,and what can we do to fix it?[J].ILAR Journal,2014,55(3):438-456.
[3] 陈信义,富琦,范颖,等.免疫性血小板减少性紫癜病证结合模型的建立与评价[C].第七届全国中西医结合血液病学术会议论文集.北京:中国中西医结合血液学专业委员会,2004:144-152.
CHEN X Y,FU Q,FAN Y,et al.Establishment and evaluation of the combined model of immune thrombocytopenic purpura disease[C].Proceedings of the 7th National Conference on Hematological Diseases of Integrated Chinese and Western Medicine.Beijing: Chinese Hematology Committee of Integrated Traditional and Western Medicine,2004:144-152.
[4] 余湘雪,李位智子,余文超,等.原发免疫性血小板减少症动物模型的研究进展及在中医药中的应用[J].中药药理与临床,2023,39(7):106-114.
YU X X,LI W Z Z,YU W C,et al.Progress in animal model of primary immune thrombocytopenia and its application in traditional Chinese medicine[J].Pharmacology and Clinics of Chinese Materia Medica,2023,39(7):106-114.
[5] DENG R,BALTHASAR J P.Comparison of the effects of antibody-coated liposomes,IVIG,and anti-RBC immunotherapy in a murine model of passive chronic immune thrombocytopenia[J].Blood,2007,109(6):2470-2476.
[6] KATSMAN Y,FOO A H,LEONTYEV D,et al.Improved mouse models for the study of treatment modalities for immune-mediated platelet destruction[J].Transfusion,2010,50(6):1285-1294.
[7] NESCHADIM A,BRANCH D R.Mouse models for immune-mediated platelet destruction or immune thrombocytopenia (ITP)[J].Current Protocols in Immunology,2016,113:1-13.
[8] 張书金,李佳晌,贾云芳,等.黄芪、西洋参、党参生血能力差异性比较及机制探讨[J].河北中医药学报,2018,33(4):40-43.
ZHANG S J,LI J S,JIA Y F,et al.Comparison and mechanism of blood generating ability of astragalus,panax quinquefolium and codonopsis pilosula[J].Journal of Hebei Traditional Chinese Medicine and Pharmacology,2018,33(4):40-43.
[9] 徐西,王硕仁,林谦.党参口服液治疗25例冠心病血瘀证患者临床及实验研究[J].中国中西医结合杂志,1995,15(7):398-400.
XU X,WANG S R,LIN Q.Clinical and experimental study on Dangshen oral liquid in the treatment of 25 patients with coronary heart disease and blood stasis syndrome[J].Chinese Journal of Integrated Traditional and Western Medicine,1995,15(7):398-400.
[10] GAO Z Z,ZHANG C,JING L R,et al.The structural characterization and immune modulation activitives comparison of codonopsis pilosula polysaccharide(CPPS) and selenizing CPPS(sCPPS) on mouse in vitro and vivo[J].International Journal of Biological Macromolecules,2020,160:814-822.
[11] 袁力,纪建华,李敏艳.木犀草素调节SIRT3/AMPK/mTOR信号通路对溃疡性结肠炎小鼠Th17/Treg免疫平衡的影响[J].天然产物研究与开发,2023,35(7):1144-1153.
YUAN L,JI J H,LI M Y.Effect of luteolin on Th17/Treg immune balance in mice with ulcerative colitis by regulating SIRT3/AMPK/mTOR signaling pathway[J].Natural Product Research and Development,2023,35(7):1144-1153.
[12] 张珺,朱瑞芳,吕亚茹,等.功能食品在免疫性血小板减少症防治中的作用及功效[J].全科护理,2022,20(33):4672-4676.
ZHANG J,ZHU R F,LYU Y R,et al.Effect of functional food in the prevention and treatment of immune thrombocytopenia[J].Chinese General Practice Nursing,2022,20(33):4672-4676.
[13] LV Y,SHI H P,LIU H,et al.Current therapeutic strategies and perspectives in refractory ITP:what have we learned recently?[J].Frontiers in Immunology,2022,13:953716.
[14] ZHANG P,ZHANG G Y,LIU X Y,et al.Mesenchymal stem cells improve platelet counts in mice with immune thrombocytopenia[J].Journal of Cellular Biochemistry,2019,120(7):11274-11283.
[15] 徐皓,鮑计章,朱文伟,等.健脾滋肾泻火方对免疫性血小板减少症小鼠脾脏树突状细胞、CD86表达和外周血IL-12p70的影响[J].中华中医药学刊,2022,40(3):107-110;268.
XU H,BAO J Z, ZHU W W,et al.Effects of Jianpi Zishen Xiehuo Recipe on splenic dendritic cells,CD86 expression and peripheral blood IL-12p70 in mice with immune thrombocytopenia[J].Chinese Archives of Traditional Chinese Medicine,2022,40(3):107-110;268.
[16] XU P P,JIANG Y,ZUO H Q,et al.Vincristine-loaded platelets coated with anti-CD41 mAbs:a new macrophage targeting proposal for the treatment of immune thrombocytopenia[J].Biomaterials Science,2019,7(11):4568-4577.
[17] 狄正霞,耿岩,孙晓琳,等.GPⅡb/Ⅲa在免疫性血小板减少症中的诊疗意义[J].中国实验血液学杂志,2019,27(4):1241-1245.
DI Z X,GENG Y,SUN X L,et al.Clinical significance of platelet membrane glycoprotein GPⅡb/Ⅲa in diagnosis and treatment of immune thrombocytopenia[J].Journal of Experimental Hematology,2019,27(4):1241-1245.
[18] LI X,WANG S W,FENG Q,et al.Novel murine model of immune thrombocytopaenia through immunized CD41 knockout mice[J].Thrombosis and Haemostasis,2019,119(3):377-383.
[19] KAHNG J,PARK H H,HAN K,et al.Quantitative comparisons of antibody-binding sites of platelet glycoprotein Ⅱb/Ⅲa in aplastic anemia and idiopathic thrombocytopenic purpura[J].Annals of Clinical and Laboratory Science,2008,38(1):6-11.
[20] LYU M E,LI Y,LYU C C,et al.Relative analysis of platelet activation with bleeding risk in patients with primary immune thrombocytopenia[J].National Medical Journal of China,2017,38(1):33-38.
[21] 徐静,鲍计章,周永明.原发免疫性血小板减少症动物模型建立研究进展[J].中华中医药学刊,2019,37(12):2879-2883.
XU J,BAO J Z,ZHOU Y M.Progress of studies on animal models of primary immune thrombocytopenia[J].Chinese Archives of Traditional Chinese Medicine,2019,37(12):2879-2883.
[22] 刘建强,侯圣贵,李晓燕,等.升血小板胶囊对小鼠免疫性血小板减少症的治疗作用及其机制[J].山东医药,2023,63(4):38-41.
LIU J Q,HOU S G,LI X Y,et al.Therapeutic effect and mechanism of Sheng Xuexiaoban Capsules on ITP mice[J].Shandong Medical Journal,2023,63(4):38-41.
[23] ABUQAYYAS L,ZHANG X Y,BALTHASAR J P.Application of knockout mouse models to investigate the influence of FcγR on the pharmacokinetics and anti-platelet effects of MWReg30,a monoclonal anti-GPⅡb antibody[J].International Journal of Pharmaceutics,2013,444(1/2):185-192.
[24] 陈梦依,严媚,焦红杰,等.补体C3对免疫性血小板减少症小鼠血小板计数变化的影响[J].新疆医科大学学报,2022,45(7):710-713.
CHEN M Y,YAN M,JIAO H J,et al.Effects of complement C3 on platelet count in mice with immune thrombocytopenia[J].Journal of Xinjiang Medical University,2022,45(7):710-713.
[25] 刘晓,费飞,秦兰.补肾活血方对慢性免疫性血小板减少症模型小鼠VEC相关血管因子的影响[J].辽宁中医杂志,2023,50(2):191-195.
LIU X,FEI F,QIN L.Effect of Bushen Huoxue Decoction on vascular endothelial cell related vascular factor in CITP mouse model[J].Liaoning Journal of Traditional Chinese Medicine,2023,50(2):191-195.
[26] 楊建宇,刘桂香,刘冠军,等.中华中医药道地药材系列汇讲(19):道地药材纹党参的研究近况[J].现代医学与健康研究电子杂志,2020,4(19):109-111.
YANG J Y,LIU G X,LIU G J,et al.Summary of authentic Chinese medicine series(19):recent research on authentic Chinese medicine codonopsis pilosula[J].Modern Medicine and Health Research Electronic Journal,2020,4(19):109-111.
(收稿日期:2023-09-04;修回日期:2024-03-20)
(本文编辑 曹妍)
