淋巴样增强结合因子1在B细胞慢性淋巴增殖性疾病中的表达
2024-04-15赵敏倪平翟惠莹靳小可杨玉琼
赵敏 倪平 翟惠莹 靳小可 杨玉琼
1芜湖市第二人民医院血液内科(安徽芜湖 241000);2皖南医学院附属第一医院(弋矶山医院)血液内科(安徽芜湖 241000)
B 细胞慢性淋巴增殖性疾病(B cell chronic lymphoproliferative disorders, B-CLPD)是一类以成熟B 淋巴细胞单克隆增多为主要表现的淋巴瘤亚型,血常规类似白血病,病理类型以惰性淋巴瘤为主,临床相对少见。B-CLPD 主要包括CLL、白血病期套细胞淋巴瘤(mantle cell lymphoma, MCL)、白血病期滤泡细胞淋巴瘤(folicular lymphoma, FL)、白血病期边缘区淋巴瘤(marginal zone lymphoma,MZL)、淋巴浆细胞淋巴瘤(lymphoplasmacyticlymphom, LPL)等形态上以小淋巴细胞为主的淋巴瘤亚型。依据流式免疫分型、细胞遗传学和分子生物学可区分大部分疾病[1]。B-CLPD以CLL常见,流式免疫分型结合CLL 积分可诊断典型病例,但仍缺乏特异性和敏感性的指标[2]。淋巴样增强结合因子1(lymphoid enhancer-binding factor 1, LEF1)是Wnt/β-catenin 通路的转录因子,在调节细胞增殖和生存中发挥重要作用[3],作为TCF/LEF 家族的成员,LEF1 在前B 淋巴细胞和T 淋巴细胞上表达,在早期淋巴细胞发育中起关键作用[4]。LEF1 在血液肿瘤患者中的表达研究,国内报道以急性淋巴细胞白血病为主,对B-CLPD 这类惰性淋巴瘤的研究尚未见系统报道。本研究采用免疫组织化学染色方法,研究B-CLPD 患者中LEF1 蛋白表达情况,探索其在B-CLPD 各亚型,尤其是在CLL 的诊断和鉴别诊断中的作用。
1 资料与方法
1.1 一般资料收集2018 年9 月至2023 年6 月因血细胞异常或淋巴结肿大就诊我院的B-CLPD 患者58 例,其中CLL 20 例,MCL 12 例,FL 5 例,MZL 11 例,LPL 8 例,毛细胞白血病(hairy cell leukemia,HCL)2 例;对照组选取非恶性血液系统疾病患者的骨髓活检标本20 例。B-CLPD 患者诊断以及亚型的诊断参照中华医学会血液学分会、中国抗癌协会血液肿瘤专业委员会修订的专家共识[1];所有淋巴结病理诊断参照2017 年第4 版WHO 淋巴造血系统组织肿瘤分类标准[5]。本研究经芜湖市第二人民医院伦理委员会批准(批号:2022-JS-022),并获得所有患者知情同意。58例中男44例,女14 例,年龄36~85 岁,中位年龄65(58,73)岁,B-CLPD 各亚型以及临床基本资料见表1。对照组20 例中男10 例,女10 例,年龄35~70 岁,中位年龄为61(45,69)岁。
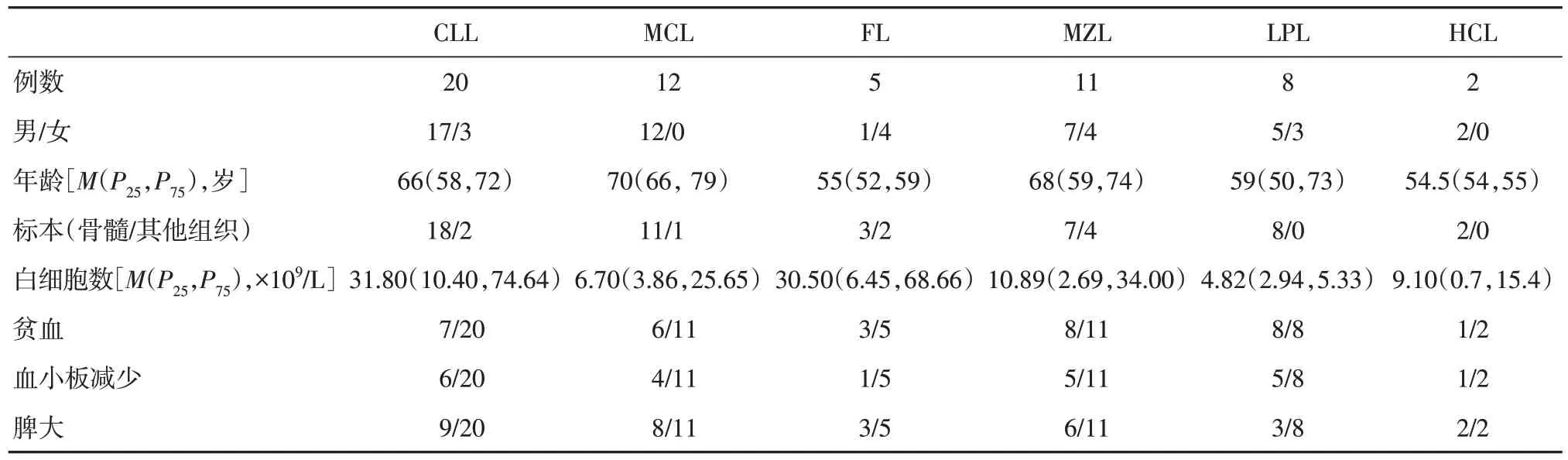
表1 58 例B-CLPD 患者临床资料Tab.1 Clinical characteristic of 58 B-CLPD patients例
1.2 免疫组织化学检测方法及结果判读标准骨髓活检标本经3.7%中性甲醛固定后,经3.7%硝酸甲醛溶液脱钙、流水冲洗4 h,常规石蜡包埋,3 μm厚连续切片,常规HE 染色以及检测CD3、CD5、CD10、CD20、CD38、CD138、CD34、CCND1、TdT、PAX-5 等抗原,按说明书检测LEF1 抗原表达。以上抗体均购自福州迈新生物技术开发有限公司。采用EnVision 法,二氨基联苯胺显色。20 例对照组骨髓活检标本,除做LEF1 染色外,同时标记CD3和PAX-5抗原,以区别正常T淋巴细胞中LEF1的表达。淋巴结或组织活检标本经10%甲醛固定,常规石蜡包埋,切4 μm 切片,HE 染色和免疫组化染色。采用扁桃体组织作为LEF1 阳性对照,反应性增生滤泡内和滤泡间区T 淋巴细胞LEF1染色阳性。空白对照以PBS 代替一抗。LEF1 染色以≥ 10%肿瘤细胞核内出现棕黄色或棕褐色颗粒判为阳性。
1.3 常规染色体核型分析检测方法及结果判读标准取骨髓标本2 mL,在RPMI 1640 培养液中短期培养24 h,收获前30 min 加秋水仙胺,收获细胞。低渗35 min,用固定液(甲醇∶冰乙酸为3∶1)固定3 次;细胞悬液制片,制备染色体标本并采用G 显带吉姆萨染色后进行核型分析,核型描述根据《人类细胞遗传学国际命名体制(ISCN2013)》。
1.4 原位荧光杂交(In Situ fluorescence hybridization, FISH)检测方法及结果判读标准4 种DNA 特异性探针:RB1、ATM、P53、CSP12,分别定位于13q14、11q22.3、17p13.1、12p11.1-12q11.1,以上探针购于北京金蓓嘉生物技术公司。取新鲜骨髓或外周血标本2 mL,参照说明书,标本提取单个核细胞,低渗、固定后,再滴片、脱水、气干等步骤完成制片。室温下滴加配制好的探针,封片;将玻片置于原位杂交仪中,72 ℃变性5 min,42 ℃杂交16 h,然后洗脱、染色。荧光显微镜下(日本Olympus 公司)通过DAPI/PI/FITE 三色滤光镜观察杂交信号。每份标本计数至少200 个细胞,并记录杂交信号的阳性率。正常间期细胞中RB1 为2 个绿色(2G),ATM 为2 个红色(2R),P53 为2 个绿色(2G),CSP12为2 个红色(2R),在异常间期细胞中RB1 为1G(13q-阈值:4.1%),ATM 为1R(11q-阈值:3.3%),P53 为1G(17p-阈值:4.5%),CSP12 为3R(+12 阈值:3.8%),以异常细胞大于上述阈值为阳性标准。
1.5 统计学方法应用SPSS 22.0 统计分析软件,本研究中计量资料均为非正态分布,采用中位数(四分位数)表示,计数资料以%表示,采用χ2检验和似然比χ2检验;以P< 0.05 为差异有统计学意义。
2 结果
2.1 LEF1的表达情况58例B-CLPD患者和20例对照组中LEF1 的表达差异有统计学意义(P<0.05)。见图1、表2。
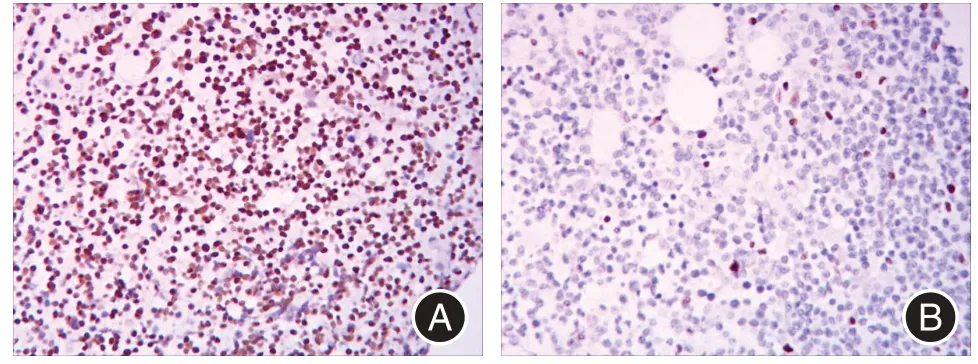
注:A,1 例CLL 患者LEF1 表达,细胞弥漫阳性;B,1 例LPL 患者,LEF1 表达阴性图1 骨髓活检标本LEF1 的表达情况(SP, × 400)Fig.1 The expression of LEF1 protein in 2 patients with bone marrow samples by immunohistochemistry (SP, × 400)
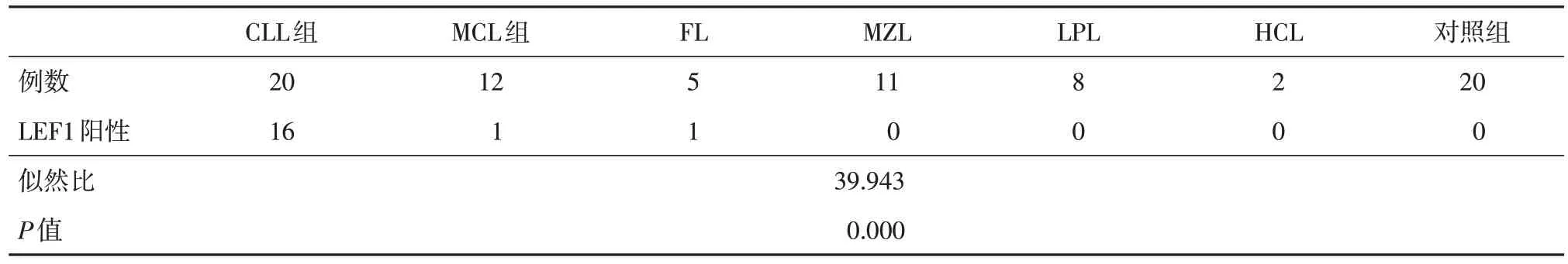
表2 B-CLPD 各组和对照组中LEF1 蛋白表达情况Tab.2 The expression of LEF1 in B-CLPD sub-groups and control group例
2.2 CD5+的B-CLPD 患者的LEF1 和其他蛋白表达的相关性32 例CD5+的B-CLPD(CLL20 例,MCL12 例)。LEF1 阳性组中,CD23 阳性、CD200 阳性、FMC-7 阴性、CCND1 阴性、SOX11 阴性的比例明显高于LEF1 阴性组(P< 0.001),见表3。而LEF1 的表达和CD22、CD79b 的表达无相关性(P>0.05)。采用两种CLL 积分方法计算32 例患者的积分,LEF1 阳性的患者中,积分典型例数明显高于阴性组(P< 0.001),见表4。
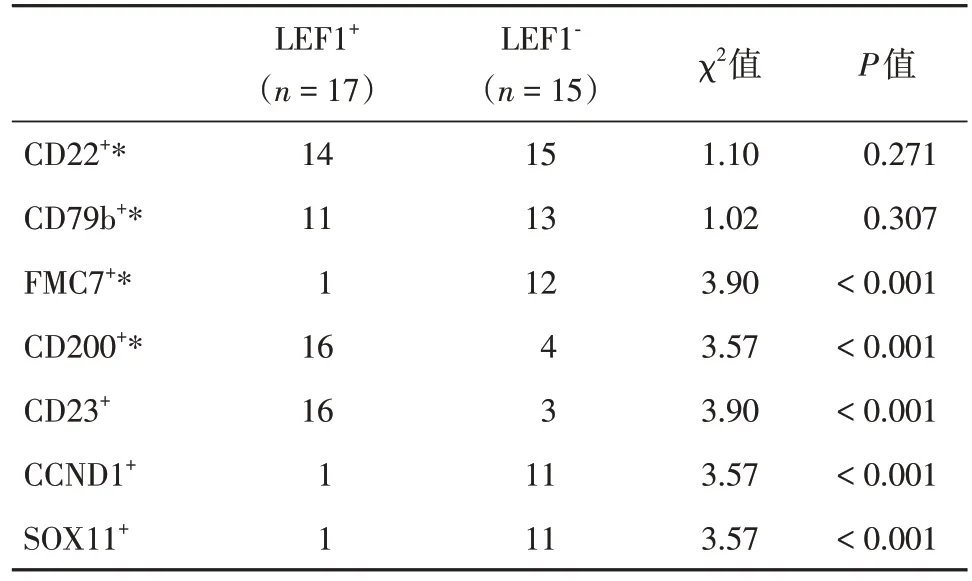
表3 CD5 阳性患者中LEF1 表达和其他抗原表达的相关性Tab.3 The correlation between LEF1 expression and other antigen expression in CD5 positive patients例

表4 CD5 阳性患者中LEF1 表达和CLL 积分的相关性Tab.4 The correlation between LEF1 expression and CLL score in CD5 positive patients例
2.3 LEF1 的表达和CLL 患者细胞遗传学特点的相关性20 例CLL 患者,常规进行染色体分析和FISH 检测,其中:13q-阳性7 例;+12 阳性4 例(其中1 例为复杂染色体异常);11q-4 例;17p-(TP53)阳性0 例。在11q-和13q-阳性患者中,LEF1 均阳性;4 例LEF1 阴性的患者,2 例+12 异常,16 例LEF1 阳性患者中,2 例+12 异常,+12 异常检出率在LEF1阴性组中高于LEF1 阳性组,但差异无统计学意义(P> 0.05)。
3 讨论
B-CLPD 是一类淋巴瘤亚型的统称,此类淋巴瘤容易累及骨髓及外周血,表现为一系或多系血细胞异常,伴或不伴淋巴结、肝脾肿大;CLL、MCL、FL、MZL 等均在此病的范畴。因为B-CLPD 的特殊临床表现,各亚型的鉴别主要依靠骨髓标本的流式免疫分型和组化染色;但是各亚型流式表型变异多,部分亚型之间抗原表达有重叠[6],表型不典型的病例,仍是诊断难点。因此,筛选更多的特异性指标,作为鉴别诊断依据是必要的。
LEF1 基因序列上含有高度保守的高迁移率基团DNA 结合域,并在Wnt/β-catenin 信号传导中的发挥核转录因子作用[7]。LEF1 在乳腺癌、大肠癌等多种恶性肿瘤中异常表达[8];在血液系统恶性肿瘤的动物模型中,LEF1 的过度表达可诱导生成急性髓系白血病[9],LEF1 外显子2 和外显子3 发生点突变(K86E、P106L)后,激活c-myc 和cyclin D1 的表达,导致白血病细胞持续增殖[10]。LEF1 在T 细胞和B 细胞分化和增殖中是必需的,因此正常的前B 和T 淋巴细胞表面均有LEF1 的表达,在正常成熟的B 淋巴细胞表面,LEF1 不表达;在各种B 淋巴增殖性疾病患者中,LEF1 主要在急性淋巴细胞白血病(acute lymphocyte leukemia, ALL)[11]和CLL[12]、大细胞转化型淋巴瘤、一部分霍奇金淋巴瘤中表达[13],而在DLBCL、MCL 等类型中为阴性[14]。
MENTER 等[15]报道298 例小B 细胞淋巴瘤,CLL 患者LEF1 的阳性率为92%;而其他类型的小B 细胞淋巴瘤,LEF1 阴性。RANGAN 等[16]也报道129 例 CLL 患者,LEF1 阳性率为 98%,33 例MCL中仅2 例阳性;142 例MZL 和50 例LPL 均阴性。本研究检测58 例B-CLPD 患者LEF1 表达情况,在20 例CLL患者中,阳性率为80%,而在其他B-CLPD亚型中,LEF1 个别阳性,和文献报道一致。CD200是近年来发现诊断CLL 的一个新标志,在CD5 阳性的B-CLPD 的患者中,CLL 患者CD200 阳性,而MCL 患者阴性;在其他CD5 阴性B-CLPD 患者中,CD200也普遍为阴性或低水平表达[17]。本研究17 例LEF1 阳性的患者中,16 例患者CD200 阳性,LEF1表达和CD200 的表达有明显相关性;而LEF1 和CCND1、SOX11 等MCL 的指标呈负相关。采用2种CLL 积分方法[2,18]对CD5 阳性的患者进行评分,LEF1 的阳性率在CLL 积分典型的患者也明显升高。LEF1 作为一个诊断CLL 的标志,具有较高的敏感性和特异性。
LEF1 在不同病种之间表达强弱存在差异。陈雪等[12]报道LEF1 在ALL 中普遍为中等至强阳性表达,中位值为90%,而在CLL 中表达的中位值为45%。REA等[19]发现在霍奇金淋巴瘤各亚型中,LEF1 在经典型霍奇金淋巴瘤表达多为强阳性,且阳性细胞较多;而在结节淋巴细胞为主型中,仅表现为阳性,阳性细胞数多< 50%。SOLIMAN 等[20]采用流式细胞术分析CLL 患者的LEF1 的荧光强度,CLL 积分不典型的患者,LEF1 的荧光强度低于积分典型者(211vs.786)。CLL 积分低于4 分的CD5+B-CLPD 患者,排除MCL 后,其淋巴瘤亚型诊断是临床的难点,而LEF1 是一个很好的辅助诊断指标。本研究中,4 例骨髓标本LEF1 阴性的CLL患者中,2 例为淋巴结病理诊断,其中1 例CLL 流式积分为3 分。LEF1 作为一个诊断CLL 的特异性指标,在CLL 的诊断中有较高的特异性,而病理诊断虽然为“金标准”但存在主观判断的因素,因此,对于淋巴结病理和相关组化矛盾的病例,还需进一步验证二者的相关性。在非CLL 的B-CLPD 患者,LEF1 阳性也有个别报道[21]。
LEF1 作为CLL 的诊断指标之一,其在预后方面的意义尚不确定。+12 是CLL 预后中等的一个细胞遗传学指标,发生率约占CLL 患者的1/3[22]。文献报道,LEF1 阴性的CLL 患者,+12 号染色体异常比例高于阳性组[20]。本研究中,4 例LEF1 阴性的患者,2 例+12 异常,发生率高于LEF1 阳性组以及其他染色体异常组,和文献报道相符。但病例数少,后续还需扩大样本量进一步验证。同时,LEF1 阴性的这部分CLL 患者在细胞遗传学、分子生物学以及对药物治疗反应上存在何种特点目前尚无大样本的研究,值得进一步探索。
综上所述,LEF1 在慢性淋巴细胞白血病患者的诊断和鉴别诊断中,有较好的灵敏性和特异性,是B-CLPD 鉴别诊断的良好补充。
【Author contributions】ZHAO Min performed the experiments and wrote the article.ZHAI Huiying and JIN Xiaoke performed the experiments.NI Ping revised the article.YANG Yuqiong designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
