根治性放化疗前18F-FDG PET/CT代谢异质性参数结合临床特征对食管鳞状细胞癌预后的预测价值
2024-04-15马希雅季虎朱泽华潘博谢强姚晓波
马希雅 季虎 朱泽华 潘博 谢强, 姚晓波,
1蚌埠医学院研究生院(安徽蚌埠 233000);2中国科学技术大学附属第一医院(安徽省立医院)核医学科(合肥 230001)
食管癌是全球范围内第8 大常见肿瘤,尤以东亚的发病率最高[1]。食管鳞状细胞癌(ESCC)是食管癌主要的组织病理学类型之一[2]。ESCC的治疗包括手术、放疗、化疗、分子靶向治疗和免疫治疗等[3]。然而,目前ESCC 的治疗并未获得令人满意的疗效,预后较差。早期精准预测ESCC 患者的预后有助于制定更合理的诊疗方案,从而改善患者生存,具有重要的临床价值。有研究报道,部分治疗前18F-FDG PET/CT 肿瘤代谢参数,如肿瘤代谢体积(MTV)、病灶糖酵解总量(TLG)等对ESCC 患者的预后具有一定的预测价值[4]。近年来,18F-FDG PET/CT 肿瘤代谢异质性参数已被证明可以在多种实体肿瘤的预后预测中发挥作用[5-8],但在预测ESCC 患者根治性放化疗(D-CRT)的预后方面少见报道。本研究旨在探讨D-CRT前18F-FDG PET/CT 肿瘤代谢和异质性参数结合临床特征对ESCC 患者预后的预测价值,为临床治疗决策的制定提供依据。
1 资料与方法
1.1 研究对象本研究回顾性分析了2017 年1 月至2021 年12 月间在中国科学技术大学附属第一医院接受D-CRT 的106 例ESCC 患者的临床资料,所有患者均已在D-CRT 前2~4 周行18F-FDG PET/CT 检查。纳入标准如下:(1)病理证实为ESCC,且病历资料完整;(2)18F-FDG PET/CT 检查前未接受抗肿瘤治疗;(3)除D-CRT 外未行其他治疗。排除标准:(1)患者失访或缺乏临床资料;(2)合并其他原发肿瘤病灶。所有入组患者的临床分期采用2009 年第五届全国食管癌放疗研讨会通过的“非手术治疗食管癌临床分期”修改方案[9]。
对患者进行门诊或电话随访,终点日期为病人的死亡日期或者研究随访终止日,随访的截止日期为2023 年7 月31 日。以总生存期(OS)为研究终点,OS 定义为疾病诊断之日起至患者死亡或随访截止的时间。本研究符合《赫尔辛基宣言》的原则,并已经过中国科学技术大学附属第一医院伦理委员会批准。共入组106 例患者,男86 例,女20 例,年龄(70±9)岁,其中> 70 岁50 例(51.9%),≤ 70 岁56 例(48.1%);随访至截止日期,共35 例(33.0%)患者死亡,1、1.5 年生存率分别为77.4%、51.9%,中位OS 为20 个月。
本研究符合《赫尔辛基宣言》的原则,并已经过中国科学技术大学附属第一医院伦理委员会批准(编号:2023-RE-309)。
1.2 18F-FDG PET/CT采集及处理所有患者于检查前禁食6~8 h,按3.7~7.4 MBq/kg(0.1~0.2 mCi/kg)经静脉注射18F-FDG,平卧休息60 min 用PET/CT(SIEMENS Biography 16 HR)行全身显像。CT扫描参数为管电压120 kV,管电流100 mAs,螺距0.75,层厚及间距5 mm,矩阵512 × 512,以2 min/床位进行PET 3D 模式扫描,使用True X 算法重建PET 图像。重建PET 图像并与CT 融合后,由2 名经验丰富的医师对图像进行处理分析,当判断结果不一致时,通过讨论达成一致;定量参数取2 名医师测定的平均值。
采用西门子Syngo.via 软件对原发灶感兴趣区(ROI)进行半自动勾画,在ROI 内测量最大标准化摄取值(SUVmax)、平均标准化摄取值(SUVmean)、MTV、TLG 等代谢参数。MTV 是ROI 内以40%SUVmax为阈值的全部体素的体积,TLG 是MTV 与SUVmean的乘积。随后计算变异系数(CV)和异质性指数(HI),包括CV2.5、CV40%、HI-1、HI-2 这4 个肿瘤代谢异质性参数[7]。CV 为SUV 的标准差(SD)与SUV mean 之比;CV2.5 是以SUV2.5 为阈值的CV,CV40%是以40%SUVmax为阈值的CV。HI-1、HI-2 分别是指MTV 在不同SUVmax阈值(2.5、3.0、3.5 及25%、50%、75%)下线性回归斜率的绝对值。
1.3 治疗方法入组患者的治疗方式均为D-CRT,放疗方法为调强放射治疗,对于局部晚期患者一般行同步化疗,而有化疗禁忌或者TNM 分期较早者一般不行同步化疗。治疗前利用CT 模拟机定位,结合CT、钡餐及内镜检查结果勾画出肿瘤靶区、临床靶区并制定计划靶区,每周5 次,治疗5~6 周,共计25~30 次,照射总剂量为50~60 G y。
1.4 统计学方法使用SPSS 27.0软件进行统计学分析,所有计数资料采用例数例(%)进行统计描述,正态分布的计量资料以(±s)表示;肿瘤代谢和异质性参数均采用受试者工作特征(ROC)曲线计算曲线下面积(AUC),并用约登指数法判定最佳界值,以该值进行分组;采用Kaplan-Meier 法进行生存分析,各研究因素组间比较采用Log-rank 检验,Ρ< 0.05 的因素纳入Cox 比例风险模型进行多因素分析。以Ρ< 0.05为差异有统计学意义。
2 结果
2.1 预后的单因素分析所有的原发灶均有不同程度的18F-FDG 摄取,SUVmax、SUVmean、HI-1、HI-2、CV2.5、CV40%、MTV、TLG 的最佳界值分别为13.98、3.42、7.84、4.12、0.49、0.23、5.69 cm3和57.90 g(表1)。单因素分析结果显示:N 分期、M 分期、MTV、TLG、HI-2、CV40%与ESCC D-CRT患者预后相关(P= 0.035、0.013、0.005、0.004、0.037、< 0.001),见表2,相关生存分析见图1。

注:A-G分别为以HI-2、SUVmax、TLG、MTV、M分期、CV40%、N分期进行分组的Kaplan-Meier生存曲线;H为Ⅰ、Ⅱ、Ⅲ组患者Kaplan-Meier生存曲线图1 ESCC 患者Kaplan-Meier生存曲线Fig.1 Kaplan-Meier survival curves in patients with ESCC

表1 ESCC 原发灶代谢及异质性参数ROC 曲线分析Tab.1 ROC curve analysis of metabolic and heterogeneity parameters for primary lesions in ESCC
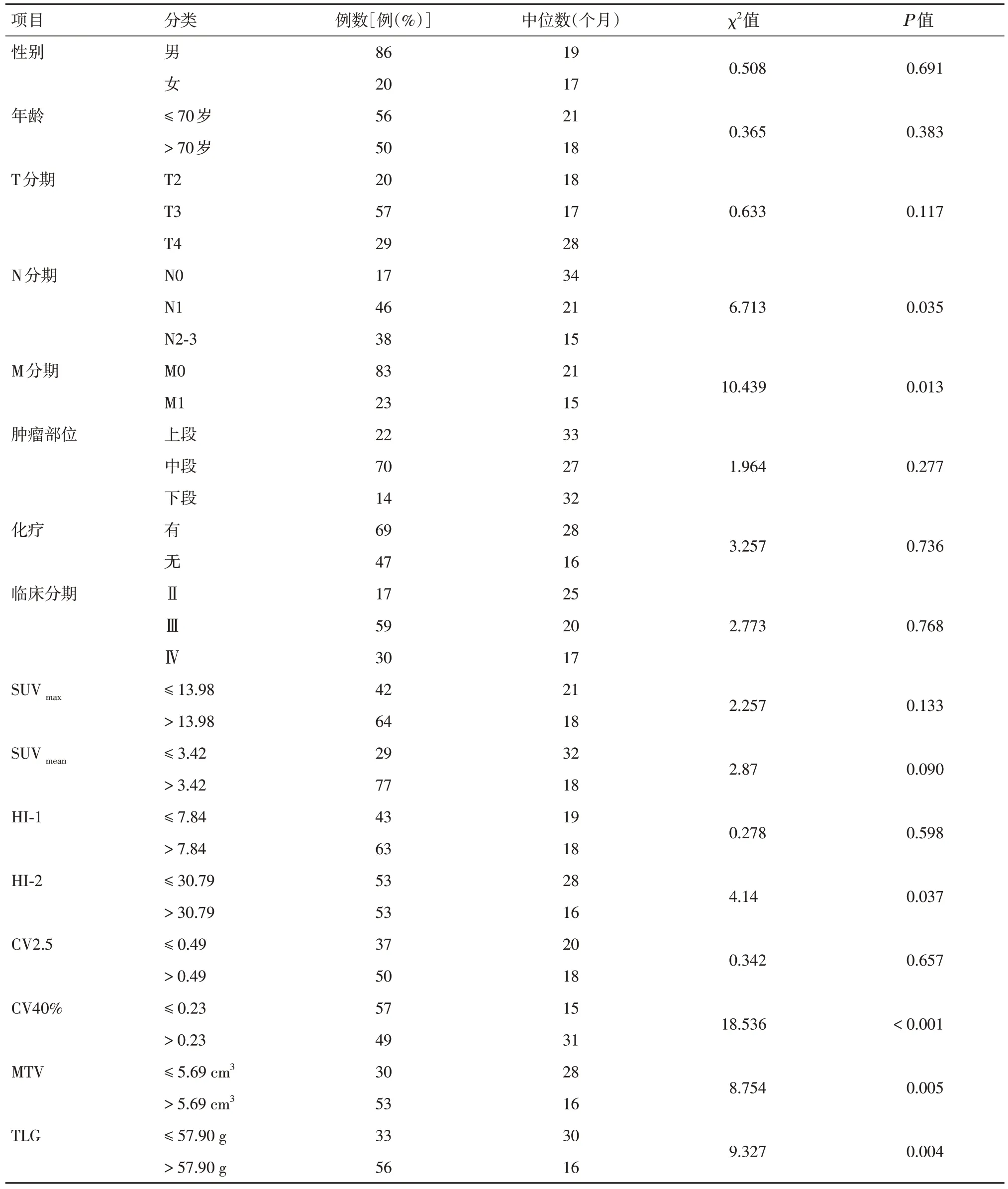
表2 106 例ESCC 患者的临床特征和预后的单因素分析Tab.2 Univariate Analysis of Clinical Characteristics and Prognosis in 106 Patients with ESCC
2.2 预后的多因素分析多因素Cox 回归分析显示,N 分期、CV40%是ESCC D-CRT 患者预后的独立危险因素(P= 0.039、< 0.001),见表3。联合CV40%和N 分期将患者分为3 组并进行Kaplan-Meier 生存分析,CV40% > 0.23 且N0-1的患者为Ⅰ组(n= 28),CV40% > 0.23且N2-3或CV40% ≤0.23 且N0-1的患者为Ⅱ组(n= 55),CV40% ≤ 0.23 且N2-3的患者为Ⅲ组(n= 23),三组患者OS 的差异有统计学意义(Ρ<0.001)。Ⅰ组患者的中位OS(39 个月)明显高于Ⅱ、Ⅲ组(分别为19、11 个月),见图1H。
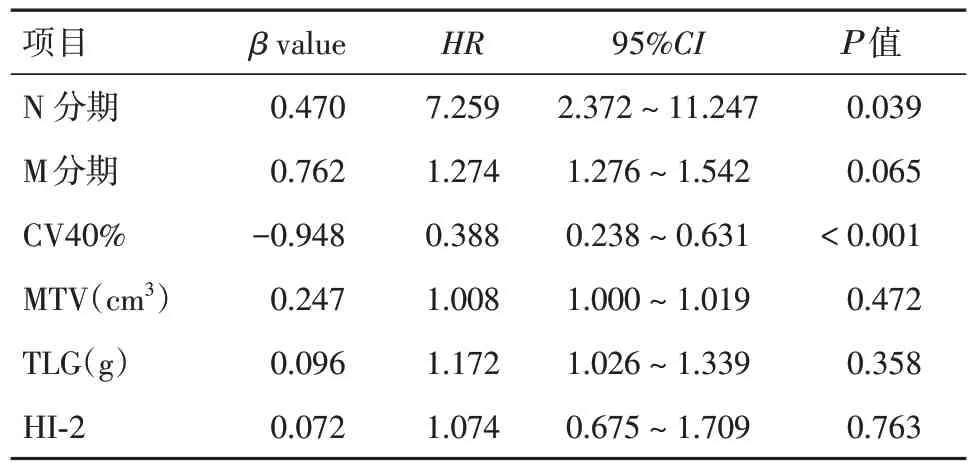
表3 106 例ESCC 患者预后的Cox 多因素分析Tab.3 Cox Multifactor Analysis of Prognosis in 106 Patients with ESCC
3 讨论
TNM 分期是评估食管癌患者预后的重要依据,N 分期已被证明是其主要预后因素[1],本研究亦表明N 分期对ESCC D-CRT 患者的预后具有独立预测价值,其β值为0.682,HR= 7.259,95%CI:2.372~11.247,P= 0.039。N0组的中位OS(34 个月)高于N1、N2-3组的中位OS(分别为21、15 个月),差异有统计学意义(χ2= 6.713,Ρ= 0.035),这表明随着N 分期的提高,患者死亡风险显著增加。与METZGER 等[10]研究结果一致。然而,仅根据TNM分期仍难以准确评估患者预后,寻找更多的早期预测预后的指标对临床治疗方案的制订具有重要的参考价值。
18F-FDG PET/CT 肿瘤代谢参数与肿瘤代谢活跃程度密切相关,可以较为直观地反映肿瘤的增殖和侵袭能力。有研究报道MTV 是食管癌术后患者预后的独立预测因素[11],TLG 为早期ESCC 患者预后的独立预测因子[1],本研究发现MTV 和TLG 仅与接受D-CRT 的ESCC 患者预后相关,但并非独立预测因素,其相应的HR值分别为1.008、1.172,P值分别为0.472、0.358。与上述研究不一致,其原因可能为本研究的入组患者的临床病理特征、治疗方式与上述研究差异较大。此外,部分研究显示SUVmax与患者远期生存呈负相关,是食管癌术后患者的预后指标[12];但不是食管癌放疗或同步放化疗患者预后的独立预测因素[13-14],不能作为食管癌放化疗患者预后的预测指标。本研究亦未发现SUVmax与ESCC D-CRT 患者的预后相关,与上述的研究结果基本一致。因此,SUVmax、MTV 和TLG 对ESCC 患者预后及生存的预测价值还有待进一步深入研究,亟需更多临床可及的代谢相关参数评估患者预后。
肿瘤异质性包括时间、空间、结构、基因、蛋白质及功能等多方面的异质性[15-16],是恶性肿瘤本质的特征之一,与疾病进展、治疗效果、预后不良有关[17]。18F-FDG PET/CT 肿瘤代谢异质性参数CV、HI 分别显示了不同肿瘤区域SUV 的变化和MTV 的变化,均反映了部分肿瘤的基因突变和预后相关的异质性特征[17-19]。近年来,研究发现肿瘤代谢异质性参数是接受手术或化疗的食管癌患者预后的预测因素,DONG 等[20]基于MATLAB平台提取原发病灶体素三维灰度信息构建灰度共现矩阵(GLCM)并计算统计量,发现此参数是影响ESCC 术后患者复发和OS 的唯一预测因素,GLOPAL 等[21]基于梯度面积的方法计算不同体积下SUV 直方图的AUC,以AUC 差异表征肿瘤代谢异质性,其研究结果表明对于接受手术和化疗的ESCC 患者,这些参数具有潜在价值的临床预后价值。本研究表明肿瘤代谢异质性参数也适用于预测ESCC D-CRT 患者的预后,在CV2.5、CV40%、HI-1、HI-2四个代谢异质性参数中,HI-2、CV40%与ESCC放疗患者的预后相关,CV40%是ESCC D-CRT患者预后的独立预测因子,CV40% > 0.23 组的中位OS(31 个月)高于CV40% ≤ 0.23 组(15 个月),差异有统计学意义(χ2= 18.536,Ρ< 0.001)。其原因可能为:肿瘤具有结构异质性且肿瘤细胞亚群的分布具有空间异质性,CV 是通过直方图分析获得的反映肿瘤内葡萄糖代谢的空间异质性指标,CV40%较低患者的ESCC 全部体素内以葡萄糖代谢水平较均一的恶性肿瘤细胞为主,而当ESCC 微环境内混有较多的葡萄糖代谢水平较低的基质细胞、免疫细胞或恶性度较低的肿瘤细胞亚群等异质性成分时,则CV40%较高,因此能获得较好的治疗预后。此前有研究[5]发现含有部分黏液腺癌的结直肠腺癌CV40%明显低于恶性度较低的结直肠腺癌,亦说明了较低的CV40%可能与肿瘤的不良预后关系密切。当CV40%和N 分期结合时,本研究发现患者生存分析可以进一步分类,CV40% > 0.23 且N0-1的患者的中位OS 明显高于CV40% > 0.23 且N2-3或CV40% ≤ 0.23 且N0-1或CV40% ≤ 0.23 且N2-3的患者。这一结果表明合并独立预后危险因素对进一步预测ESCC D-CRT 患者的预后更具价值。
本研究的局限性主要在于这项研究为单中心回顾性研究,病例数相对较少,最终入组患者存在部分偏倚,且最终入组患者的病情和治疗方案存在差异,放疗剂量不完全一致,部分患者接受联合化疗,化疗的方案因患者耐受性不同而不完全一致,这些因素未完全纳入并进行进一步亚组分析。
综上所述,N 分期和基于放疗前18F-FDG PET/CT 的肿瘤代谢异质性参数CV40%可预测ESCC 患者预后,与患者生存关系密切,是食管癌预后评估的关键因素,在患者管理和制定诊疗方案过程中有重要的临床价值。但CV 值受SUVmax阈值影响,不同类型的肿瘤可能有不同的最佳阈值。因此,CV40%对ESCC 预后的预测价值需要进一步多中心、大样本的临床研究去证实。
【Author contributions】MA Xiya performed the experiments and wrote the article.JI Hu performed the experiments.ZHU Zehua and YAO Xiaobo revised the article.YAO Xiaobo designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
