党参多糖通过调控MAPK/NF-κB信号通路对脂多糖诱导的急性肺损伤小鼠肺组织的保护作用
2024-04-15肖凌高春蕾郭伟王宁张萱刘明
肖凌 高春蕾 郭伟 王宁 张萱 刘明
1衡水市人民医院呼吸与危重症科(河北衡水 053000);河北省中医院 2呼吸与危重症科, 3呼吸二科(石家庄 050011)
急性肺损伤(acute lung injury, ALI)是一种由肺内外各致病因素导致的急性肺组织细胞损伤,以肺部浸润、低氧血症和水肿为主要临床表现,在世界范围内具有较高的发病率和病死率[1]。ALI若不及时干预,会进一步发展成为急性呼吸窘迫综合征(acute respiratory distress, ARDS),引起心、肾等多组织器官功能障碍[2],这也是造成重症监护中患者死亡的重要因素。目前临床上还没有确切的ALI 治疗方案。治疗控制原发病,遏制其诱导的全身失控性炎症反应,是预防和治疗ALI 的必要措施[3]。
丝裂原活化蛋白激酶(MAPK)/核因子κB(NF-κB)是参与调节炎症相关疾病发病机制的关键信号通路[4-5]。有研究[6]发现,急性肺损伤后,MAPKs、ERK、JNK 和p38 均参与了肺中信号转导和转录激活因子3(STAT3)的激活。也有研究[7]表明,NF-κB 的激活可以促进促炎症细胞因子的产生,而这些细胞因子又可以反过来激活NF-κB,从而放大炎症信号。而MAPK 是启动NF-κB 激活的经典途径[8]。此外,MAPK-NF-kB 的激活可促进TNF-α、IL-1β 和IL-6 的生成。研究[9]表明,抑制MAPK/NF-κB 通路的激活可改善肺部损伤,降低脂多糖(LPS)诱导的ALI 小鼠的死亡率。党参是桔梗科植物党参、川党参和素花党参的干燥根,是我国传统的补益药物。现代药理学研究表明,党参具有抗氧化和改善机体免疫的作用,而党参多糖和党参皂苷是其主要有效成分,在机体的免疫调节、抗氧化、抗炎、抗癌/抗肿瘤和调节肠道菌群方面起着重要作用[10-14]。但在LPS 诱导的ALI 中,党参多糖是否可以通过MAPK/NF-κB 信号通路减轻炎症反应,发挥肺功能和肺组织保护作用尚未见相关报道。本研究采用通过LPS 诱导建立ALI小鼠模型,并探讨党参多糖对ALI 小鼠炎症反应和肺组织的保护作用及其机制,旨在为党参多糖的药理作用研究提供数据基础。
1 材料与方法
1.1 材料
1.1.1 实验动物清洁级雄性昆明小鼠,6~8 周龄,体质量18~22 g。购自河北医科大学实验动物中心,使用许可证号:SCXK(冀)2020-002,伦理委员会批准(编号:IACUC-Hebmu-P-2022019)。实验动物饲养于恒温恒湿,明暗各12 h 的清洁动物房内,饲养条件及饲养流程均符合《实验动物管理条例》。
1.1.2 试剂和设备大肠杆菌脂多糖(批号L2880)购自美国Sigma 公司;党参多糖(纯度90%,批号A7863A)购自上海士锋生物科技有限公司;苏木素-伊红(HE)染液(批号G1120)和瑞氏-吉姆萨(Giemsa)染液(批号G1020)购自北京索莱宝科技有限公司;地塞米松片(国药准字H44024469)购自广东华南药业集团有限公司;总蛋白提取试剂盒(批号78510)购自美国Thermofisher 公司;酶联免疫吸附(ELISA)检测试剂盒IL-1β(批号ab222503)、IL-6(批号ab222503)、MPO(批号ab155458)、TNF-α(批号ab208348)均购自美国Abcam 公司,p-p38 MAPK(批号4511)、p-IκB-α(批号2859)、p-p65(批号3033)兔抗鼠一抗均购自美国Cell Signaling Technology 公司;辣根过氧化物酶(HRP)标记的山羊抗兔二抗(批号ab205718)购自美国Abcam 公司;酶标仪和垂直电泳仪均购自美国Bio-rad 公司;光学显微镜、石蜡切片机和烤片机购自德国Leica 公司;多参数肺功能检测系统购自上海玉研科学仪器有限公司;烘箱购自于苏州德力电热设备有限公司。
1.2 方法
1.2.1 动物分组及模型制备50 只小鼠随机分为对照组、模型组、地塞米松组、党参多糖高剂量组和党参多糖低剂量组,每组10 只。除对照组以外,其余各组小鼠均通过腹腔注射LPS(10 mg/kg)的方式构建小鼠ALI 模型[15]。党参多糖高剂量组和低剂量组分别给予300 mg/kg 和150 mg/kg 党参多糖灌胃,地塞米松组给予5 mg/kg 地塞米松,对照组和模型组均每天给予生理盐水灌胃。建模12 h 后,取2 只模型组小鼠,光镜下观察其肺组织病理形态学变化,发现模型组小鼠肺组织下叶明显肺泡水肿、出血及大量炎性细胞浸润,肺泡壁增厚,表示造模成功。
1.2.2 小鼠肺功能检测将各组小鼠腹腔注射1%戊巴比妥(50 mg/kg)深度麻醉,固定于小动物手术台上,取仰卧位分离暴露气管后在颈部正中将气管切开,插入气管插管后缝合固定。多参数肺功能检测系统测定小鼠0.3 s 用力呼气量(forced expiratory volume in 0.3 second,FEV0.3),用力肺活量(forced vital capacity,FVC)以及FEV0.3/FVC。
1.2.3 小鼠肺组织干湿重比(W/D)及肺组织病理学观察小鼠腹腔注射1%戊巴比妥后,颈椎脱臼法处死,剪开小鼠颈部及胸腔,完整分离气管及肺组织。切除气管后,取右肺中叶,称湿重后放置于培养皿中,60 ℃烘箱内烘干24 h 后称干肺重,计算肺组织W/D;取右肺下叶10%福尔马林固定,石蜡包埋,5 μm 连续切片后,显微镜下进行组织病理学观察。
1.2.4 小鼠肺泡灌洗液中炎性细胞分类和计数将小鼠处死后,打开胸腔,结扎右肺支气管,将预冷生理盐水缓慢注入小鼠左侧肺泡内灌洗3 次,收集肺泡灌洗液(bronchoalveolar lavage fluid, BALF)。1 500 r/min 4 ℃离心5 min,弃上清后1 mL 生理盐水重悬细胞,取20 μL 细胞悬液进行细胞涂片,涂片晾干后行Giemsa 染液染色,待玻片晾干后,光学显微镜下进行白细胞分类和计数。
1.2.5 小鼠BALF 和血浆中IL-1β、IL-6、MPO、TNF-α 水平检测将小鼠BALF 在4 ℃下3 000g离心10 min,取上清,于-80 ℃保存备用。并采用眼眶取血,2 500 r/min 离心15 min,分离血浆。BALF和血浆均使用ELISA 试剂盒,按照说明书方法,检测IL-1β、IL-6、MPO、TNF-α 水平。
1.2.6 小鼠肺组织p-p38 MAPK、p-IκB-α、p-p65的蛋白表达水平检测取小鼠右肺下叶组织,研磨匀浆后,使用蛋白抽提试剂盒提取总蛋白,BCA法检测组织蛋白浓度。10% SDS-PAGE 凝胶电泳后,将分离蛋白转至PVDF 膜上,5%脱脂牛奶封闭1 h 后,磷酸缓冲液(TBST)洗膜。加入抗p-p38 MAPK、p-IκB-α、p-p65、β-actin 一抗(1∶1 000),4 ℃孵育过夜,TBST 洗膜3 遍后,加入HRP 标记的二抗(1∶2 000),室温孵育2 h,TBST洗膜3遍,ECL显影液显色。凝胶成像系统成像,Image J软件计算灰度值,以β-actin为内参,计算目的蛋白相对表达量。
1.2.7 统计学方法采用SPSS 22.0 软件进行统计分析。计量资料用(±s)表示。两组间比较采用t检验,多组间比较采用单因素方差分析。以P< 0.05 为差异具有统计学意义。
2 结果
2.1 一般体征对照组小鼠活动和食欲正常,无扎堆情况。模型各组小鼠逐渐呼吸异常,身体发颤,扎堆聚集。模型组与各治疗组均有1 只小鼠死亡,造模成功率为90%。
2.2 小鼠肺功能检测小鼠FEV0.3、FVC、FEV0.3/FVC 检测结果显示,与对照组比较,模型组小鼠FEV0.3、FVC、FEV0.3/FVC 值显著降低(P< 0.05);给予党参多糖后,小鼠FEV0.3、FVC、FEV0.3/FVC 值均有不同程度升高(P< 0.05)。见图1。
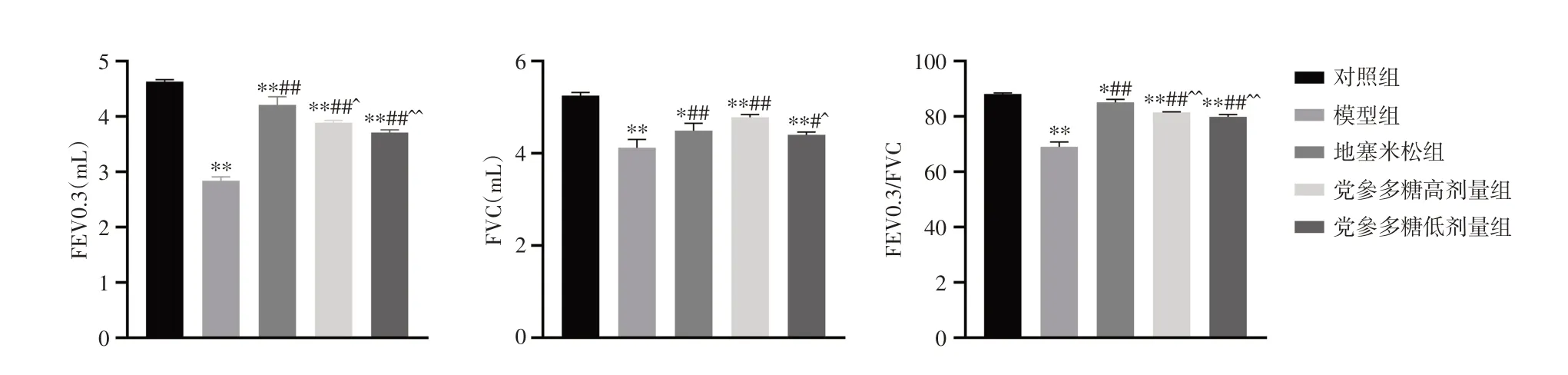
注:与对照组比较,*P < 0.05,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01;与地塞米松组比较,^P < 0.05,^^P < 0.01图1 党参多糖对小鼠肺功能指标的影响Fig.1 Effect of Codonopsis polysaccharide on lung function indexes in mice
2.3 小鼠肺组织W/D 检测与对照组比较,模型组小鼠肺组织W/D 水平显著升高(P< 0.05);给予党参多糖后,小鼠W/D水平均显著降低(P< 0.05)。见图2。
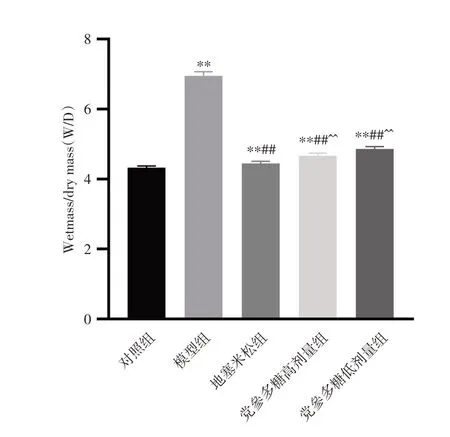
注:与对照组比较,*P < 0.05,**P < 0.01;与模型组比较,#P <0.05,##P < 0.01;与地塞米松组比较,^P < 0.05,^^P < 0.01图2 党参多糖对各组小鼠肺组织W/D 的影响Fig.2 Effect of Codonopsis polysaccharide on wet mass/dry mass in lung tissue of mice in each group
2.4 小鼠肺组织病理学观察对照组小鼠肺组织上皮细胞形态正常,无明显病理学改变;与对照组比较,模型组小鼠肺泡上皮细胞增生,肺泡隔明显增厚,间质见大量炎性细胞浸润,以核呈杆状的中性粒细胞为主;党参多糖高剂量组肺泡上皮细胞较为正常,间质见少量炎性细胞浸润;党参多糖低剂量组部分肺泡上皮细胞增生,肺泡隔有所增厚,间质见较多炎性细胞浸润。见图3。
2.5 小鼠BALF 炎性细胞分类和计数与对照组比较,模型组小鼠BALF 中性粒细胞和淋巴细胞均明显升高(P< 0.05);给予党参多糖后,小鼠中性粒细胞均显著降低,党参多糖高剂量组淋巴细胞显著降低(P< 0.05)。见图4。
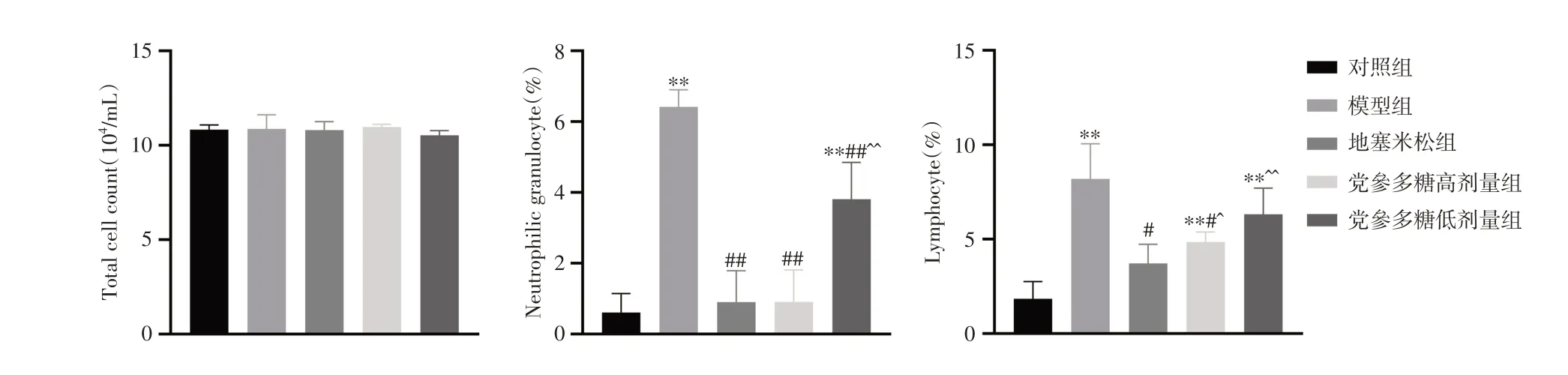
注:与对照组比较,*P < 0.05,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01;与地塞米松组比较,^P < 0.05,^^P < 0.01图4 党参多糖对小鼠BALF 炎性细胞数量及分类的影响Fig.4 Effect of Codonopsis polysaccharide on number and classification of inflammatory cells in BALF of mice
2.6 小鼠BALF 中IL-1β、IL-6、MPO、TNF-α 水平检测与对照组比较,模型组小鼠BALF 中IL-1β、IL-6、MPO、TNF-α 水平显著升高(P< 0.05);给予党参多糖后,小鼠IL-1β、IL-6、髓过氧化物酶(MPO)、TNF-α水平显著降低(P< 0.05)。见图5。
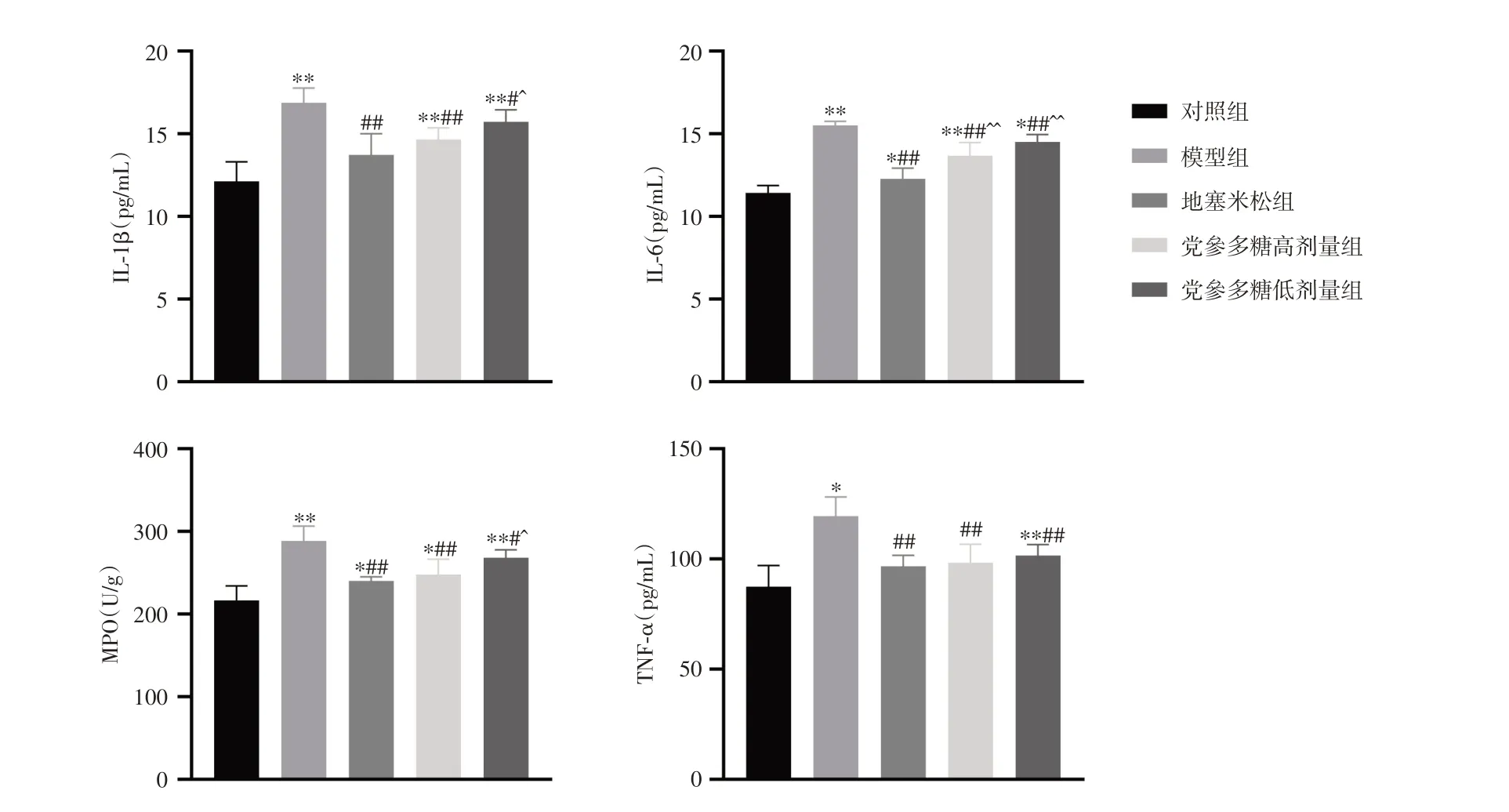
注:ELISA 法检测BALF 中IL-1β、IL-6、MPO、TNF-α 水平。与对照组比较,*P < 0.05,**P <0.01;与模型组比较,#P < 0.05,##P < 0.01;与地塞米松组比较,^P < 0.05,^^P < 0.01图5 党参多糖对小鼠BALF 中IL-1β、IL-6、MPO、TNF-α 水平的影响Fig.5 Effect of Codonopsis polysaccharide on the levels of IL-1β, IL-6, MPO and TNF-α in BALF of mice
2.7 小鼠血浆IL-1β、IL-6、MPO、TNF-α 水平检测与对照组比较,模型组小鼠血浆IL-1β、IL-6、MPO、TNF-α 水平显著升高(P< 0.01);给予党参多糖后,其IL-1β、IL-6、MPO、TNF-α 水平显著降低(P< 0.01)。见图6。
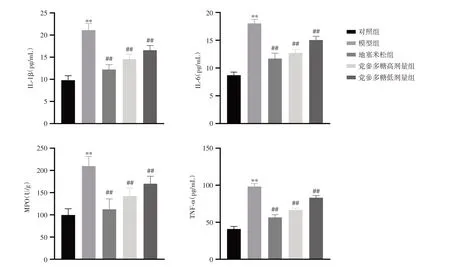
注:ELISA 法检测血浆IL-1β、IL-6、MPO、TNF-α 水平。与对照组比较,*P < 0.05,**P < 0.01;与模型组比较,#P < 0.05,##P < 0.01图6 党参多糖对小鼠血浆中IL-1β、IL-6、MPO、TNF-α 水平的影响Fig.6 Effect of Codonopsis polysaccharide on the levels of IL-1β, IL-6, MPO and TNF-α in plasma of mice
2.8 小鼠肺组织p-p38 MAPK、p-IκB-α、p-p65 的蛋白表达水平检测与对照组比较,模型组小鼠肺组织p-p38 MAPK、p-IκB-α、p-p65 蛋白水平均升高,差异具有统计学意义(P< 0.05);给予党参多糖后,小鼠p-p38 MAPK、p-IκB-α、p-p65 蛋白水平均降低,其中地塞米松组和党参多糖高剂量组p-p38 MAPK、p-IκB-α、p-p65 蛋白,以及党参多糖低剂量组p-p38 MAPK 蛋白相对表达差异具有统计学意义(P< 0.05)。见图7。
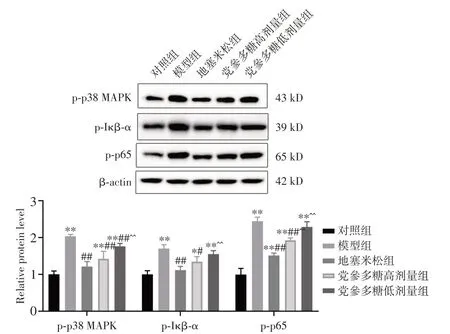
注:Western blot 法检测p-p38 MAPK、p-IκB-α 和p-p65 蛋白表达水平。与对照组比较,*P < 0.05,**P < 0.01;与模型组比较,#P <0.05,##P < 0.01;与地塞米松组比较,^P < 0.05,^^P < 0.01图7 党参多糖对小鼠肺组织p-p38 MAPK、p-IκB-α 和p-p65 蛋白相对表达水平的影响Fig.7 Effect of Codonopsis polysaccharide on expression levels of p-p38 MAPK、p-IκB-α and p-p65 in lung tissue of mice
3 讨论
ALI 是一类非心源性的全身性炎症反应引起的肺部疾病。LPS 是革兰氏阴性菌的外膜成分,是ALI 发病最常见的原因。当LPS 刺激机体时,可激活体内巨噬细胞,导致大量炎症因子产生,并诱导中性粒细胞在肺间质和肺泡内聚集,从而导致血管充血、肺水肿、肺泡萎缩等一系列肺组织损伤。ALI 主要分为三个阶段:急性期(肺组织积液,肺水肿现象),增生期和纤维化期[16]。在ALI早期,中性粒细胞和巨噬细胞聚集在肺部,产生大量炎症信号,导致肺水肿以及肺泡上皮细胞和血管内皮细胞的损伤[17-18]。ALI 患者病情进展迅速,患者往往因为体内的“炎症因子风暴”导致多器官受损和功能衰竭[19-20]。本研究采用腹腔注射LPS的方法建立ALI 模型,模拟了ALI 发生的病理过程。病理结果发现,ALI 模型党参多糖组小鼠肺组织肺泡上皮细胞增生,肺泡隔明显增厚,以中性粒细胞为主的大量炎性细胞浸润。这与ALI 病理改变一致,提示成功构建了ALI 模型。
中性粒细胞是LPS 诱导的肺部炎症反应中最重要的细胞之一,MPO 水平是中性粒细胞浸润组织的有效衡量指标。本研究结果显示,造模后小鼠BALF 中性粒细胞、淋巴细胞以及MPO 水平明显升高,而给予党参多糖后,高剂量党参多糖组小鼠中性粒细胞和淋巴细胞以及低剂量党参多糖组小鼠中性粒细胞水平明显降低。同时,造模后小鼠BALF 中水平明显升高,给予党参多糖后,其水平明显降低。提示党参多糖能降低急性肺损伤小鼠BALF 的中性粒细胞和淋巴细胞水平,缓解中性粒细胞对肺组织的浸润程度,不同程度缓解肺泡上皮细胞的增生。同时,肺功能检测发现,ALI 模型小鼠肺功能明显降低,给予党参多糖后,肺功能不同程度地好转。证明党参多糖可改善急性肺损伤小鼠肺功能。
当肺泡-毛细血管屏障的完整性被破坏时,表现为肺水肿。而肺组织W/D 增高是肺组织水肿的重要表征[21-23]。本研究发现,ALI 模型小鼠W/D 水平明显升高,给予党参多糖后,其水平明显降低。提示党参多糖可缓解急性肺损伤小鼠肺水肿。
MAPK 家族是一类高度保守的丝氨酸苏氨酸蛋白激酶,在细胞生长、增殖和分化中起着重要作用,并通过不同途径形成相应的传导通路,发挥不同的生物学效应。其中,p38MAPK 是介导细胞生长、发育、分裂和死亡的应激蛋白激酶,可对不同环境应激和炎症细胞因子的刺激做出反应,并与TNF-α 的产生密切相关[24]。而TNF-α 是ALI 发病学研究的焦点,在肺泡毛细血管屏障的损伤中起着重要作用[25]。NF-κB 是位于Toll 样受体信号通路下游的关键转录因子。当炎症或免疫反应发生时,活化的IκB-α 被磷酸化后,使NF-κB/p65 移位到细胞核,结合炎症相关基因,从而刺激促炎症介质的释放[26]。多项研究[27-28]表明,NF-κB 参与了LPS 诱导的ALI,并与TNF-α、IL-6 和IL-1β 等炎症因子的产生有关。这些炎症因子除了作用于炎症通路,进一步促进炎症因子的分泌以外,还能直接损伤血管内皮细胞和肺泡上皮细胞等功能细胞,损伤肺泡原毛细血管屏障,增加肺泡-血管屏障通透性,降低肺顺应性和肺功能[29]。本研究发现,LPS 诱导ALI 后,小鼠BALF 和血浆中IL-1β、IL-6和TNF-α 水平明显升高,肺组织p-p38 MAPK、p-IκB-α 和p-p65 蛋白相对表达明显增加。而给予党参多糖后,党参多糖组小鼠BALF 和血浆IL-1β、IL-6 和TNF-α 水平均明显降低。同时,高剂量党参多糖组小鼠p-p38 MAPK、p-IκB-α 和p-p65 蛋白和低剂量党参多糖组小鼠p-p38 MAPK 蛋白相对表达明显降低,提示ALI 模型小鼠肺组织功能产生障碍,而党参多糖可对抗这些作用。因此,认为党参多糖能发挥肺组织的保护作用可能是通过抑制MAPK/NF-κB 信号通路的激活来完成的。
综上所述,党参多糖可减轻LPS 诱导的ALI 模型小鼠的炎症反应,降低炎症细胞对肺组织的浸润,减轻肺水肿,改善肺功能,可能是通过抑制MAPK/NF-κB 信号通路的激活来完成的。本研究初步探索了党参多糖在ALI 中的抗炎及肺组织保护作用,为党参多糖治疗LPS 诱导的ALI 提供理论依据。但本研究还存在一定的局限性,仅涉及全身给药引起的ALI,后续本课题组还将继续完善其他给药方式引起的ALI 及其机制研究,为不同病因ALI 的治疗和药物研发提供进一步研究数据。
【Author contributions】GAO Chunlei, GUO Wei and WANG Ning performed the experiments and wrote the article.XIAO Ling performed the experiments.XIAO Ling and ZHANG Xuan revised the article.LIU Ming designed the study and reviewed the article.All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
