LiFSI-LiPF6电解液在高镍/硅碳锂电池中的应用
2024-04-14刘驰喻鹏张纯张薇王志国黄卫刘辉
刘驰 喻鹏 张纯 张薇 王志国 黄卫 刘辉

〔摘 要〕高镍/硅碳体系是最具潜力的下一代高能量密度锂离子电池体系,但由于电池循环稳定性差,目前规模化应用受限。研究认为,构建稳定的SEI是提升高镍/硅碳电池容量保持率的关键方法之一。传统电解液中六氟磷酸锂(LiPF6)会产生酸腐蚀性产物,不利于SEI的稳定;双氟磺酰亚胺锂(LiFSI)作为一种新秀锂盐被证明有优异的热稳定和成膜性能,会腐蚀正极集流体。研究了LiFSI-LiPF6双盐电解液在高镍/硅碳软包电池中的应用,通过化成、循环和储存测试,评测其电化学性能。结果表明,LiFSI-LiPF6电解液可以降低电池化成产气量和内阻,提升电极稳定性,0.6 mol/dm3 LiFSI + 0.6 mol/dm3 LiPF6电池循环1 000圈后的容量保持率最高,达75.66%,其储存电压降比LiFSI单盐电池少37.64%。
〔关键词〕六氟磷酸锂;双氟磺酰亚胺锂;双盐电解液;高镍/硅碳软包电池
中图分类号:O646;TM912 文献标志码:A 文章编号:1004-4345(2024)01-0009-05
Application of LiFSI-LiPF6 Electrolyte in High-grade Nickel/Silicon Carbon Lithium Batteries
LIU Chi, YU Peng, ZHANG Chun, ZHANG Wei, WANG Zhiguo, HUANG Wei, LIU Hui
(School of Chemistry and Materials Science of Hunan Agricultural University, Changsha, Hunan 410128, China)
Abstract The high-grade nickel/silicon carbon system is the most promising next-generation high-energy density lithium-ion battery system. However, owing to weak cycling stability of the battery, its large-scale application is currently limited. It believes in the study that building a stable SEI is one of the key methods to improve the capacity retention rate of high-grade nickel/silicon carbon batteries. LiPF6 in traditional electrolytes produces acidic corrosive products, which are not conducive to the stability of SEI. LiFSI has been proven to have excellent thermal stability and film-forming properties as a novel lithium salt, but it can corrode the positive current collector. The paper makes a study of the application of LiFSI-LiPF6 double-salt electrolyte in high-grade nickel/silicon carbon pouch batteries, and analyzes its electrochemical performance by formation, cycling, and storage tests. The results show that LiFSI-LiPF6 electrolyte can reduce the gas production and internal resistance of battery formation, and enhance electrode stability. The 0.6 mol/dm3 LiFSI+0.6 mol/dm3 LiPF6 battery has the highest capacity retention rate of 75.66% after 1 000 cycles, and its storage voltage drop is 37.64% less than that of the LiFSI single-salt battery.
Keywords LiPF6; LiFSI; double-salt electrolyte; high-grade nickel/silicon carbon pouch battery
0 前言
高鎳/硅碳体系锂电池是最具应用潜力的下一代高能量密度锂离子电池体系。其中,高镍正极材料已经成功应用于纯电动汽车中,与石墨负极搭配,作为目前能量密度最高的商业化电池体系[1-4]。受限于硅基材料嵌脱锂过程中较大的体积效应(>300%),硅碳负极仍未实现大规模商业化[5]。氧化亚硅(SiOx)是最有潜力的硅基负极材料[5-7],其在循环中的膨胀率高达160%[8],能使活性颗粒间失去电接触,导致电极表面的电极/电解液界面膜(Solid Electrolyte Interphase,简称“SEI膜”)的反复破碎与生成,消耗活性锂及电解液[9]。
电解液作为电池中的重要组成部分,不仅起到传输锂离子的作用,还能在电极表面通过氧化还原形成SEI膜,保护电极和电解液。如常用电解液中的溶剂碳酸乙烯酯(EC)可在石墨负极表面优先还原分解,生成富含Li2CO3、烷基碳酸锂等成分的SEI膜,阻止溶剂随锂离子共嵌入[10-11]。除成膜性能外,在循环过程中电解液还对SEI膜稳定性具有重要影响。常用电解液所采用的锂盐是六氟磷酸锂(LiPF6),其热稳定性差且对水分敏感,在常温下存在分解平衡反应LiPF6?葑HF+PF5。作为强路易斯酸(Lewis acid),PF5会与溶剂发生反应,生成CO2、氟代烷和POF3等[12-14]。此外,PF5遇水会进一步生成HF[15],腐蚀SEI膜[12],进而腐蚀电极[16],破坏电极结构,最终导致极大的容量衰减。这对硅基负极电池的影响尤为明显。HF与SEI膜反应产生的水会继续与PF5发生反应,持续产生HF和更多的气体。以上副反应会降低SEI膜的稳定性,消耗电解液,破坏电极,使电池的循环稳定性下降[11]。因此,科研工作者努力探索其他替代锂盐,最具代表性的是双氟磺酰亚胺锂(LiFSI)。LiFSI电解液具备较高的电导率和热稳定性,可以保证更高的电池容量,减少界面反应[17]。但LiFSI在3.3 V(vs. Li+/Li)下会腐蚀Al集流体[18],在扣式电池研究中还会腐蚀不锈钢组件[19],这些都限制了其推广应用。
LiFSI-LiPF6双盐电解液其中的LiFSI可以增强电解液的电导率并提升电解液的热稳定性,LiPF6则可以缓解LiFSI对Al集流体的腐蚀,提高正极侧稳定性,因此这种双盐电解液可能具有极大的应用潜力。本文拟将LiFSI-LiPF6双盐电解液应用于LiNi0.8Co0.1Mn0.1O2||Artificial Graphite-SiOx(NCM811||AG-SiOx)软包电池,研究该体系的电化学性能,探索LiFSI-LiPF6双盐电解液的应用可行性。电化学性能测试主要有化成测试(首次库伦效率、首圈放电容量、产气量、阻抗)、循环测试(循环放电容量、容量保持率、阻抗、产气量)、储存测试(断路储存电压降)。
1 实验材料与方法
1.1 电解液配置及电导率测试
配置电解液的试剂有:1)LiPF6(w≥99.93%);2)LiFSI(w≥99.93%);3)EC(w≥99.98%);4)DEC(w≥99.98%);5)EMC(w≥99.98%);6)DMC(w≥99.98%);7)分子筛(4A, beads)。
取分子筛于多功能管式炉中,在氩气氛围中,350 ℃下活化3 h。在纯氩气环境[?渍(H2O) < 0.01×10-6, ?渍(O2)< 0.01×10-6]的手套箱中,使用移液枪按体积比VEC∶VEMC∶VDEC∶VDMC=1∶1∶2∶6准确移取溶剂与混合;按质量比m电解液溶剂∶m分子筛=6∶1加入分子筛,静置1.5 h,除去溶剂中的痕量水。除水后的溶剂通过0.22 m有机系滤膜过滤后,按照1.2 mol/L、1.1 mol/L、0.6 mol/L、0.1 mol/L的濃度分别加入锂盐LiPF6或LiFSI,配制出1.2 mol/dm3 LiPF6、1.2 mol/dm3 LiFSI、1.1 mol/dm3 LiFSI+0.1 mol/dm3 LiPF6和0.6 mol/dm3 LiFSI+0.6 mol/dm3 LiPF6 4个体系电解液,分别命名为LiPF6单盐、LiFSI单盐、1.1+0.1体系电解液和0.6+0.6体系电解液。
对上述配制的电解液分别进行离子电导率测试:1)取2 mL电解液;2)在通风橱中,将所有测试样品和标准样品试管置于25 ℃水浴锅中静置10 min,待样品温度稳定于25 ℃;3)电导率测试仪经两标准样品校准后,再对待测样品进行测试。
1.2 电池注液及封装
将软包干电芯沿右侧封装线剪开,在真空条件下以105 ℃干燥14 h,除去电芯中的痕量水。将干燥过后的电芯装袋并快速转移至手套箱中,使用注射器准确移取4.5 g电解液至干电芯中。将注完液的电池移至真空预封机中进行封装,封装条件为真空度为90 kPa,温度为185 ℃,封装时间为4 s。
1.3 电化学性能测试
1)化成测试。封装好的电池用不锈钢夹具进行加压,置于45 ℃的电池测试恒温箱中进行化成,先以C/20的电流将电池充至1.5 V并恒压保持24 h,使电解液可以充分浸润电池电极孔隙及隔膜。随后,以C/100的小电流充电10 h,使电解液在电极表面充分反应形成钝化膜。再以C/15充电至4.2 V,放电至3.0 V,再充电至3.8 V。化成完成后的电池移入手套箱中,剪开气囊袋,排出气体后沿电极边缘进行二次封装。
2)循环测试。二次封装后的电池转移至25 ℃的电池测试恒温箱中,用新威CT-4008-5V6A电池测试仪对电池进行1 000圈长循环性能测试。测试以1 C的倍率在电压区间3.0~4.2 V进行恒流恒压充/放电,恒压充放电截止倍率为C/20。
3)储存测试。二次封装后的电池转移至45 ℃的电池测试恒温箱中,用新威CT-4008-5V6A电池测试仪对电池进行断路储存电压降测试。将电池以C/15的倍率充电至4.2 V,放电至3.0 V,以相同电流循环1圈后,最终以恒流恒压(截止倍率0.000 3 C)充电至4.2 V。对电池进行搁置,每6 h记录1次电压,共测试500 h。
将一次封装后、化成后、二次封装后、循环后、压降测试后的电池均悬挂于静水测试装置中,完全浸泡于超纯水中记录分析天平得到的示重,根据阿基米德原理Vgas =(m2-m1)/?籽,计算得到电池在化成、循环和储存测试中的产气量数据。
电池在化成、循环和储存测试后都将其充/放电至3.8 V(约50% SOC),并用Gamry Reference 620电化学工作站在25 ℃下进行交流阻抗测试。测试频率范围为0.1 ~ 10 MHz。
2 实验结果与讨论
2.1 电解液离子电导率
不同电解液在25 ℃下的离子电导率见图1。从图1可知,LiPF6单盐电解液的离子电导率比LiFSI单盐电解液低0.73 mS/cm。双盐电解液的离子电导率介于两个单盐电解液之间,LiFSI占比越大,离子电导率越高。
2.2 电池化成性能
搭配不同电解液的NCM811||AG-SiOx软包电池在化成首次充电过程的微分容量(dQ/dV)—电压曲线见图2。
图2(a)中的反应峰主要对应着电解液在AG-SiOx负极的还原分解。所有电池均在2.8 V附近出现还原反应峰,对应着EC的分解。在LiFSI单盐电池中EC的分解反应比在其他电池中提前了约0.05 V,但反应强度更低。图2(b)中,3.4~4.2 V的反应峰则主要代表着Li+在NCM811正极的脱出与在AG-SiOx负极的嵌入反应。其中,3.4~4.0 V的反应峰代表着NCM811正极脱锂过程中的六方晶系(H1)→单斜晶系(M)→六方晶系(H2)的相转变,4.1 V附近的反应峰代表着六方晶系(H2)→六方晶系(H3)的相转变。普遍认为H2→H3的相转变过程可逆性较差,易造成不可逆的正极容量损失。从图2中可见,搭配不同电解液的电池之间的差异集中于3.4~4.0 V;4.1 V时的H2→H3相转变峰高度重合,表明电解液锂盐体系的改变不会影响初始循环时的正极稳定性。
图3是搭配不同电解液的NCM811||AG-SiOx软包电池化成首圈放电容量及首次库伦效率。由图3可以看出,电池的首圈放电容量由高到低依次为LiFSI单盐、1.1+0.1体系、0.6+0.6体系、LiPF6单盐,即双盐电池的首次放电容量高于LiPF6单盐电池,低于LiFSI单盐电池。电池首次库伦效率由高到低依次为1.1+0.1体系(75.05%)、LiFSI单盐(74.93%)、0.6+0.6體系(74.71%)、LiPF6单盐(73.56%)。双盐电池首次库伦效率均高于LiPF6单盐电池,其中1.1 +0.1体系电池首次库伦效率最高。
图4是搭配不同电解液的NCM811||AG-SiOx软包电池化成后的交流阻抗Nyquist图以及等效电路拟合所得电荷转移阻抗(Rct)与SEI膜阻抗(RSEI)。由图4(b)可以看出,LiPF6单盐、LiFSI单盐、1.1+0.1体系和0.6+0.6体系电池化成后内阻(RSEI+Rct)依次为7.14 Ω·cm2、6.03 Ω·cm2、5.07 Ω·cm2和6.03 Ω·cm2。化成后的电池基本呈现出首次库伦效率越高、内阻越小的趋势,其中1.1+0.1体系电池内阻最小,LiPF6单盐电池内阻最大。电池内阻的大小决定循环过程中的充放电极化大小,深刻影响电池的循环容量。因此,双盐电池更可能释放出更高的循环容量。
图5是搭配不同电解液的NCM811||AG-SiOx软包电池化成产气量。化成产气量是电池工业化生产中的重要指标,剧烈的产气会导致电极或隔膜上出现许多微小气泡,使形成的SEI膜存在较多缺陷,影响电池循环性能,甚至引发安全问题。LiPF6单盐电池产气量最大,表明其中电解液发生的副反应最多,与化成过程中电池最低的首次库伦效率和最大的内阻相对应。双盐体系电池产气量均低于LiPF6单盐和LiFSI单盐电池,0.6+0.6体系电池产气量最小。
2.3 电池循环性能
电池完成化成后进行1 000圈的循环测试。搭配不同电解液的NCM811||AG-SiOx软包电池在25 ℃下的循环性能见图6。
从图6(a)可见,所有电池在前200圈经历了较大的容量衰减,主要是AG-SiOx负极中活性SiOx的流失。从图6(b)可知,循环1 000圈后的容量保持率从高到低依次为0.6+0.6体系(75.66%)、1.1+0.1体系(74.43%)、LiFSI单盐(74.24%)、LiPF6单盐(73.12%)。双盐电池的循环稳定性均高于LiFSI单盐和LiPF6单盐电池,循环性能最优的0.6+0.6体系电池循环1 000圈后的容量分别比LiPF6单盐电池和LiFSI单盐电池高27.1 mAh和13.9 mAh,循环容量保持率分别为2.54%和1.42%。
图7展示了搭配不同电解液的NCM811||AG-SiOx软包电池在25 ℃下循环1 000圈后的交流阻抗Nyquist图以及等效电路拟合所得Rct与RSEI。电池循环1 000圈后的内阻从小到大依次为:0.6+0.6体系(6.34 Ω·cm2)、LiPF6单盐(7.22 Ω·cm2)、1.1+ 0.1体系(14.10 Ω·cm2)、LiFSI单盐(20.99 Ω·cm2)。对比化成后的阻抗可知,LiPF6单盐和0.6 + 0.6体系电池循环1 000圈后的内阻分别增加了0.07 Ω·cm2和0.31 Ω·cm2,而LiFSI单盐和1.1+0.1体系电池循环1 000圈后的内阻则分别增加了14.96 Ω·cm2和9.03 Ω·cm2。可见,LiFSI占比较高的电池循环内阻显著增加,尤其是Rct。LiFSI单盐电池循环后的内阻远高于LiPF6单盐电池,但其循环容量以及稳定性却更高。电池循环容量的减少与电池内阻的增加及电极活性物质的流失紧密相关。因此,循环过程中LiPF6分解的酸性产物对SEI膜以及活性材料的腐蚀可能是LiPF6电池循环稳定性差的主要原因。
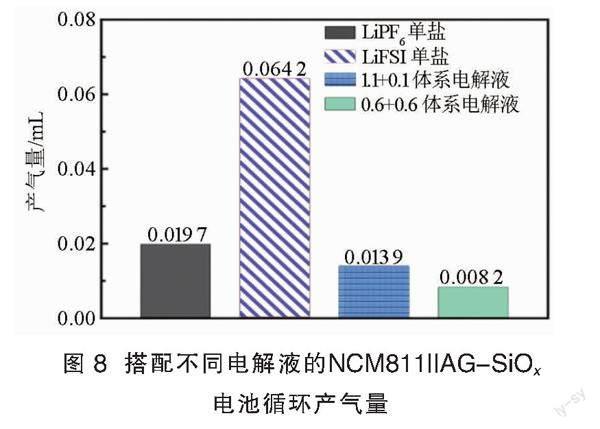
图8是搭配不同电解液的NCM811||AG-SiOx软包电池在25 ℃下1 000圈循环过程中的产气量。电池在循环过程中的产气量均显著低于化成产气量,表明电池服役过程中的产气主要源自化成阶段的成膜反应。LiFSI单盐电池循环产气量远大于LiPF6单盐电池的,双盐电池的循环产气量则小于LiPF6单盐和LiFSI单盐电池的,循环稳定性最佳的0.6+0.6体系电池循环产气量最小。
2.4 電池高温储存性能
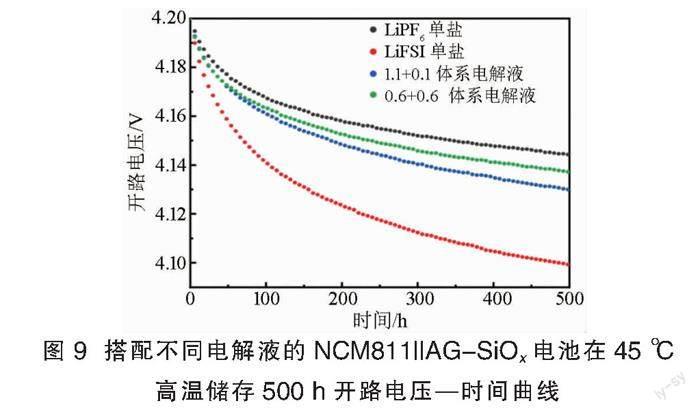
搭配不同电解液的NCM811||AG-SiOx软包电池在45 ℃高温下储存500 h的开路电压—时间曲线见图9。
当电池负极受到由EC分解所形成SEI膜的良好保护时,电池在高荷电态下的断路储存电压降数据可以反映电解液在正极的氧化和正极活性材料的损失溶解情况。电池储存500 h后的开路电压降从小到大依次为:LiPF6单盐(0.058 2 V)、0.6+0.6体系(0.062 5 V)、1.1+0.1体系(0.070 0 V)、LiFSI单盐(0.100 7 V)。由于高压下LiFSI对正极Al集流体的腐蚀,LiFSI单盐电池储存电压降最大,正极侧稳定性最差。1.1+0.1体系和0.6+0.6体系电池电压降分别比LiFSI单盐电池的少30.49%和37.64%,可见双盐体系则可显著改善LiFSI对正极稳定性的破坏,减少电池储存电压降,且其改善效果随LiPF6占比的增加而增加。
3 结论
本文研究了LiPF6-LiFSI电解液在NCM811||AG-SiOx软包电池中的应用,结果表明LiFSI-LiPF6双盐电解液对高镍/硅碳电池性能有明显提升作用,具体结果如下:1)LiFSI-LiPF6双盐电解液离子电导率高于LiPF6单盐电解液;2)LiFSI-LiPF6双盐电池首次放电容量高于LiPF6单盐电池;化成产气量和阻抗低于LiFSI和LiPF6单盐电池;3)LiFSI-LiPF6双盐电池循环稳定性高于LiFSI和LiPF6单盐电池,0.6 +0.6体系电池1 000圈容量保持率分别比LiPF6和LiFSI单盐电池高2.54%和1.42%;双盐电池循环后的阻抗均小于LiFSI单盐电池;4)LiFSI-LiPF6双盐电池储存自放电比LiFSI单盐电池少30.49%以上。进一步探索出合适的双盐浓度比例并配合使用合适的成膜添加剂,高镍/硅碳电池的循环稳定性将进一步提升,1 000圈后的容量保持率有望突破80%。
参考文献
[1] CHO Y,OH P,CHO J.A new type of protective surface layer for high-capacity Ni-based cathode materials: nanoscaled surface pillaring layer[J]. Nano letters,2013 (13): 1145-1152.
[2] ELLIS B L,LEE K T, NAZAR L F. Positive electrode materials for Li-ion and Li-batteries[J].Chem. mater., 2010(22): 691-714.
[3] YOSHIO M,NOGUCHI H,ITOH JI, et al.,Preparation and properties of LiCoyMnxNi1-x-yO2 as a cathode for lithium ion batteries[J]. J. Power sources,2000(90): 176-181.
[4] WOO S U, YOON C S, AMINE K, et al. Significant improvement of electrochemical performance of AlF3-coated Li[Ni0.8Co0.1Mn0.1]O2 Cathode materials[J]. J. Electrochem. Soc., 2007(154): 1005-1009.
[5] CHAE S, CHOI S H, KIM N., et al. Integration of graphite and silicon anodes for the vommercialization of high-energy lithium-ion batteries[J].Angewandte chemie international edition, 2020 (59): 110-135.
[6] YANG J , TAKEDA Y,IMANISHI N, et al. SiOx-based anodes for secondary lithium batteries[J].Solid state ionics, 2002(152/153): 125-129.
[7] KIM T,PARK S,OH S M. Solid-state NMR and electrochemical dilatometry study on Li+uptake/extraction mechanism in sio electrode[J]. J. Electrochem. Soc., 2007 (154): 1112-1117.
[8] JUNG S C, KIM H J, KIM J H, et al.Atomic-level understanding toward a high-capacity and high-power silicon oxide (SiOx) material[J]. J. phys. chem. C, 2016(120): 886-892.
[9] KWON T W,CHOIJ W,COSKUNA.The emerging era of supram-olecular polymeric binders in silicon anodes[J]. Chemical society reviews, 2018(47): 2145-2164.
[10] AURBACH D , MOSHKOVICH M, COHEN Y, et al. The study of surface film formation on noble-metal electrodes in alkyl carbo-nates/Li salt solutions, using simultaneous in situ AFM, EQCM, FTIR and EIS[J]. Langmuir, 1999(15): 2947-2960.
[11] KIM J, LEE J G, KIM H S, et al. Thermal degradation of solid electrolyte interphase(SEI) layers by phosphorus pentafluoride (PF5) attack[J].J. electrochem. soc., 2017 (164): 2418-2425.
[12] KAWAMURA T,KIMURA A, EGASHIRA M, et al. Thermal stability of alkyl carbonate mixed-solvent electrolytes for lithium ion cells[J]. J. power sources, 2002(104): 260-264.
[13] PARIMALAM B S, MACINTOSH A D, KADAM R, et al. Decomposition reactions of anode solid electrolyte interphase (SEI) components with LiPF6[J]. J. phys. chem. c, 2017 (121): 22733-22738.
[14] LIAO Z, ZHANG S, ZHAO Y, et al. Experimental evaluation of thermolysis-driven gas emissions from LiPF6-carbonate electrolyte used in lithium-ion batteries[J].J.energy chem.,2020(49):124-135.
[15] AURBACH D, ZABAN A, EIN-ELI Y, et al.Recent studies on the correlation between surface chemistry, morphology, three-dimensional structures and performance of Li and Li-C intercal-ation anodes in several important electrolyte systems[J].J. power sources, 1997(68): 91-98.
[16] CHOI N S, YEW K H, KIM H, et al. Surface layer formed on silicon thin-film electrode in lithium bis(oxalato) borate-based electrolyte[J]. J. power sources, 2007(172): 404-409.
[17] PHILIPPE B, DEDRYVRE R, GORGOI M, et al. Improved performances of nanosilicon electrodes using the salt LiFSI: a photoelectron spectroscopy study[J]. Journal of the American chemical society, 2013(135): 9829-9842.
[18] ABOUIMRANE A, DING J, DAVIDSON I J.Liquid electrolyte based on lithium bis-fluorosulfonyl imide salt: aluminum corrosion studies and lithium ion battery investigations[J].J. power sources, 2009 (189): 693-696.
[19] WU X Y, DU Z J.Study of the corrosion behavior of LiFSI based electrolyte for Li-ion cells[J]. Electrochem commun, 2021(129): 107088-107093.
收稿日期:2023-07-20
基金項目:长沙市自然科学基金(项目编号:kq2208079);广东省先进储能材料重点实验室开放课题(项目编号:AESM202103)
作者简介:刘驰(1998—),男,硕士研究生,主要从事高能量密度硅基锂离子电池适配电解液研究。
通信作者:刘辉(1985—),女,副教授,主要从事碱金属离子电池负极材料及适配电解液研究。
