子宫颈储备细胞及相关疾病研究进展
2024-04-14朱梓嫣
朱梓嫣,张 凡
(1.河北北方学院研究生学院,河北 张家口 075000;2.河北北方学院附属第一医院病理科,河北 张家口 075000)
子宫颈被覆上皮由鳞状上皮和腺上皮组成,两者交汇于子宫颈管外口,称为鳞柱交界区(squamocolumnar junction,SCJ)[1-2],该区域在婴儿出生后逐渐扩展形成移行区,由高柱状黏液上皮细胞和能够进行鳞状上皮化生的储备细胞组成,具有抵御机械损伤和炎症入侵的功能。该区域具有不同成熟水平化生的鳞状上皮向上与高柱状黏液上皮接壤,该区域也是人乳头瘤病毒(human papilloma virus,HPV)感染和宫颈病变易发区域[3-4]。
近年来,关于宫颈病变的细胞起源尚有争议,普遍认为子宫颈部位的幼稚细胞(包括鳞状上皮的基底细胞和腺上皮的储备细胞)是病变的来源细胞[5]。但最新研究发现婴儿出生后富含糖原的成熟鳞状上皮基底细胞可感染HPV,但癌变风险极低;移行区域鳞状上皮由于其鳞状化生的程度不同,较原始鳞状上皮增生活跃,其癌变风险相对较高[6];而柱状上皮下的储备细胞可分化成柱状上皮,亦可化生成鳞状上皮;不同成熟水平的化生性鳞状上皮感染HPV后会发生高级别鳞状上皮内病变和癌变,在其向腺上皮分化过程中亦可癌变为原位腺癌及浸润性腺癌,此区域癌变的风险最高[7-8]。因此部分学者推测宫颈储备细胞可能是宫颈癌的肿瘤干细胞,但尚需深入研究证实。目前认为储备细胞在异常分化情况下可能演变为包括鳞状细胞上皮内瘤变、鳞状细胞癌及具有鳞状分化、腺样分化的多种病变(如原位腺癌、腺样基底细胞癌、腺样囊性癌、基底细胞样鳞状细胞癌、复层分泌黏液的癌)。
1 子宫颈储备细胞的胚胎由来及演变
子宫颈和阴道上部从最初实心的中肾旁Müllerian管发育而来,阴道起源于泌尿生殖窦,两者均被覆柱状上皮,常规染色无法区分。随着胚胎的发育进展,泌尿生殖窦向子宫颈迁移并最终到达子宫颈管外口。泌尿生殖窦起源的储备细胞以CK17和p63共表达为特征[9],密度在SCJ附近达到最高,向峡部逐渐下降,是鳞状化生的主要起源细胞。起源于Müllerian管的储备细胞也分布于整个宫颈上皮,免疫组化结果显示CK7阳性,但在子宫峡部附近其密度最高。两种来源的储备细胞是腺上皮细胞更新的关键干细胞,也是腺体良性病变和恶性病变的关键干细胞。另有研究证实这些中肾管起源的储备细胞可同时表达CK17和p63[10],具有干细胞特性[3,11]。研究发现这些具有干细胞特性的储备细胞可能具有发展为鳞状化生上皮、(复发性)高级别鳞状上皮内病变(high-grade squamous intraepithelial lesion,HSIL)和宫颈鳞状细胞癌(squamous carcinoma of the cervix,SCC)的能力。
2 储备细胞的鳞状上皮化生和癌变
鳞状上皮病变可发生于宫颈的任何部位,包括宫颈阴道部、宫颈口或宫颈管,绝大多数鳞状细胞癌起源于化生的鳞状上皮,而不是宫颈和阴道的原始鳞状上皮。起源于泌尿生殖窦的储备细胞在SCJ处密度较高最易发生鳞状上皮化生[9]。鳞状化生的第一步是储备细胞多灶性增生,产生1~2排CK17和p16共表达的阳性细胞,部分顶部仍为高柱状上皮细胞,随后是未成熟的化生鳞状上皮,由几层均匀的立方体细胞组成,通常为CK17阳性[12-13]。SCJ中间层和浅表层的细胞进行糖原化后,化生的鳞状上皮类似于原始的鳞状上皮。该区域储备细胞鳞状化生的主要驱动因素是HPV感染,尤其是高危型HPV感染[14]。成熟的鳞状上皮基底细胞也会被HPV感染,当成熟鳞状上皮被感染时,表皮上层中角化不全细胞数量增多,病变细胞的层数增加,一般多于10层,而且可能与低级别鳞状上皮内病变(low-grade squamous intraepithelial lesion,LSIL)共存,尤其是感染不同亚型的HPV时此种特征尤为明显。HPV感染宫颈鳞柱交界处的储备细胞和未成熟的鳞状上皮化生细胞后,易发展为病变细胞层数小于9的HSIL,常被误认为未成熟的鳞状化生。大多数HSIL病变细胞层数大于10,通常由高危型HPV感染成熟的鳞状上皮细胞和未成熟的鳞状上皮化生细胞所致[9,15]。早期胚胎发育[7]如图1:两种不同来源的细胞谱系在子宫峡部相遇,人类阴道穹窿和宫颈下端的发育[7]如图2。
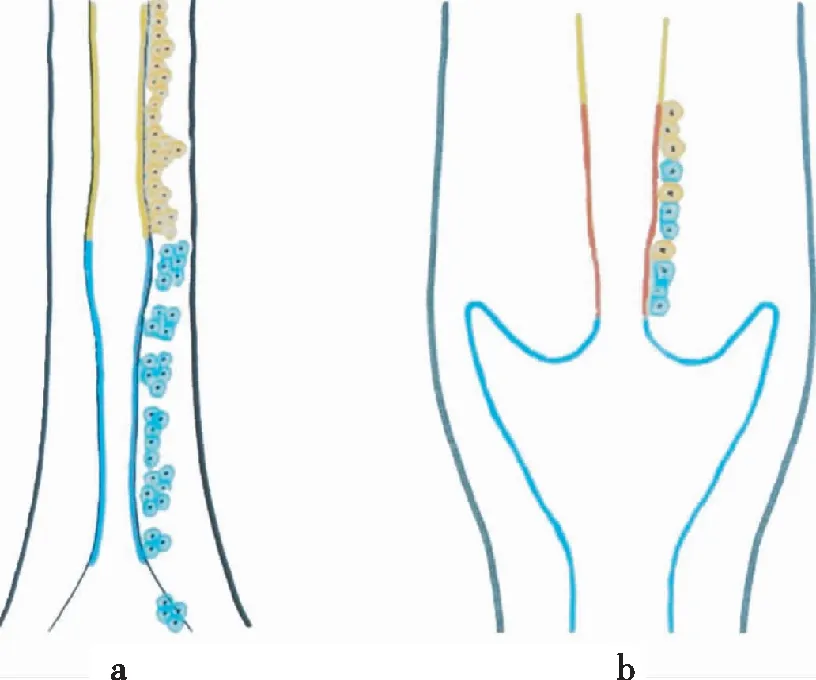
a-泌尿生殖窦结构(蓝色)和苗勒管结构(黄色)的边界;b-宫颈内上皮能够进行鳞状化生(红线),泌尿生殖窦衍生的CK17阳性储备细胞(蓝色)和苗勒管衍生的CK7阳性储备细胞(黄色)
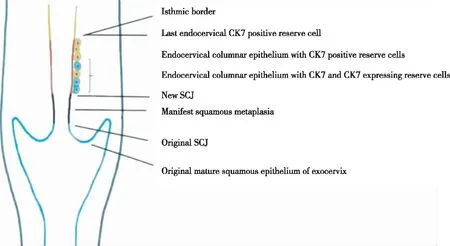
蓝线-阴道、阴道穹窿和宫颈外口被覆富含糖原的成熟鳞状上皮,该区域是鳞状宫颈癌的低风险区域;黑线-转化区,成熟化生的鳞状上皮,类似于原始鳞状上皮,源于p63/CK17阳性储备细胞,该区域也是鳞状宫颈癌的低风险区域,未成熟化生的鳞状上皮是鳞状细胞癌的高风险区域;红线-宫颈管柱状上皮,伴有泌尿生殖窦衍生的p63/CK17阳性储备细胞(蓝色细胞)和Müllerian管来源的CK7阳性储备细胞(黄色细胞),这些储备细胞是HPV感染的敏感细胞;黄线-子宫峡部黏膜是Müllerian管衍生为子宫内膜的一部分,含有CK7阳性宫颈内储备细胞,代表对HPV敏感的子宫上皮的上边界
3 宫颈储备细胞相关的病变
3.1 原位腺癌
宫颈腺癌的前期病变是指宫颈腺上皮呈现恶性表现,但没有间质浸润的早期腺性病变,如果不及时治疗将有进展为浸润性腺癌的风险。早期有学者将一些腺上皮细胞异型程度和核分裂象都明显低于原位腺癌(adenocarcinomainsitu,AIS)的宫颈病变命名为宫颈腺上皮不典型增生,也称宫颈腺上皮内瘤变(cervical glandular intraepithelial neoplasia,CGIN),并有二级三级分类法,其中二级分类法分为低级别CGIN及高级别CGIN;三级分类法分为CGIN I、II、III级。但临床治疗时发现很难准确掌握划分标准三级分类法,且重复性较差。2003年第3版WHO女性生殖系统肿瘤分类将宫颈腺上皮前驱病变分为腺体异型增生(glandular dysplasia)和原位腺癌[16]。国际子宫颈腺癌标准与分类(international endocervical adenocarcinoma criteria and classification,IECC)通过高倍镜观察到的核分裂和凋亡小体将宫颈腺癌分为人乳头状瘤病毒相关腺癌(human papilloma virus-associated adenocarcinoma,HPVA)和伴或不伴HPVA特征的非人乳头状瘤病毒相关腺癌(non human papilloma virus-associated adenocarcinoma,NHPVA)两大类[17]。因此,依据《WHO(2014)女性生殖系统肿瘤分类》[18]中宫颈鳞状上皮前驱病变的命名系统和分类原则,宫颈腺上皮的前驱病变只保留了AIS,并同时将高级别CGIN作为同义名词与之并列为宫颈腺上皮前驱病变。《WHO(2014)女性生殖系统肿瘤分类》明确了宫颈腺上皮前驱病变的组织学诊断标准,腺上皮细胞具有显著异型性,并可查见核分裂象,常伴有细胞凋亡,宫颈原位腺癌免疫组化检测结果显示p16呈弥漫强阳性,p16免疫组化检测可用于宫颈腺上皮前驱病变的辅助诊断。
与宫颈腺癌相似,绝大部分的宫颈AIS与HPV感染相关,其发病高峰年龄为35~39岁,比宫颈浸润腺癌发病年龄早10~15年。大部分患者无症状或偶尔出现异常的阴道不规则出血[19]。多数AIS是局灶性病变,但有少部分病例弥漫分布或多灶性分布。与HPV相关的宫颈AIS可以发生在宫颈任何部位的腺上皮,极易发生在宫颈的鳞柱交界处,且病变常同时累及宫颈黏膜表层和宫颈管深部,发病部位较为隐匿,通常在宫颈癌常规筛查中偶然发现,检出率仅为10%[20]。临床数据显示大约有25%~85%的宫颈上皮内病变、浸润性鳞状细胞癌和浸润性腺癌都伴有宫颈AIS病变。AIS的腺上皮与正常腺体的位置和结构基本一致,细胞异型性明显,细胞核增大、拥挤、深染、染色质增粗、核仁出现单个或多个核仁,可见正常或异常的核分裂象,细胞核出现不同程度复层。腺腔面出现核分裂象可作为AIS与良性腺上皮病变鉴别的重要依据。AIS分为不同的组织学亚型,主要包括宫颈黏膜型、子宫内膜样型、肠型、透明细胞型、腺鳞癌型、绒毛腺型及纤毛型。宫颈AIS细胞失去原来正常腺体的栅栏状结构,细胞排列成片状、腺样结构,细胞拥挤呈“羽毛状”[21]。值得注意的是,同样作为宫颈腺癌的前期病变,宫颈AIS比HSIL的危险性更高,且预后较差。有文献报道,大约有50%宫颈AIS患者同时伴有HSIL或浸润性宫颈鳞癌的病变,由于宫颈AIS的病变范围较为广泛,常呈多灶性,少数病变可呈跳跃性分布,并向上可累及宫颈管内口,针对鳞状上皮内病变的治疗并不完全适合AIS。通常情况下,约50%的病变与切缘距离1 mm以上患者的子宫全切标本中可见残留病变,75%的锥切标本显示“切缘呈阳性”患者的全切子宫标本中可见残留病变[22]。因此,建议病理科需详尽注明每个切缘与病变的具体距离(mm),甚至有学者提出,只有病变距切缘10 mm以上[23-24],才可诊断为“切缘呈阴性”。如果患者无生育要求,采用子宫全切术是比较谨慎的治疗措施。对于希望保留生育功能的患者,采取保守治疗,若切缘阴性,需排除浸润性癌;如果初次切缘阳性,应再次进行保守型切除,确认排除浸润性癌并获得阴性切缘,手术6个月后,进行宫颈细胞学、HPV-DNA检测及阴道镜检查,且需长期严格随访[25-26]。
3.2 子宫颈产生黏液的复层上皮内病变和子宫颈浸润性复层产黏液的癌
2000年Park JJ等提出子宫颈产生黏液的复层上皮内病变(stratified mucin-producing intraepithelial lesion,SMILE)[27],此病变可与HSIL、普通型宫颈AIS、宫颈浸润性鳞状细胞癌或腺癌伴随出现,罕见独立存在。最初有学者认为SMILE是一种前驱病变,可见细胞质内黏液,形态学上与腺鳞癌类似,但又有所不同。SMILE病变细胞表现出与鳞状上皮内病变相似的细胞分层、拥挤、核质比增加、核深染的结构特征。此外,细胞质中黏蛋白以不同比例弥漫分布于各层上皮细胞,因此细胞质出现空泡,细胞核间距离增加,没有典型腺体形成,其病变性质及肿瘤演进与子宫颈腺癌较为相似。第四版WHO女性生殖器官肿瘤分类将SMILE列为子宫颈原位腺癌的一种罕见亚型[28],尤其在临床诊疗中与宫颈原位腺癌的处理一致。SMILE的细胞形态与宫颈鳞状上皮内瘤变不同,病变往往出现在宫颈腺上皮的全层或深层隐窝,病变细胞呈复层排列,部分呈实性巢团状,全层细胞胞质中均含有黏液,呈现胞质内空泡,细胞异型性较大,细胞可出现核分裂象或凋亡小体。研究发现p40阳性表达提示SMILE的鳞状分化,且主要分布于癌巢周边,少量可散在分布于巢内,并表明宫颈癌前病变表型的多样性[29]。免疫组化染色结果显示,SMILE呈现p16弥漫强阳性,同时Ki-67高表达,胰岛素样生长因子ⅡmRNA结合蛋白 3(insulin-like growth factor Ⅱ mRNA-binding protein 3,IMP3)通常阴性,其他类型的原位腺癌中IMP3通常呈阳性[30]。
宫颈浸润性复层产黏液的癌(invasive stratified mucin-producing carcinoma,ISMC)由Lastra等于2016年首次报道并命名[31]。ISMC约占宫颈管腺癌病例的10%,占所有宫颈癌病例的1%左右,是继普通型(48%)和胃型(23%)宫颈管腺癌之后第三大最常见的宫颈管腺癌亚型。ISMC是一种人乳头状瘤病毒相关腺癌,无典型宫颈腺癌的典型柱状外观,ISMC的特征在于肿瘤细胞内可见不同数量的黏液空泡,细胞核不规则,无突出核仁,细胞呈栅栏状排列,浸润宫颈基质,同时伴有中性粒细胞的浸润,凋亡小体和核分裂象常见[32]。ISMC除上述经典形态,还可出现岛状、腺样、实性、乳头状、微乳头状、梁状生长[33]。ISMC最常见的首发症状是阴道出血,一些患者仅表现出细胞学检查结果异常,没有明显症状,发病年龄较普通型宫颈腺癌患者低,患者平均年龄为41.8岁。SMILE和ISMC可能起源于宫颈转化区中HPV感染的储备细胞,这些储备细胞具有多种分化潜能。宫颈储备细胞能够像干细胞一样分化为鳞状细胞和腺细胞,并且可同时表达鳞状上皮和腺上皮的特异性标志物,其组织学与基底层的储备细胞相似。二代测序技术结果亦显示,与上皮-间质转化和干细胞相关的基因突变频率更高,为证实ISMC起源于宫颈储备细胞提供了有利证据[34]。随着ISMC报道病例数的增多,对其形态谱系及预后的认识就越充分,有助于病理诊断及临床治疗[35]。此外,ISMC比其他类型宫颈腺癌的预后更差,更具侵袭性,并且具有远处转移的实质性风险,尤其是肺部转移。ISMC需与黏液表皮样癌、低分化鳞状细胞癌、浆液性癌、透明细胞癌、腺鳞癌、腺样囊性癌和腺样基底细胞癌进行鉴别诊断。
3.3 宫颈腺样基底细胞癌
宫颈腺样基底细胞癌少见,占宫颈腺癌的1%~4.7%[36]。宫颈腺样基底细胞癌好发于绝经后女性,患者发病年龄60岁左右。患者通常无明显临床症状,阴道镜检查时常仅表现为糜烂外观[37]。但是在宫颈细胞学筛查时,发现多数病例存在异型鳞状上皮细胞,并可以检测到HPV感染,主要为HPV16型。其病理学特征表现为子宫颈见不到明确肿块,镜下肿瘤细胞由体积大小、形态较一致、分化好的基底细胞样细胞组成,细胞排列成巢状、条索样结构,癌巢周边的细胞常呈栅栏状规整排列,少数病例可以形成明显筛状结构。肿瘤周边常可见高级别上皮内瘤变或浸润性鳞状细胞癌[38]。鉴别诊断包括腺样基底细胞增生,病变范围小而表浅,一般不超过5 mm,表现为小的基底样上皮细胞巢紧邻黏膜的鳞状上皮或子宫颈内膜腺体,其形状呈小叶状,腺腔中可见粉染的嗜酸性物质,病变中找不到明确的基底细胞样成分,免疫组化结果显示CD10阳性。恶性病变为腺样囊性癌,形成明确肿块,边缘不整齐,细胞异型性更明显,具有更明确的筛状结构,采用子宫全切术治疗,且预后较好。但此类肿瘤呈浸润性生长,可以延展到子宫下段,如合并其他类型癌,则依据具体的组织学类型采取相应的治疗方案。
3.4 宫颈腺样囊性癌
子宫颈腺样囊性癌极为罕见,约占所有宫颈癌的0.4%~1.7%,有个别文献报道有患者年龄低于40岁,但大部分患者为绝经后妇女[39],主要症状是阴道出血。与子宫颈腺样基底细胞癌极为相似,部分病例可以检测到HPV16型感染。肉眼观,肿瘤以外生性生长为主,大小不等,可触及坚硬肿块,质脆或有溃疡,肿瘤或可侵犯子宫颈管壁。组织学上,宫颈腺样囊性癌与发生在其他部位的腺样囊性癌形态一致,由均匀大小的基底细胞组成,细胞质稀少,细胞核呈圆形或椭圆形。细胞排列在拥挤的细胞岛中,细胞质很少,呈筛状模式,中央含有透明或嗜酸性物质[40],有时可观察到小梁、管状等不常见结构[41]。通常情况下,宫颈腺样囊性癌多合并HSIL及浸润性鳞癌,多位于浸润性鳞癌下方,侵及宫颈肌壁深层,且二者肿瘤界限清楚。有研究显示该肿瘤可发生t(6;9)(q22-23;p23-24)移位,出现涎腺肿瘤特异的MYB-NFIB融合基因。需要对宫颈腺样囊性癌与宫颈腺样基底细胞癌进行鉴别诊断[42],两种肿瘤组织学形态类似,但是宫颈腺样囊性癌中常可见明显的筛状结构,细胞相对较大,细胞核较深染,核分裂象易见,有时可见到坏死结构。此外,大约20%的宫颈腺样囊性癌患者的组织切片中可以观察到在其癌灶周围及组织间隙有小灶性的类似于宫颈腺样基底细胞癌特征的分化,部分学者认为这种小灶性的基底细胞巢是腺样囊性癌中分化较好的区域[43],据此有学者认为腺样基底细胞癌可能是腺样囊性癌的前体病变。
宫颈腺样囊性癌起源于具有多重分化功能的宫颈内储备细胞,大多数情况下,相关鳞状细胞分化的存在表明肿瘤起源于宫颈转化区的储备细胞,这些细胞被认为是大多数宫颈癌的祖细胞。宫颈腺样囊性癌具有侵袭性,局部复发倾向高,早期可出现淋巴结转移和远处转移,需改善术后治疗方案,加强治疗后随访,尤其应与其他具有类似组织形态的肿瘤鉴别诊断[44]。宫颈腺样囊性癌的治疗包括手术治疗和放化疗,与只进行全子宫切除的患者相比,早期手术后进行放化疗的患者具有更好预后。
4 展 望
宫颈鳞柱交界处的储备细胞极易受到高危型HPV的感染,与该区域细胞增生活跃程度密切相关。宫颈储备细胞与宫颈癌干细胞之间存在密切联系,对宫颈储备细胞分化机制的深入研究,将为宫颈上皮内病变的防治和宫颈恶性肿瘤的诊疗提供参考依据。
