间充质干细胞对糖尿病肾病小鼠lncRNA的干预及肾脏保护的可能机制
2024-04-08凡洋李亚玲雷蕾白彝华
凡洋 李亚玲 雷蕾 白彝华
(昆明医科大学第二附属医院肾脏内科,云南 昆明 650101)
糖尿病肾病(DN)是糖尿病一种严重的并发症,其特点是尿白蛋白排泄增加或肾小球滤过率(GFR)降低,或两者兼而有之〔1〕。DN目前是导致终末期肾病(ESRD)的主要原因,目前DN的临床治疗重点主要是控制血压、血糖及蛋白尿,这些措施可减缓而不是预防DN进展,因此许多接受临床治疗的患者最终仍可能进展为ESRD〔2〕。所以,DN作为威胁人类健康的常见疾病,急需对其治疗方法及其机制进行深入的探究,以更好地干预疾病进展。
间充质干细胞(MSC)来源于中胚层,是一类具有较强的自我更新能力和多项分化潜能的成体干细胞〔3〕。骨髓MSC(BMSC)已在DN治疗中得到广泛研究。动物模型中,显示出BMSC改善肾功能及抑制纤维化的能力,但其机制尚不清楚〔4〕。长链非编码RNA(lncRNA)是一类长度大于200 nt的非编码RNA,参与复杂而精确的基因调控网络,也与多种疾病的炎症发生相关。有研究报道,lncRNA与DN的纤维化有关〔5〕。
我们在前期对DN小鼠模型转录组测序(RNAseq)数据和正常小鼠进行筛选,筛选出在DN小鼠中表达异常增高的lncRNA,其中lncRNA NONMMUG023935升高最为显著,但是lncRNA NONMMUG023935与DN的肾小管间质纤维化之间的关系及lncRNA NONMMUG023935在MSC治疗DN过程中扮演的角色如何,目前尚未见文献报道,因此本研究的目标是探索MSC干预对DN小鼠中表达上调的lncRNA的影响及MSC作用下对小鼠肾小管上皮细胞中lncRNA NONMMUG023935表达变化的影响及其对肾脏保护可能机制。
1 材料与方法
1.1主要试剂与仪器 C57BL/6小鼠(南京东极生物),DMEM/F12(Hyclone,SH30023 ),胎牛血清(FBS,Hyclone,SH30070),磷酸盐缓冲液(PBS,南京生兴生物,SN331),Triton X-100(Alladin,T109027),牛血清白蛋白(BSA,Sigma-aldrich,V900933),流式细胞仪(BD,AccuriC6),α-MEM(Hyclone,SH30265.01B/500 ml),Tween-20(Solarbio,T8220),FITC-CD44(eBioscience,11-0441-82),FITC-CD45(eBioscience,11-0451-82),FITC-CD90(eBioscience,MA5-17752),噻唑蓝(MTT,beyotime,C0009),CO2培养箱(Thermo fisher,3131),MEM(Hyclone,SH30023),Trizol试剂(Takara,9108),分光光度仪Nano drop 2000(Thermo fisher,ECS000282),荧光定量 PCR仪(Applied Biosystems,Stepone plus),RIPA溶液(Thermo Fisher Scientific,Waltham,MA,USA),十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)仪(Bio-Rad,Mini Protean 3),聚偏氟乙烯(PVDF)膜(Millipore,ISEQ00010),化学发光检测系统(Tanon,5200),碧天云二喹啉甲酸(BCA)蛋白浓度测定试剂盒。
1.2lncRNA的筛选 将基因表达综合数据库(GEO)中的ID为GSE95376的表达数据下载,STZ建模的糖尿病小鼠,取肾脏组织,流式细胞术分离近端肾小管上皮细胞(PTCs),提取RNA,采集肾脏组织细胞在不同时间点进行RNAseq检测,时间点分别为2、4、8 w,n=2;对照为0 w,n=2。对不同时间点的小鼠RNAseq数据与正常小鼠进行筛选,根据样本中的基因,依据矫正P值<0.05和基因表达差异倍数(FC)>1.5或<-1.5,选择上调基因的前20位,得到差异非编码RNA基因列表。数据分析采用Tophat和cufflink软件比对(比对基因组为NONCODE v4.0)和分析。
1.3小鼠肾小管上皮细胞(mRTECs)的分离培养及鉴定 ①分离培养。取正常雄性C57BL/6小鼠1只,小鼠颈椎脱臼处死,浸泡在体积分数为75%的乙醇中5 min。无菌取肾,置于盛有4 ℃PBS培养皿中,用镊子仔细去除肾蒂及包膜,分离、剪碎肾皮质,移置于网筛上,用注射器栓芯轻轻研磨肾组织,并用PBS充分冲洗,将网筛倒扣于培养皿中,再次用PBS充分冲洗,收集网筛上的肾小管节段,1 000 r/min离心5 min,弃上清。向沉淀中加入质量分数为0.2%Ⅱ型胶原酶消化液5 ml,37 ℃水浴振荡消化15 min,加入含体积分数为10%的胎牛血清的DMEM/F12完全培养液终止消化,获得的细胞悬液过网筛后1 000 r/min离心5 min,弃上清。加入5 ml含体积分数为10%的FBS的DMEM/F12完全培养液,充分吹打混匀,接种于T25培养瓶中进行原代培养。定期观察细胞生长状态,于第3天更换培养基,以后隔天换液。当细胞生长至70%融合时可进行传代。去除培养基,加入PBS洗1~2次,去除PBS后,加入1 ml胰酶消化1~3 min后,加入3 ml完全培养基中和胰酶终止消化,将消化的细胞转移至15 ml离心管中,1 000 r/min离心10 min。倒掉上清后,加入3 ml培养基重悬细胞,1∶3传代至培养瓶中。1 w后,用于后续实验。②mRTECs鉴定。将细胞从培养箱中取出,去除培养基,加入预冷的 PBS 轻轻将细胞洗2次。加入4%多聚甲醛常温固定10 min,将多聚甲醛去除,加入预冷的PBS洗3次,每次5 min。加入含0.5% Triton X-100的PBS,在冰上将细胞膜穿刺10 min。去除PBS-Triton,加入预冷的PBS洗3次,每次5 min。加入PBS-3% BSA,常温封闭30 min。将CK18抗体按照1∶100比例稀释在PBS-1%BSA溶液中,去除封闭液后,加入一抗,室温孵育2 h或4 ℃孵育过夜。去除一抗,加入PBS-0.35%Tween20,洗3次,每次5 min。将荧光二抗分别按照1∶400比例稀释在 PBS-1%BSA溶液中,去除PBS-T后,加入二抗,室温避光孵育1 h。去除二抗,加入PBS-0.35%Tween20,洗3次,每次5 min。加入100 ng/ml 4′,6-二脒基-2-苯基吲哚(DAPI)溶液,室温避光孵育10 min。去除DAPI,加入PBS-0.35%Tween20,洗3次,每次5 min。加入防荧光淬灭溶液,4 ℃避光放置或直接在荧光显微镜拍照。
1.4BMSC分离培养及鉴定 ①分离培养。取C57小鼠1只,颈椎脱臼法处死,浸泡于75%乙醇中5~10 min,无菌手术器械取出双侧股骨及胫骨,去除附着肌肉,将其浸泡于适量PBS中。取5 ml针筒,吸取适量PBS插入一端干骺端,将骨髓中细胞冲至培养皿中,反复几次,直至股骨和胫骨发白,收集此细胞悬液,用200目滤网过滤去除稍大的杂质,将过滤的细胞悬液收集至离心管中1 000 r/min,5 min离心,弃上清,加入适量α-MEM培养基混匀,接种于培养瓶中,培养在37 ℃含5%CO2细胞培养箱中,2~3 d后全量更换培养基。当细胞长至80%~90%时,去除培养基,加入PBS洗1~2次,去除PBS后,加入1 ml胰酶消化1~3 min后,加入3 ml完全培养基中和胰酶终止消化,将消化的细胞转移至15 ml离心管中,1 000 r/min离心5 min。倒掉上清后,加入3 ml培养基重悬细胞,1∶3传代至培养皿中培养。②BMSC鉴定。BMSC培养在MEM培养基中,含10%胎牛血清,100 U/ml的青霉素,100 μg/ml的链霉素,培养在37 ℃含5%CO2的细胞培养箱中。当P1代细胞长至80%~90%时,去除培养基,加入PBS洗1~2次,去除PBS后,加入1 ml胰酶消化1~3 min后,加入3 ml完全培养基中和胰酶终止消化,将消化的细胞转移至15 ml离心管中,1 000 r/min离心5 min。倒掉上清后,加入3 ml培养基重悬细胞,1∶3传代至6孔板中培养。细胞用胰酶消化后,用PBS洗2次,用PBS将细胞沉淀重悬,将细胞调整成2×107个细胞/ml。1 500 r/min离心5 min,去除上清。取100 μl PBS重悬细胞,按照抗体说明书推荐浓度加入一抗,冰上避光孵育20 min。用PBS将细胞洗3次,每次1 000 r/min,4 ℃离心5 min。加入500 μl PBS将细胞重悬,上流式细胞仪检测。
1.5细胞处理及分组 按文献〔6〕方法将mRTECs细胞在DMEM培养基中培养24 h,DMEM中含有体积分数为10%的胎牛血清和5.5 mmol/L(对照组)或30 mmol/L(高糖组)葡萄糖。mRTECs分组:Control(Ctrl)组、高糖组(HG组)、高糖+BMSC(HG+BMSC,transwell 非接触,即将高糖处理后的mRTECs与BMSC共同在transwell小室中再培养24 h)组。
1.6MTT检测mRTECs细胞增殖率 将长到培养皿80%~90%的mRTECs细胞用胰酶消化下来,1 000 r/min离心5 min,去除上清,加入完全培养基重悬细胞,将细胞分别种在48孔板中,每孔种10 000个细胞。待细胞贴壁后,HG组和HG+BMSC组更换高糖培养基,HG+BMSC组放置transwell小室,小室内接种BMSC细胞,共同培养24 h后,加入20 μl MTT(5 mg/ml),在细胞培养箱中继续培养约3 h。去除培养基,每孔加入150 μl 二甲基亚砜(DMSO),摇晃均匀,在570 nm波长测定吸光度。实验重复3次。
1.7荧光定量PCR检测 Trizol试剂用于提取各组mRTECs细胞RNA,使用Nanodrop2000对样品进行定量。RNA纯度根据Nanodrop检测的浓度和OD230、OD260、OD280决定,并进行逆转录操作,获取cDNA,逆转录实验步骤按照逆转录试剂盒(takara,RR047)说明书操作。以cDNA为模板,进行荧光定量PCR。引物序列:合成的上皮标志蛋白E-钙黏蛋白(cadherin)上游5′-CAGTTCCGAGGTCTACACCTT-3′、下游5′-TGAATCGGGAGTCTTCCGAAA A-3′;纤维化指标α-平滑肌肌动蛋白(SMA)上游5′-CCCAGACATCAGGGAGTAATGG-3′、下游5′-TCTAT CGGATACTTCAGCGTCA-3′;vimentin上游5′-CGTCCACACGCACCTACAG-3′、下游5′-GGGGGATGAGGAATAGAGGCT-3′;Ⅰ型胶原(collagenⅠ)上游5′-GCTCCTCTTAGGGGCCACT-3′、下游5′-ATTGGGGACCCTTAGGCCAT-3′,lncRNA NONMMUG023935上游5′-GACCTGGAATATGGCGAGAAA-3′,下游5′-CACGTCCTA CAGTGGACATTT-3′;lncRNA NONMMUG030287上游5′-GGCCATCTCCACTTCTTAACTC-3′,下游5′-CGTGTCTCATGCTCCTTCTTAG-3′;lncRNA NONMMUG004302上游5′-GATGCCACCATCAAGTGAGATA-3′,下游5′-AGGGACTCCACTC CTGTAAA-3′;GAPDH上游5′-AGGTCGGTGTGAA CGGATTTG-3′,下游5′-GGGGTCGTTGATGGCAACA-3′。反应体系20 μl:cDNA模板2.0 μl,上下游引物各0.4 μl,SYBR®Premix Ex Taq(Takara,RR820A,即SYBR green溶液)10.0 μl,灭菌双蒸水7.2 μl。以GAPDH为内参。实验重复3次。
1.8lncRNA NONMMUG023935 siRNA干扰及lncRNA NONMMUG023935过表达实验表达 根据lncRNA NONMMUG023935的NM序列,采用BLOCK-iTTMRNAiDesigner 设计至少3条siRNA:①si-lncRNA NONMMUG023935-1:CTGAAAAAGGTGGAATATTTA;②si-lncRNA NONMMUG023935-1:ACGGAAAATGAGAAATACACA;③si-lncRNA NONMMUG023935-1:ATCATGGAAAATGAGAAACAT。通过脂质体转染siRNA,验证敲减效率和转染的剂量。构建正确的pcDNA3.1(+)-NONMMUG023935质粒扩大培养,si-NC:GAAATCCTCGGCAATCTAACG,用去内毒素质粒提取试剂盒抽提质粒,同时构建空载体作对照组使用。实验重复3次。mRTECs分组(9组):对照(ctrl)组、过表达对照(NC)组、lncRNA-NONMMUG023935过表达(lncRNA组)组;si-NC组、si-NONMMUG023935(si-lncRNA)组、高糖(HG)组、高糖+si-NONMMUG023935(HG+si-lncRNA)组;高糖+BMSC(HG+BMSC)组、高糖+BMSC+NONMMUG023935过表达(HG+BMSC+lncRNA)组。
1.9Western印迹实验 采用RIPA溶液提取上述各组蛋白,根据碧云天BCA测定试剂盒说明书操作测定,SDS-PAGE电泳仪分离等量蛋白质并转移到PVDF膜上,将膜用TBS从下向上浸湿后,移至含有封闭液(质量分数为5 %的脱脂奶粉TBST溶液)的平皿中,室温下脱色摇床上摇动封闭1 h。将一抗用含质量分数为1%的牛血清白蛋白的TBST溶液按照1∶1 000稀释于4 ℃孵育过夜,将二抗用TBST按照1∶5 000 稀释,室温下孵育2 h后,用TBST在室温下脱色摇床上洗3次,每次10 min;进行化学发光反应。采用Tanon ECL进行化学发光,按照试剂盒说明书操作,于Tanon5200化学发光成像仪下拍照,获取图片,观察免疫印迹。实验重复3次。
1.10统计学方法 采用SPSS26.0软件进行两独立样本的t检验、单因素方差分析。
2 结 果
2.1DN小鼠模型中表达上调前3名的lncRNA 前期筛选得到与糖尿病肾病相关的上调前20 lncRNA,分别为:NONMMUG023935(logFC8.51)、NONMMUG030287(logFC6.73)、NONMMUG043418(logFC3.03)、NONMMUG009828(logFC3.41)、NONMMUG042010(logFC3.74)、NONMMUG037567(logFC4.40)、NONMMUG043216(logFC3.55)、NONMMUG001757(logFC2.50)、NONMMUG031457(logFC3.16)、NONMMUG031454(logFC3.36)、NONMMUG018351(logFC3.10)、NONMMUG001726(logFC2.51)、NONMMUG017883(logFC2.48)、NONMMUG016531(logFC2.63)、NONMMUG027387(logFC4.07)、NONMMUG016619(logFC3.46)、NONMMUG004302(logFC4.78)、NONMMUG011245(logFC2.65)、NONMMUG010209(logFC3.99)、NONMMUG035948(logFC3.82)。其中表达上调前3位的lncRNA为NONMMUG023935、NONMMUG030287、NONMMUG004302。
2.2mRTECs鉴定 免疫鉴定呈抗细胞角蛋白(Cytokeration)18抗体染色阳性,细胞角蛋白18是主要在上皮细胞中表达的中间丝蛋白。这些数据表明细胞是mRTECs。见图1、图2。

图1 mRTECs、BMSC细胞白光(×100)

图2 mRTECs鉴定免疫荧光(×100)
2.3BMSC鉴定 BMSC 细胞CD45阴性,CD44和CD90表达阳性,阳性率分别为97.1%和95.3%,实验中使用的细胞鉴定为BMSC细胞。见图1、图3。
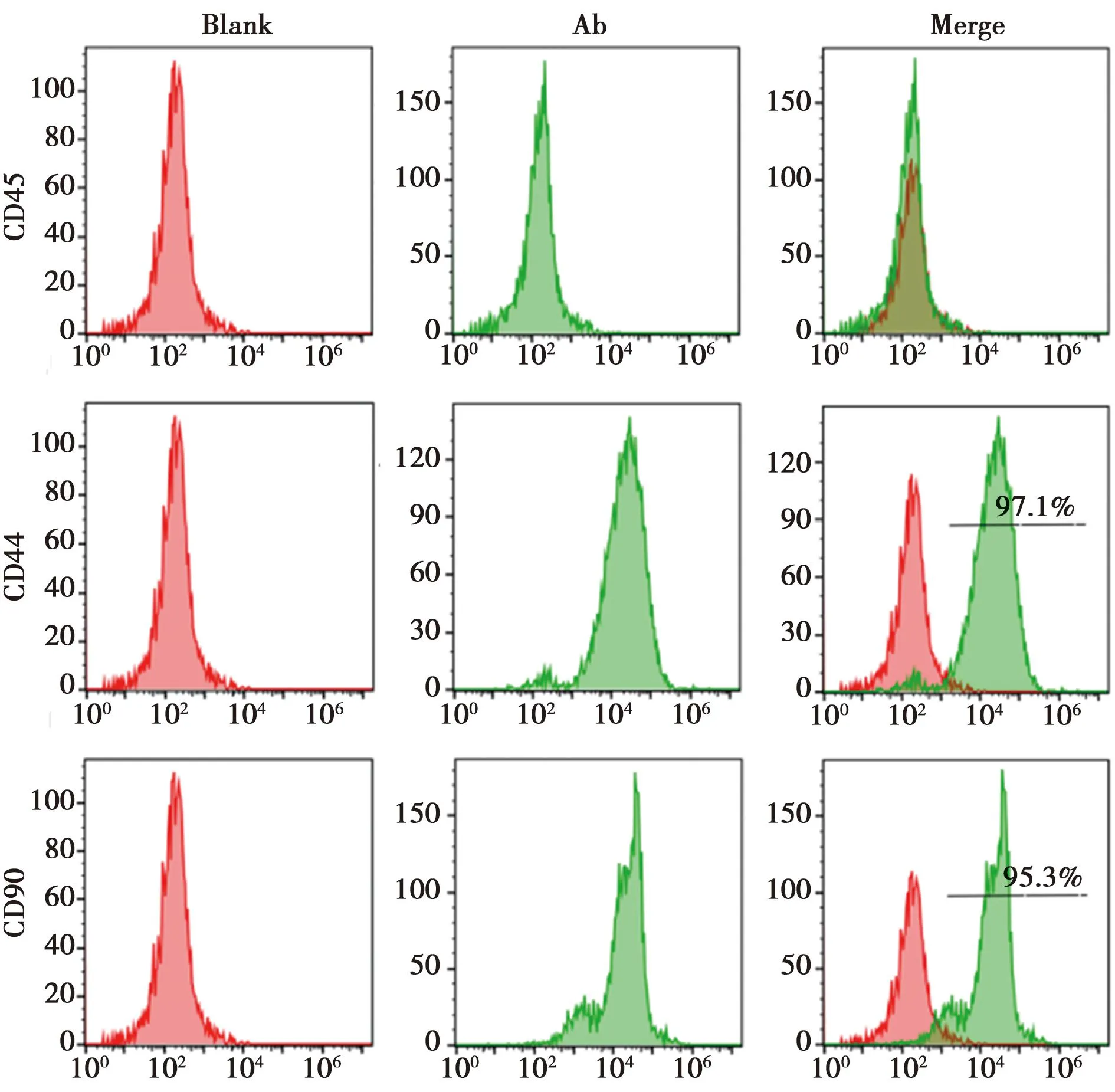
图3 PDSC细胞流式鉴定
2.4HG刺激及BMSC对mRTECs细胞增殖率的影响 与ctrl组相比,HG组mRTECs细胞增殖率显著升高(P<0.05);与HG组相比,HG+BMSC组mRTECs 细胞增殖率显著降低(P<0.05)。说明高糖促进mRTECs细胞增殖能力,加入BMSC后抑制增殖。见表1。

表1 各组mRTECs细胞增殖率、E-cadherin、α-SMA、vimentin 、collagenⅠ及lncRNA NONMMUG023935、NONMMUG030287、NONMMUG004302表达水平比较
2.5HG刺激及BMSC对mRTECs中collagenⅠ、α-SMA、vimentin、E-cadherin、lncRNA NONMMUG023935、lncRNA NONMMUG030287、lncRNA NONMMUG004302表达的影响 PCR检测结果显示,相比ctrl组,HG组collagenⅠ、α-SMA 和 vimentin、lncRNA NONMMUG023935、lncRNA NONMMUG030287、lncRNA NONMMUG004302表达水平均显著上升,E-cadherin表达水平显著下降(P<0.05),而HG+BMSC组对比HG组,collagenⅠ、α-SMA和vimentin、lncRNA NONMMUG023935、lncRNA NONMMUG030287、lncRNA NONMMUG004302表达水平均显著下降,E-cadherin表达显著上升(P<0.05)。说明BMSC细胞共培养可以缓解高糖引起的纤维化作用,在BMSC细胞共培养缓解高糖引起的纤维化作用时,其中lncRNA NONMMUG023935变化最为明显,后续选用该lncRNA进行后续研究。见表1。
2.6siRNA干扰mRTECs中lncRNA-NONMMUG 023935的表达 ctrl组、si-NC组、si-lncRNA NONMMUG 023935①组、si-lncRNA NONMMUG023935②组、si-lncRNA NONMMUG023935③组lncRNANONMMUG 023935表达分别为:1.00±0.14、0.99±0.10、0.63±0.06、0.68±0.08、0.27±0.07。转染si-lncRNA NONMMUG023935后,相对应的lncRNA-NONMMUG023935表达降低(F=188.276,P=0.000,n=3),说明si-lncRNA NONMMUG023935在细胞中起到预期的作用。
2.7lncRNA NONMMUG023935对BMSC干预HG刺激的mRTECs中collagenⅠ、E-cadherin、α-SMA和vimentin蛋白表达的影响 Western印迹结果显示,与NC组相比,lncRNA组collagenⅠ、α-SMA、vimentin蛋白表达均显著上升,E-cadherin蛋白表达水平显著下降(P<0.05),见表2、图4,说明lncRNA NONMMUG023935过表达促进肾小管上皮细胞纤维化。与HG组相比,si-NC组、si-lncRNA组、HG+si-lncRNA组collagenⅠ、α-SMA、vimentin蛋白表达均显著下降,E-cadherin表达显著上升(P<0.05),提示通过siRNA干扰lncRNA NONMMUG023935表达抑制肾小管上皮纤维化发生。而与HG+BMSC组相比,HG+BMSC+lncRNA组中collagenⅠ、α-SMA、vimentin蛋白表达均显著上升,E-cadherin蛋白表达显著下降(P<0.05),见表2、图4,说明BMSC可能是通过影响lncRNA NONMMUG023935表达从而抑制肾小管上皮纤维化发生。

表2 mRTECs不同处理后collagenⅠ、E-cadherin、α-SMA和vimentin蛋白表达比较

图4 各组mRTECs中collagenⅠ、E-cadherin、α-SMA和vimentin蛋白表达
3 讨 论
糖尿病引起的肾脏疾病是全球疾病负担的主要原因,1990~2012年,因DN导致的死亡人数增加了94%〔7〕。在欧洲、美国、日本,DN已成为ESRD主要病因,而在中国大陆,2015年,它已经超过肾小球肾炎成为住院人群中慢性肾脏病(CKD)主要病因〔8〕。
研究表明,上皮-间充质转化(EMT)是肾小管间质纤维化发生发展的重要机制,也是DN发展中重要的过程〔9〕。DN发展过程中存在的高脂血症及蛋白尿均可触发EMT〔10〕。研究发现,通过不同途径干预EMT的表达可以改善肾脏纤维化从而控制DN进展〔10,11〕。近年来,MSC作为治疗DN的一种可行的手段被广泛关注并成为研究热点。有研究表明MSC注射可抑制白蛋白尿和肾小管上皮细胞的损伤及延缓DN的进展〔12〕。这与本研究结果相同,说明高糖促进mRTECs细胞增殖能力,加入BMSC后抑制增殖。MSC延缓DN进展主要是通过修复肾损伤、调节免疫应答、抗炎、抗纤维化实现的〔13〕。在DN细胞模型中,MSC通过不同机制来缓解肾纤维化,减轻DN相关的肾功能损害〔14〕。
有证据表明,lncRNAs可以调节多种生物过程,包括参与DN发病机制和进展〔15,16〕。如高糖环境中通过上调lncRNA MALAT1可诱导人近端小管细胞的EMT和损伤〔17〕。
DN的特征是细胞外基质的积累及微炎症〔18〕。肾小管间质细胞外基质成分过度沉积是肾纤维化的进展的特征〔19〕。而EMT则被确定是肾脏纤维化的促发因素〔20〕。通过调节E-cadherin和a-SMA的表达可以改善EMT〔21〕。在EMT期间,E-cadherin表达下调,vimentin、α-SMA、 collagenⅠ表达上调〔21,22〕。本研究表明高糖可诱导EMT;lncRNA NONMMUG023935过表达促进肾小管上皮细胞纤维化;通过siRNA干扰lncRNA NONMMUG023935表达可以抑制肾小管上皮纤维化发生。
有研究表明,MSC可改善DN肾脏纤维化及延缓EMT进程〔23〕。本研究结果说明BMSC可以缓解高糖引起的肾小管上皮细胞EMT;MSC抑制小管细胞EMT的作用在过表达lncRNA NONMMUG023935时候减弱了,进一步证实lncRNA NONMMUG023935在MSC抑制EMT过程中发挥作用。
综上所述,MSC可能是通过下调DN肾小管上皮细胞中lncRNA NONMMUG023935的表达而改善肾脏纤维化,从而延缓DN的进程,这可能为治疗DN提供新靶点新思路。但是目前对于lncRNA NONMMUG023935的研究尚不够多,它与EMT的因果关系及与DN中的炎症等关系尚不清楚,需更进一步实验探讨。
