卡瑞利珠单抗致反应性皮肤毛细血管增生症1例*
2024-04-08蔡林璇陈岷吕子彦
蔡林璇,陈岷,吕子彦
(电子科技大学医学院,四川省医学科学院·四川省人民医院药学部,成都 610072)
1 病例介绍
1.1患者情况 患者,男,51岁,体质量51 kg,体表面积1.488 m2。2023年2月2日因“食管鳞癌(cT4bN2M0 IVA期)第3周期化疗后20余天,寻求下一步治疗”入院。2022年9月,患者自觉进食硬物后吞咽困难,无发热寒战,恶心呕吐,腹痛腹泻,未予以重视。2022年10月吞咽困难加重。2022年11月胸部增强CT示食道中上段管壁僵硬、偏心增厚,最厚处壁约13 mm,管腔狭窄,食道外膜欠规则,左侧壁明显,可疑侵犯周围脂肪间隙,病变与气管关系密切,气管轻度受压;纵隔见多发小淋巴结显示,较大者短径约8 mm,强化不均。于2022年11月14日胃镜活检,活检后常规病理报告示:查见鳞状细胞癌。初步诊断食管鳞状细胞癌(cT4bN2M0 IVA期)。既往史:既往体健,否认高血压、糖尿病;否认心、肾、肝等重要器官疾病史。有银屑病史:全身斑块皮屑瘙痒反复10年,治疗史不详。
1.2用药情况 患者于2022年11月27日、2022年12月17日、2023年1月10日行第一至三周期紫杉醇和卡铂化疗联合卡瑞利珠单抗免疫治疗,具体方案为:注射用紫杉醇(白蛋白结合型)400 mg(静脉滴注,d1)联合卡铂注射液600 mg(静脉滴注,d1)联合注射用卡瑞利珠单抗200 mg(苏州盛迪亚生物医药有限公司,批号:202205020F,静脉滴注,d1,规格:每支200 mg),q3w。
1.3不良反应描述 本次入院为患者第三周期化疗后20余天,发现患者足肿胀,全身可见剥脱性斑块皮屑,以双下肢、背部为甚(图1),后背部可见散在鲜红色圆形丘疹,部分破溃后成暗红色痣,入院目的为寻求下一周期治疗,并处理不良反应。
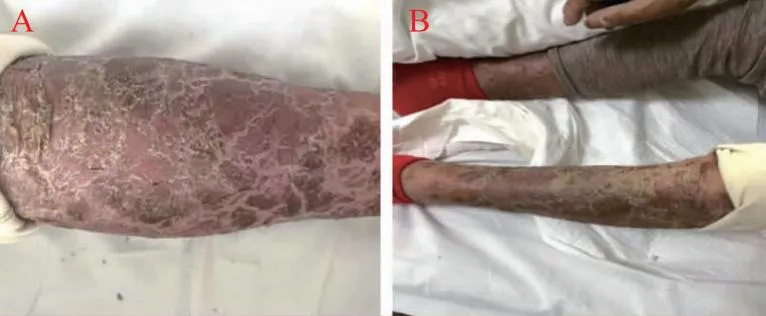
A.患者足肿胀;B.双足表皮剥脱,泛发破溃型结节。
中国临床肿瘤学会(Chinese Society of Clinical Oncology,CSCO)参考皮肤以及皮下组织疾病分级标准制定了RCCEP分级,CSCO分级中的G3级别描述为病灶呈泛发性,可并发感染,可能需要住院治疗,符合该患者情况。故结合《CSCO免疫检查点抑制剂相关的毒性管理指南2023版》[1](下称CSCO指南)、《卡瑞利珠单抗致反应性皮肤毛细血管增生症临床诊治专家共识》[2](下称专家共识)以及MDT意见,将患者的RCCEP定为3级。治疗方案:口服盐酸安罗替尼胶囊12 mg,qd;外用丙酸氯倍他索尿素乳膏5 g,bid;使用纱布保护易摩擦部位;窄谱紫外线(narrow band ultraviolet,NB-UVB)全身光疗,每周3次(1,3,5)治疗银屑病。
患者经过3个周期化疗联合免疫治疗,疗效评价SD。卡瑞利珠单抗引起RCCEP(3级),依据CSCO指南,需要暂停免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)治疗,待恢复至≤1级后重新给药。故2023年2月2日更改化疗方案,具体为:雷替曲塞4 mg(静脉滴注,第1天)联合奈达铂60 mg(静脉滴注,第1天~第2天),q3w。2023年2月4日结束第4周期化疗后,患者背部、后背部鲜红色圆形丘疹和暗红色痣面积明显减小,腿部和手臂的剥脱性斑块皮屑也显著改善(图2)。患者好转出院。
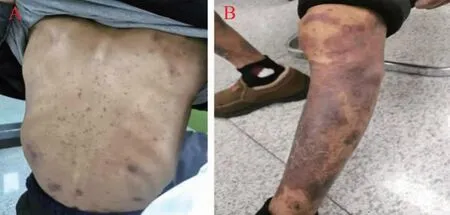
图2 患者经治后皮损恢复
2 讨论
2.1背景 ICIs作为一类新兴的免疫治疗药物,其疗效已在多项临床试验中得到证实[3-5],研究的靶点以程序性死亡受体-配体1(programmed cell death-ligand 1,PD-L1)和细胞毒性 T细胞相关蛋白-4(cytotoxic T lymphocyte associate protein-4,CTLA-4)为代表。截止至2023年3月,国内已有17种ICIs对应多种适应证获批上市,显著提高了许多晚期实体瘤患者的总生存期。卡瑞利珠单抗是ICIs中的一种,属于我国自主研发的人源化抗PD-1单克隆抗体,通过阻断PD-L1信号通路重新激活T细胞,诱导内源性免疫启动。RCCEP为卡瑞利珠单抗最常见的皮肤不良反应。
2.2不良反应相关性分析 患者诊断为食管鳞状细胞癌(cT4bN2M0 IVA期),有淋巴结转移,无远处转移,且食管癌常见转移部位为肺、脑、骨转移或淋巴系统转移,极少出现皮肤转移。结合患者的临床表现,考虑为药物的药理作用特征导致的皮肤不良反应。为甄别致敏药物,依据诺氏评估量表[6]行不良反应因果关系评分,注射用卡瑞利珠单抗:7分(很可能有关);注射用白蛋白结合型紫杉醇:3分(可能有关);卡铂注射液:3分(可能有关)。说明书明确指出RCCEP是卡瑞利珠单抗治疗患者最常见的不良反应,大多数患者在首次用药后2~4周内出现,少数患者在3~4个月后出现[2]。该患者在第3周期化疗结束20余天出现RCCEP,不良反应的出现与卡瑞利珠单抗在治疗时间上有合理的先后顺序。笔者未见白蛋白紫杉醇、卡铂引起RCCEP的文献报道,故判定最可能导致RCCEP的药物为注射用卡瑞利珠单抗。
2.3不良反应基本情况 ICIs的广泛应用也同时带来一些问题,抑制肿瘤免疫逃逸信号导致的T细胞过度激活会破坏免疫稳态的维持[7],进而发生免疫相关不良反应(immune-related adverse events,irAEs)。irAEs涉及多个系统和器官[8],包括皮肤、内分泌、血液毒性、肺、肾脏和心脏等。其中皮肤毒性是最常见的irAEs之一,大多易于处理,且可以不停用免疫治疗,轻度皮肤irAEs包括斑丘疹样皮疹、白癜风、银屑病、RCCEP等,而严重的皮肤irAEs(包括Stevens-Johnson综合征、中毒性表皮坏死松解症等)发生率则很低[9]。RCCEP是典型的使用ICIs导致的皮肤irAEs,主见于颜面部和躯干体表皮肤,有多种形态学表现且呈动态变化,一般分为:“斑片型”“红痣型”“瘤样型”“珍珠型”与“桑葚型”,该患者背部以及后背部的皮损即为红痣型。1~2级不危及生命,具有自限性[2]。RCCEP发生率为78.8%,其中1级约为71.1%~82.2%,3级仅为0%~4.8%,目前仅有极个别4级RCCEP报道[10],尚无5级RCCEP报道。
值得注意的是多项研究证实出现轻度皮肤irAEs与ICIs的临床疗效有一定相关性:一项前瞻性的观察性研究报道,使用帕博利珠单抗治疗转移性黑色素瘤患者,良好的客观缓解率与较高的白癜风发生率相关(71%vs.28%,P=0.002)[11];一项卡瑞利珠单抗治疗晚期肝癌的多中心II期临床试验发现RCCEP的发生与较高的客观缓解率显著相关[12]。这一现象表示患者疗效佳或可作为皮肤irAEs出现的预测,提示应更密切地监护患者皮肤状况,提前应对。但该规律并未在本次临床治疗中体现,患者出现了RCCEP,但使用卡瑞利珠单抗联合化疗的疗效欠佳,故而对于RCCEP的发生与客观缓解率之间的关系还需要在更大人群范围的临床应用中持续验证。

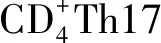
2.5RCCEP的预防与处理原则 有研究发现化疗药物以及抗血管药物与卡瑞利珠单抗联用可以降低RCCEP的发生率。王锋等[17]报道了3组患者分别接受卡瑞利珠单抗单药(38例)、联合甲磺酸阿帕替尼(6例)以及联合FOLFOX方案(18例)治疗原发性肝癌时出现RCCEP的情况,3组RCCEP发生率分别为:77.1%、33.3%和61.1%。SONG等[18]研究发现应用卡瑞利珠单抗联合沙利度胺治疗恶性肿瘤的RCCEP发生率(2/9,22.2%)显著低于卡瑞利珠单抗单药组(8/10,80%)。WU等[13]报告1例安罗替尼改善卡瑞利珠单抗诱导的RCCEP。本次的患者也通过口服安罗替尼胶囊成功缓解RCCEP症状。卡瑞利珠是人体VEGFR2的强激动剂,可激活血管内皮细胞增殖促进血管瘤生成[19],而安罗替尼是一种小分子多受体酪氨酸激酶抑制剂,它通过抑制VEGFR2、3,对血管生成和肿瘤生长产生广谱的抑制作用,二者相互拮抗,提示使用安罗替尼可能成为减少RCCEP的潜在管理措施。同理,高选择性VEGFR2酪氨酸激酶抑制剂阿帕替尼也可能存在抑制RCCEP的疗效。上述治疗方案显示出可预防RCCEP的希望,但仍需要进一步扩大样本的研究证实。
RCCEP的处理应按照分级标准而异,大多数情况下不需要特殊治疗。CSCO指南指出,分级为1级和2级的患者无需停止ICIs治疗,采用对症处理。如为了避免出血,可在易摩擦部位包裹纱布,等待RCCEP自行消退。破溃出血者可局部压迫止血,若影响日常生活也可采取激光切除等治疗措施[20-21]。分级为3级的患者需要暂停免疫治疗,恢复至≤1级可重新启用。局部和对症处理措施同1~2级患者,对于并发感染者予以抗感染治疗。
患者因食管鳞癌行3周期化疗联合卡瑞利珠单抗治疗引起RCCEP,患者经安罗替尼治疗后症状成功缓解。卡瑞利珠单抗最常见的不良反应为RCCEP,多在给药后2~4周发生,具有1或2级发生率高,3~5级发生率低的特点。卡瑞利珠单抗与化疗药物、抗血管药物联用可以降低RCCEP的发生率。RCCEP的症状轻,且具备自限性,故多数情况下不需要停药和特殊处理,应该在对症处理的基础上保持密切观察。有必要确定RCCEP的具体机制和预测危险因素,早期识别和对症管理有助于在不中断免疫治疗的情况下及时缓解症状。此外,卡瑞利珠的使用也可能导致银屑病的发生或复发加重。
