基于高分辨率T2WI的影像组学对直肠癌EGFR表达的预测价值
2024-04-07胡友强罗敏董小娟邹龙权谢刚张远林刘文军姜萍
胡友强,罗敏,董小娟,邹龙权,谢刚,张远林,刘文军,姜萍
(自贡市第四人民医院,1.放射科;2.病理科,四川 自贡 643000;3.自贡市第三人民医院放射科,四川 自贡 643020)
结直肠癌是消化系统中常见的恶性肿瘤之一,其发病率在世界范围内高居恶性肿瘤的第三位[1]。在我国,结直肠癌中有近一半为直肠癌,且近年来死亡率呈上升趋势,多数患者入院就诊时肿瘤已表现为局部进展期癌[2],我国抗击直肠癌的形势依然十分严峻。表皮生长因子受体(epidermal growth factor receptor,EGFR)作为一种跨膜糖蛋白受体,是表皮生长因子受体家族信号通路中的重要成员,具有酪氨酸激酶活性,活化后可激活下游通路,促进血管生成,诱导细胞增殖[3]。在许多肿瘤中均见到EGFR表达升高,EGFR表达与肿瘤的发生、发展有关。随着靶向EGFR药物西妥昔单抗的应用,有研究[4-5]显示,转移性结直肠癌化疗联合西妥昔单抗靶向治疗的总体生存和无进展生存均显著高于单纯化疗。因此,EGFR表达状态对直肠癌靶向治疗及预后评估具有重要价值,但目前尚缺乏无创性预测EGFR表达状态的可行办法。
影像组学的快速发展使MRI图像的定量化信息挖掘成为可能。目前,影像组学技术已广泛应用于肿瘤的精准预测、早期诊断及预后评估等方面[6]。目前,影像组学在直肠癌术前TN分期、远处转移及新辅助化疗疗效疗效评估方面已取得诸多成果[7-9]。也有学者[10]开始探索影像组学在直肠癌生物学特征评估方面的价值,但对于直肠癌EGFR表达状态的预测的研究尚未见报道。因此,本研究试图建立并验证基于高分辨率T2WI的影像组学特征,以无创性预测直肠癌EGFR表达状态。
1 资料与方法
1.1 一般资料
回顾性分析2018年6月至2020年6月自贡市第四人民医院收治的208例直肠癌患者的临床及影像资料。纳入标准:(1)术前1个月内行MRI检查,且有完整临床及MRI资料;(2)术后病理确诊为直肠腺癌;(3)病理资料中包含EGFR表达状态。排除标准:(1)MRI检查前行抗肿瘤治疗(新辅助化疗、放疗或者靶向治疗等);(2)合并其他恶性肿瘤;(3)MRI图像质量不佳,无法进行影像组学特征提取。其中年龄(67.00±10.20)岁。本研究经自贡市第四人民医院伦理委员会批准。
1.2 仪器与方法
采用西门子3.0 T MRI成像系统。所有研究对象检查前禁食时间>4 h,并在扫描前用开塞露(20 mL甘油)清洁肠道。直肠MR扫描主要序列包括:T1WI(横轴面)、脂肪抑制T2WI(矢状面)、高分辨率T2WI(斜横轴面)、DWI及增强扫描。高分辨率T2WI扫描平面垂直于病灶处肠管的长轴。扫描参数:TR 5 000 ms,TE 113 ms,FOV 160 mm,矩阵320×320,层厚3 mm,无层间距,无脂肪抑制技术。
1.3 免疫组化
病理学检查与免疫组化结果均由我院病理科医生完成,所有直肠癌肿瘤标本放置在4%中性甲醛固定,经石蜡包埋后连续切片,随后进行免疫组化染色。EGFR阳性评定标准:以脂肪组织为对照,在胞质及胞膜上棕黄色分布为阳性,若标本中阳性细胞占比≥5%,为EGFR阳性,反之则为阴性。
1.4 图像分割及特征提取
通过图像存档和通信系统上获取MRI原始图像,将轴位高分辨率T2WI序列图像导入3D slicer软件(https://www.slicer.org),由一名5年以上腹部放射学工作经验的医师沿肿瘤组织边缘逐层手动勾画,由另一名具备10年工作经验的高年资医师审核,共同确认得到病灶感兴趣容积(volume of interest,VOI)。见图1。应用Radiomics函数包提取影像组学特征。上述提取的影像组学特征,分为以下两类:(1)基于特征类,包括一阶统计量特征(first order statistic)、形状特征(shape-based)、纹理特征(texture)等;(2)基于过滤器类,包括小波分析(Wavelets)、拉普拉斯变换(Laplacian transforms)、对数特征(logarithm)、指数特征(exponential)等。最终,每例患者都提取了1 223个影像组学特征。

1.5 构建影像组学模型
采用Fe Ature Explorer(Version 0.3.6)分析影像组学特征:(1)数据预处理,以上采样法(Up Sampling)平衡样本,并以Z-score法对影像组学特征数据进行标准化处理;(2)特征降维,应用Pearson相关系数(pearson correlation coefficients,PCC)分析影像组学特征的相关性,如两个特征之一的PCC>0.99,则随机删除一个;(3)构建模型,建立模型之前,采用方差分析或递归特征消除方法筛选出基于高分辨率T2WI最优影像组学特征,分别建立支持向量机(SVM)、逻辑回归(LR)、随机森林(RF)及线性判别分析(LDA)四种分类器学习模型。为确定模型的超参数(如特征的数量),在训练数据集上应用5折交叉验证法,于训练集进行训练,于测试集评估其效能。
1.6 统计学分析
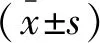
2 结果
2.1 一般资料
208例患者中,EGFR阳性表达99例(47.6%)。EGFR阳性组与阴性组间患者性别、年龄差异均无统计学意义(P>0.05),而T分期、淋巴结转移、分化程度差异有统计学意义(P<0.05)。见表1。二元Logistic回归分析显示低分化和淋巴结转移是EGFR阳性表达的独立危险因素(P<0.05)。见表2。训练集与测试集的患者在性别、年龄、TN分期及分化程度差异均无统计学意义(P>0.05)。见表3。
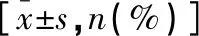
表1 EGFR阳性组与阳性组一般资料比较

表2 影响直肠癌EGFR表达指标二元Logistic回归分析

表3 训练集与测试集患者及病灶一般资料比较
2.2 影像组学特征
观察者内和观察者间基于高分辨率T2WI图像勾画直肠癌病灶VOI的一致性良好,ICC值为0.90(95%CI:0.81~0.95)。共提取1 223个影像组学特征,最终筛选出6个最优影像组学特征。见表4。

表4 基于高分辨率T2WI最终筛选出的影像组学特征
2.3 分类器模型预测表现
4种影像组学模型均有一定的预测效能。见表5。ROC曲线显示,SVM模型训练集与测试集的诊断效能均为最高:训练集AUC为0.803(95%CI:0.720~0.874),准确率、敏感度、特异度分别为77.9%、82.6%、73.7%;测试集AUC为0.725(95%CI:0.587~0.849),准确率、敏感度、特异度分别为71.4%、70.0%、72.7%。见图2。

表5 4种分类器影像组学模型评估直肠癌EGFR表达的效能

3 讨论
EGFR作为表皮生长因子受体家族信号通路中的重要成员,可促进肿瘤血管生成,诱导细胞增殖[3],对直肠癌靶向治疗及预后评估具有重要价值,但目前尚缺乏无创性预测EGFR表达状态的可行办法。本研究基于高分辨率T2WI图像用直肠癌VOI提取特征,再通过4种分类器建立相应影像组学模型用于直肠癌患者EGFR表达的预测研究。结果显示,4种影像组学模型均有一定的预测效能,SVM模型训练集与测试集的诊断效能均为最高。
EGFR广泛分布于器官组织中,在许多肿瘤中均见到EGFR表达升高。本研究中EGFR阳性表达率高达为47.6%,表明EGFR表达与直肠癌的发生密切相关。有学者[11]在非小细胞肺癌的研究中发现,在癌前病变阶段,患者的癌基因激活C-erbB-1 基因,随后EGFR过度表达,引起细胞异常分裂及增殖,导致不典型增生进而产生癌变。本研究结果显示,低分化和淋巴结转移是EGFR阳性表达的独立危险因素,这与焦俊霞等[12]研究基本一致,表明EGFR过度表达与直肠癌淋巴结转移和预后有关。
影像组学在直肠癌的研究主要集中在术前TN分期、远处转移及新辅助化疗疗效疗效评估方面[7-9]。对于直肠癌EGFR表达状态的预测的研究尚未见报道。本研究4种影像组学模型中,SVM模型训练集与测试集的诊断效能均为最高。SVM 是机器学习中最受关注的、性能良好的二分类器。它的思想是能够正确划分训练数据集,且在研究样本中找出几何间隔最大的超平面[13]。王楠等[14]应用4中分类方法进行建模,对直肠癌术前T分期进行预测,结果显示SVM 是效果最优的算法,其AUC高达0.968。本研究中4种分类方法,AUC均达到0.75以上,准确率也都高于0.71,这与Lambin等[15]提出的观点一致,好的影像组学特征应用不同分类器计算都应该获得较好的结果。因此,我们研究基于 MRI 数据开发肿瘤本身隐藏的数据信息来预测直肠癌的EGFR表达状态是有价值的。
本研究存在以下不足:(1)由于直肠癌肿瘤组织形态不规则,本研究采用手动分割逐层勾画兴趣区,该方法工作量大,不适用于大规模数据处理,基于深度学习的直肠癌兴趣区自动分割方法值得未来进一步研究。(2)本研究仅选择基于高分辨率T2WI图像进行评估,未来研究可加入多种MRI序列、多种影像学方法及实验室指标,构建多模态影像组学模型,更综合、更全面地探究术前预测直肠癌EGFR表达的问题。
综上,基于高分辨率T2WI图像的影像组学模型对直肠癌术前EGFR表达状态预测的评估具有一定价值,从而有助于临床医生为直肠癌患者制定个体化治疗方案和预后评估。
