深度烧伤痂脂肪干细胞源性外泌体蛋白组学差异的初步研究
2024-04-07巴雅力嘎巴特李全高雷李芳曹胜军
巴雅力嘎,巴特,李全,高雷,李芳,曹胜军
(1.内蒙古科技大学包头医学院,内蒙古 包头 014060;2.内蒙古医科大学第三附属医院烧伤外科·内蒙古烧伤医学研究所,内蒙古 包头 014010)
外泌体是由细胞分泌产生直径30~150 nm的小囊泡,内含各种RNA、DNA、蛋白质等,可介导细胞间信息传递及调控细胞功能活动[1-2]。同一个体不同细胞来源乃至不同病理生理状态下,外泌体所含蛋白质组及其执行的生物学功能不尽相同[3-4]。蛋白质组学是研究不同蛋白质之间相互作用及其在生物体内发挥功能的有效手段,可为疾病的诊断与治疗提供一定的理论依据[5]。
创面修复与瘢痕防治是烧伤外科学重点和难点。脂肪干细胞源性外泌体(adipose stem cell exosomes,ADSC-Exos)具有促进创面愈合、重塑及减轻瘢痕过度增生的作用[5-7],但关于ADSC-Exos 的蛋白组学研究鲜有报道。本研究以深度烧伤痂与正常皮下脂肪组织来源ADSC-Exos为研究对象,应用非标记定量蛋白质谱(label free quantification,LFQ)技术研究ADSC-Exos 蛋白质组表达水平差异,筛选标志蛋白并对其进行分析。
1 试剂与方法
1.1 材料与试剂
1.1.1 实验主要仪器及试剂 颗粒物粒度分析仪(NanoSight NS300,英国马尔文公司);生物型透射电子显微镜(Tecnai G2 SpiritBiotwin,美国FEI公司);智能型高效离心机(AvantiJXN-30,美国贝克曼库尔特公司);质谱仪(timsTOF Pro,美国布鲁克公司);液相色谱仪(UltiMate 3000 RSLCnano,丹麦泰尔茂费舍尔公司);0.15%Ⅰ型胶原酶(美国Gibco公司);胎牛血清(美国Gibco 公司);BCA蛋白浓度测定试剂盒(美国Sigma公司);成骨、成脂培养基(中国 Cyagen Biosciences Inc.公司);碳支持膜(中国中镜科仪公司);10%胎牛血清(美国Gibco公司);0.25%胰蛋白酶(美国Gibco公司);兔抗人CD64(日本SAB公司);兔抗人CD81单克隆抗体(日本Epitomics公司); DMEM/F12基础培养基(美国Hyclone公司)等。
1.1.2 取材对象 实验组选取Ⅲ度烧伤且<10%体表面积的痂下脂肪组织,患者年龄36~54岁;对照组选取整形外科患者,取腹部抽脂术中废弃的皮下脂肪组织,年龄38~52岁。两种来源的脂肪组织肉眼观察呈淡黄色,质地均匀、光滑、富有弹性,无明显液化、碳化、硬结。手术过程中的脂肪组织均选取肉眼观察健康的脂肪组织,对获取脂肪干细胞(adipose stem cell,ADSC)进行分离与传代,对初代ADSC-Exos进行蛋白组学分析。两组患者年龄差异无统计学意义(P>0.05)。
1.1.3 统计学分析 样本定量结果取log2,采用双样本双尾T检验的方法计算P值。 以P<0.05且差异表达量变化>1.5或<0.67分别作为显著上调及下调的阈值。
1.2 实验方法
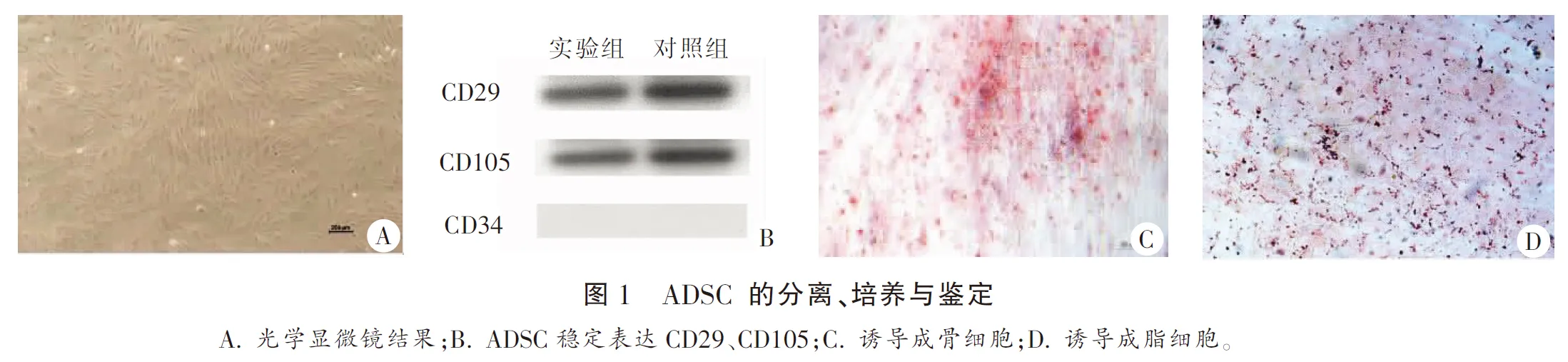
1.2.1 ADSC的分离、传代及鉴定 将实验组和对照组脂肪使用含双抗的磷酸盐缓冲液冲洗,除去多余组织,将脂肪组织剪碎,加入I型胶原酶消化外基质,使用滤网将溶解的脂肪组织从缓冲液中分离,在4 ℃条件下300×g离心除去其余夹杂细胞,弃去上清液及脂滴,获得初代ADSC[8]。将获得的细胞染色,光镜下进行观察,拍照记录。采用Western blot法将培养基中初代细胞离心后收集蛋白质,将得到的蛋白质电泳分离,转移至膜上,测定CD29、CD34、CD105表达水平。使用成骨、成脂培养基诱导 ADSC向成骨、成脂细胞分化,染色结果为鉴定ADSC提供参考[8]。
1.2.2 ADSC-Exos的分离与鉴定 取ADSC,用胎牛血清培养基培养,待细胞融合后用胎牛血清反复清洗,将培养基更换为不含胎牛血清培养基继续培养36~48 h,收集培养基上清液,采用差速离心法4 000×g离心40 min除去细胞碎片及较大囊泡,获得外泌体浓缩液。将外泌体浓缩液移至浓度30%蔗糖/重水密度垫上,离心管100 000×g 离心2 h,收集底部外泌体[8]。取20 μL外泌体悬液滴至电子显微镜铜网状栅中等待,负染、固定,晾干后拍照观察。使用去离子水溶液倒入20 μL外泌体浓缩液稀释至1 000 μL,上样,用Nanosight颗粒粒度分析仪检测ADSC-Exos的粒径和浓度,评估性质和质量。Western blot法测定 ADSC-Exos 表面标志物 CD81、CD64 表达水平[8]。
1.2.3 利用LFQ技术检测ADSC-Exos蛋白组学 (1)样品处理:向ADSC-Exos中加入裂解液充分混匀,进行组织匀浆离心,取上清。沉淀蛋白。将蛋白沉淀复溶,加入二硫苏糖醇孵育,加入碘乙酰胺进行烷基化反应。利用 Bradford 法测定蛋白浓度。向还原、烷基化样品中加入100 mmol/L Tris-HCl 溶液,将 Urea 浓度稀释至 <2 mol/L,以酶与蛋白 1∶50质量比加入胰蛋白酶,37 ℃孵育振荡酶切。第2天加入三氟乙酸(trifluoroacetic acid,TFA )终止酶切,取上清进行脱盐,抽干-20 ℃冻存待用。(2)质谱检测:样品进样与分离通过质谱仪在线液相色谱仪进行。肽段样品通过自动进样器吸入,结合至补集柱(trap column,TC),洗脱至分析柱进行分离。利用两个流动相建立分析梯度60 min。肽段进入质谱进行数据依赖采集模式(data dependent acquisition,DDA)扫描。(3)数据分析:质谱数据通过MaxQuant (V1.6.6) 软件进行检索,数据库检索算法为Andromeda,使用Uniprot中Human的蛋白质组参考数据库[9]。
2 结果
2.1 ADSC 的分离、培养与鉴定
两组患者初代ADSC体积较小,呈多形性,细胞形态分散。第2代ADSC保持较小的细胞体积和多形性,形态更为均匀、黏附性和增殖能力进一步增强。第3代ADSC细胞体积和形态更加统一,细胞的黏附性和增殖能力进一步增加光镜下呈纤维样、漩涡状或放射状生长,偶见多角形、纺锤形。细胞稳定表达ADSC 表面标志物CD29、CD105,未表达CD34(造血系分子标志物)。成骨诱导的细胞进行茜素红染色,镜下见成骨细胞特征性红色密集的钙结节。成脂诱导的细胞胞浆内有大量透亮、折光性好的脂滴,油红O染色呈红色。见图1。
2.2 ADSC-Exos分离与鉴定
透射电镜下可见分布较集中的外泌体,分散良好,直径30~150 nm,大小均一,呈双膜性结构的圆形或类圆形,中央较边缘电子密度稍低。Western blot检测显示,ADSC-Exos稳定表达表面标志物CD63、CD81。 NanoSight纳米颗粒跟踪分析表明,外泌体均匀对称分布,纯度较高,大部分直径30~150 nm,符合外泌体正常的粒径范围。见图2。

2.3 ADSC-Exos差异蛋白分析
基于LFQ技术,实验组/对照组差异倍数>1.5或<0.67,通过MaxQuant (V1.6.6)软件筛选出表达差异蛋白184个,筛选上调蛋白前10位丝裂原活化蛋白激酶3(mitogen-activated protein kinase 3,MAPK3)、丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1,MAPK1)、转化生长因子β-1(transforming growth factor beta-1,TGF-β1)、细胞凋亡调节因子BAX(apoptosis regulator BAX,BAX)、热休克蛋白HSP 90α(heat shock protein 90-alpha,HSP 90α)、微管蛋白α-1B链(tubulin alpha-1B chain,Tα-1B)、腺病毒E1B19kDa相互作用蛋白2(adenovirus E1B 19kDa interacting protein 2,AEIP2)、钙调素3(calmodulin-3,Clam3)、热休克蛋白HSP 90β(heat shock protein 90-beta,HSP 90β)、蛋白激酶Cβ型(protein kinase C beta type,PKCβ),下调蛋白前10位激肽源B1(kallikrein B1,KLKB1)、激肽源1(kininogen 1,KNG1)、补体C3(complement C3,C3)、补体C1q C链(complement C1q C chain,C1q C)、补体C1q B链(complement C1qB chain,C1qB)、补体C5(complement C5,C5)、补体C1q A链(complement C1q A chain,C1q A)、补体C4B(complement C4B,C4B)、补体C4A(complement C4A,C4A)、补体C9(complement C9,C9)进行分析。见表1。
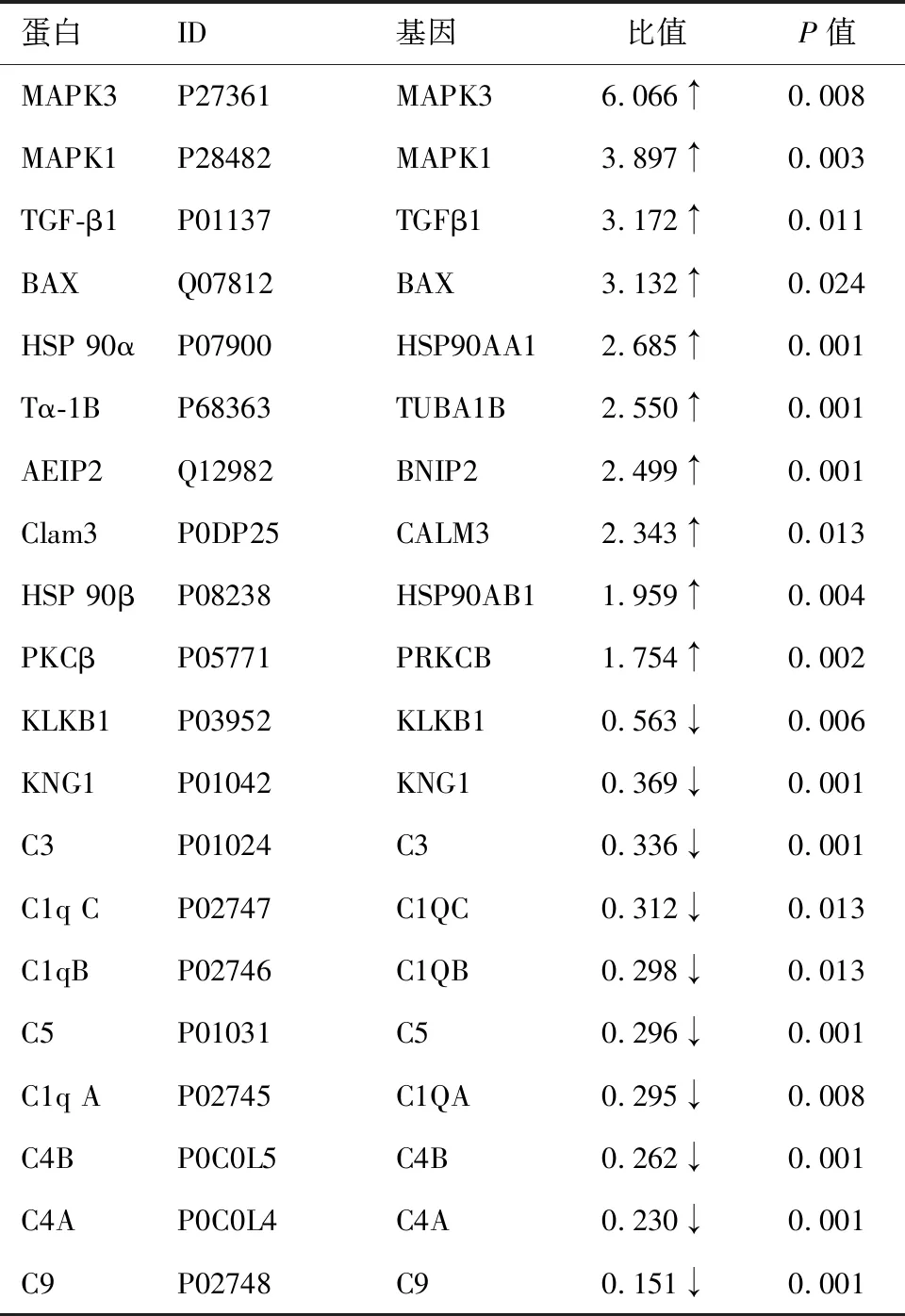
表1 不同来源ADSC-Exos蛋白表达水平差异
3 讨论
间充质干细胞(mesenchymal stem cell, MSC)作为一类多能非造血成体干细胞,骨髓、肌肉、肺、肝、胰腺、脂肪等组织中均可分离培养,来源广泛,具有向多种细胞分化、免疫调节、自我更新、抗炎及创面修复的能力[10-11]。ADSC隶属于MSC,易于获取且具有较强的迁移能力,可快速集聚于受伤部位,并能够分化为真皮成纤维细胞、内皮细胞和角质形成细胞等,因此在创伤修复、组织工程、皮肤及器官移植等研究领域具有较广泛的应用潜力[12-13]。但ADSC保存及运输较困难,移植异体ADSC易诱发较强的排斥反应、并存在潜在致瘤风险、伦理学等问题,其在烧、创伤患者救治中的临床应用受限[1,12]。胞吐是细胞执行生物学功能的重要途径,外泌体是细胞胞吐后的重要成分[14-15],且外泌体在无活体细胞的情况下仍可发挥与母细胞相似的生理功能[5-6]。因此,ADSC-Exos无免疫原性,与母细胞功能高度同源且特异性较强,在内环境中较稳定,并易于量化、保存方便,可弥补ADSC临床应用的缺陷[16-17]。本研究利用高速离心法分离出直径30~150nm细胞外泌体,分别通过电镜观察、Western blot、纳米颗粒跟踪分析仪证实其为ADSC-Exos,证明实验获取的外泌体具有一定的稳定性和可靠性。
蛋白组学研究可为ADSC-Exos在烧、创伤中实现创面愈合、瘢痕过度增生及其它分子机制提供重要参考。本研究对不同来源外泌体行蛋白质组学分析,筛选出表达差异蛋白184个,分析其功能主要集中在参与创面修复、减轻瘢痕过度增生、抗炎及机体免疫作用等方面。MAPK3与MAPK1可调节磷酸化下游靶点蛋白,是重要的细胞分化、增殖诱导信号分子[18-19];HSP90AA1可激活相关信号通路抑制皮肤细胞凋亡[20-22],可能与促进局部创面修复密切相关。细胞凋亡调节因子BAX为促凋亡基因激活物,BNIP2为抗凋亡基因激活物,两者通过级联反应致调节细胞凋亡[23-24],可能与创面修复和减轻创面过度增生相关。PRKCB表达与炎症、感染及细胞自噬相互联系[25-26],KLKB1与KNG1下调可减少血管扩张[27]。另外,补体家族蛋白与机体感染免疫均有一定联系,以上蛋白下调可有效减少机体局部炎症反应,改善局部微环境,在抗炎及调节机体免疫反应中发挥重要作用[28]。
外泌体蛋白组学研究近年来逐渐成为生命科学和临床医学的热点领域。本研究通过对不同来源 ADSC-Exos 的蛋白组学进行差异分析,初步筛选了表达水平差异蛋白,发现差异蛋白不仅参与创面修复及减轻瘢痕过度增生等作用,在抗炎、免疫、抗感染方面也有积极作用,为靶向治疗药物研发提供了有效的理论依据,但具体分子机制还需要进一步实验来阐明。
