丁苯酞对小鼠颅脑损伤后认知功能的保护作用
2024-04-07牛文书张振红王玉斌李经纶刘扬
牛文书,张振红,王玉斌,李经纶,刘扬
(联勤保障部队第九八八医院,1.神经内科;2.神经外科,河南 郑州 450000)
外伤性颅脑损伤(traumatic brain injury,TBI)会造成感觉、认知、行为、运动等功能损害,是45岁以下人群致死、致残的重要病因之一[1]。TBI后神经功能障碍可由直接和间接的机械损伤及合并的脑出血、缺血、水肿引起,也可由继发的生化和病理生理层面的级联反应引起[2-3]。除手术、康复锻炼外,有效的脑保护药物也是治疗颅脑损伤的策略之一。丁苯酞是我国自主研发的脑血管领域新药,具有抗炎、抗氧化、减轻神经细胞损伤、促进神经功能恢复等作用[4]。丁苯酞目前已被证实可改善大脑认知功能,在急性脑梗死、血管性痴呆等疾病中显示了良好的临床效果[5]。有研究[6]报道丁苯酞能改善TBI小鼠的神经功能评分,但目前对丁苯酞在TBI后认知障碍的应用报道较少。基于此,本研究拟通过构建小鼠急性TBI模型,旨在初步探讨丁苯酞对脑外伤后认知障碍的保护作用及可能的机制。
1 材料与方法
1.1 实验动物
SPF级健康雄性昆明小鼠40只,由郑州大学实验动物中心提供,7~8周龄,体重(27±2.1)g。饲养条件:光照时间12 h,室温20~22 ℃,湿度50%~60%,给予充足无菌水及饲料喂养,适应性喂养7 d。实验经本院实验动物伦理委员会批准,实验过程符合国家和单位有关实验动物的管理和使用规定。
1.2 主要实验仪器和试剂
丁苯酞氯化钠注射液(石药集团恩必普药业有限公司);抗小鼠脑衍生神经营养因子(brain-derived neurotrophic factor,BDNF)抗体(美国Abcam);抗小鼠GAPDH抗体(美国Abcam);BCA试剂盒(上海碧云天),TUNEL反应试剂盒(武汉伊莱瑞特生物科技股份有限公司);DP71型荧光显微镜(日本奥林巴斯株式会社);成像系统(加拿大QImaging公司),Morris水迷宫系统(北京友诚嘉业生物科技有限公司);凝胶成像分析系统(美国BioRAD)等。
1.3 实验方法
1.3.1 模型制备及分组 将小鼠随机分为假手术组、手术对照组、丁苯酞处理组1和组2,每组各10只。小鼠适应性喂养7 d后,手术对照组、丁苯酞处理组1和组2采用压缩损伤法诱导颅脑损伤。小鼠经0.3%戊巴比妥钠腹腔注射麻醉后固定于鼠板上,备皮消毒,沿颅中线切开头皮并暴露顶骨,在左顶部用牙科钻研磨一直径约为4 mm的骨窗,仅保留薄层颅骨。将小鼠固定于脑立体定位仪上,脑立体定位仪纵轴连接一钝端直径为3 mm的无菌损伤器械,以前囟后1.8 mm、中线旁2 mm为中心,缓慢旋转脑立体定位仪纵轴,使骨面与损伤器械钝端接触后向下按压1.3 mm,导致颅骨向内塌陷压缩脑组织。打击结束后清洁创面,用骨蜡封闭骨窗,逐层缝合头皮,放回鼠笼。假手术组仅磨薄颅骨,不造成脑压缩损伤,其余步骤一致。
1.3.2 实验方法 以腹腔注射给药对小鼠进行干预。假手术组给予200 mg·kg-1·d-1丁苯酞处理;丁苯酞处理组1和组2分别给予100 mg·kg-1·d-1、200 mg·kg-1·d-1丁苯酞处理;手术对照组给予同等剂量生理盐水处理。自开始造模前1 d每日固定时间给药,连续给药15 d。
1.4 检测指标
1.4.1 神经行为学 (1)Y型迷宫测试。于建模后7 d、14 d以Y型迷宫自发轮替行为测试。Y型迷宫由3个不透光等长臂组成(长30 cm,宽8 cm,高15 cm),相邻臂之间的角度为 120 °。小鼠初始置于迷宫的中心位置,并允许自由探索3个臂10 min。自发轮替行为定义为大鼠依次连续进入3个不同臂为1次。最大轮替次数=自发轮替次数-2;自发轮替行为百分比=自发轮替次数/最大轮替次数×100%。动物自发轮替行为比例较高时被认为具有较好的空间工作记忆能力。(2)Morris水迷宫测试:于建模后14 d、28 d行Morris水迷宫定位航行测试。将小鼠放置于Morris水迷宫系统(直径90 cm、高60 cm的圆形不锈钢水池+深度为30 cm的无毒不透明液体)中,将圆形水池平均分为4个象限,在其中1个象限中央放置1个圆柱形隐藏平台,小鼠随机从水池的4个入水点头朝池壁入水,任其游泳,直到找到平台,小鼠找到平台的时间和轨迹由水池上方的摄像机记录,每次试验后将小鼠烘干并休息20 min后进行下一次实验;记录小鼠每次寻找平台的逃避潜伏期。
1.4.2 脑组织BDNF表达 造模后14 d行为学评估后,于麻醉下取小鼠脑组织,分离伤侧前额叶皮层和海马结构,按试剂盒操作流程提取蛋白液,BCA法测定蛋白浓度并配平。行经SDS-PAGE电泳,并将蛋白转至PVDF膜。封闭抗体后,加入抗BDNF、抗GAPDH (1∶500) 4 ℃孵育过夜孵育,漂洗后加入辣根过氧化物酶(HRP) 标记的二抗 (1∶500) 孵育2 h。使用ECL化学发光底物显影。以假手术组BDNF/GAPDH灰度比为1,计算其他各组条带相对灰度比。
1.4.3 海马区神经元凋亡 于建模后7 d麻醉小鼠后制备脑组织冰冻切片,采用TUNEL法进行检测。常规行脱蜡、复水和抗原修复处理,使用TUNEL试剂盒,PBST溶液洗脱玻片(3次、10min/次),滴加核染色剂,室温下处理5 min;PBST溶液洗脱,滴加抗荧光衰减液5 μL,封片;荧光显微镜观察并拍照。
1.5 统计学分析
2 结果
2.1 各组小鼠神经行为学比较
在Y型迷宫试验中,与假手术组比较,手术对照组小鼠造模后7~14 d自发轮替行为百分比减少(P<0.05)。与手术对照组小鼠相比,丁苯酞处理组1小鼠在7~14 d时自发轮替行为百分比有一定上升,但差异无统计学意义;丁苯酞处理组2小鼠自发轮替行为百分比上升,差异有统计学意义(P<0.05)。两丁苯酞处理组间比较,组2小鼠14 d时自发轮替行为百分比高于组1 (P<0.05)。见图1。
在Morris水迷宫试验中,与假手术组比较,手术对照组小鼠造模后7~14 d逃避潜伏时间延长(P<0.05)。与手术对照组小鼠相比,丁苯酞处理组1小鼠在14 d时逃避潜伏时间延长(P<0.05),但在28 d时差异无统计学意义(P>0.05);丁苯酞处理组2小鼠在14 d及28 d时均低于手术对照组 (P<0.05)。见图2。
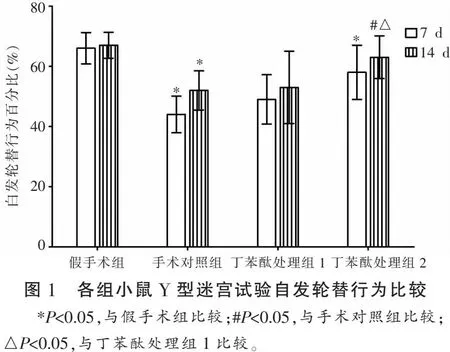
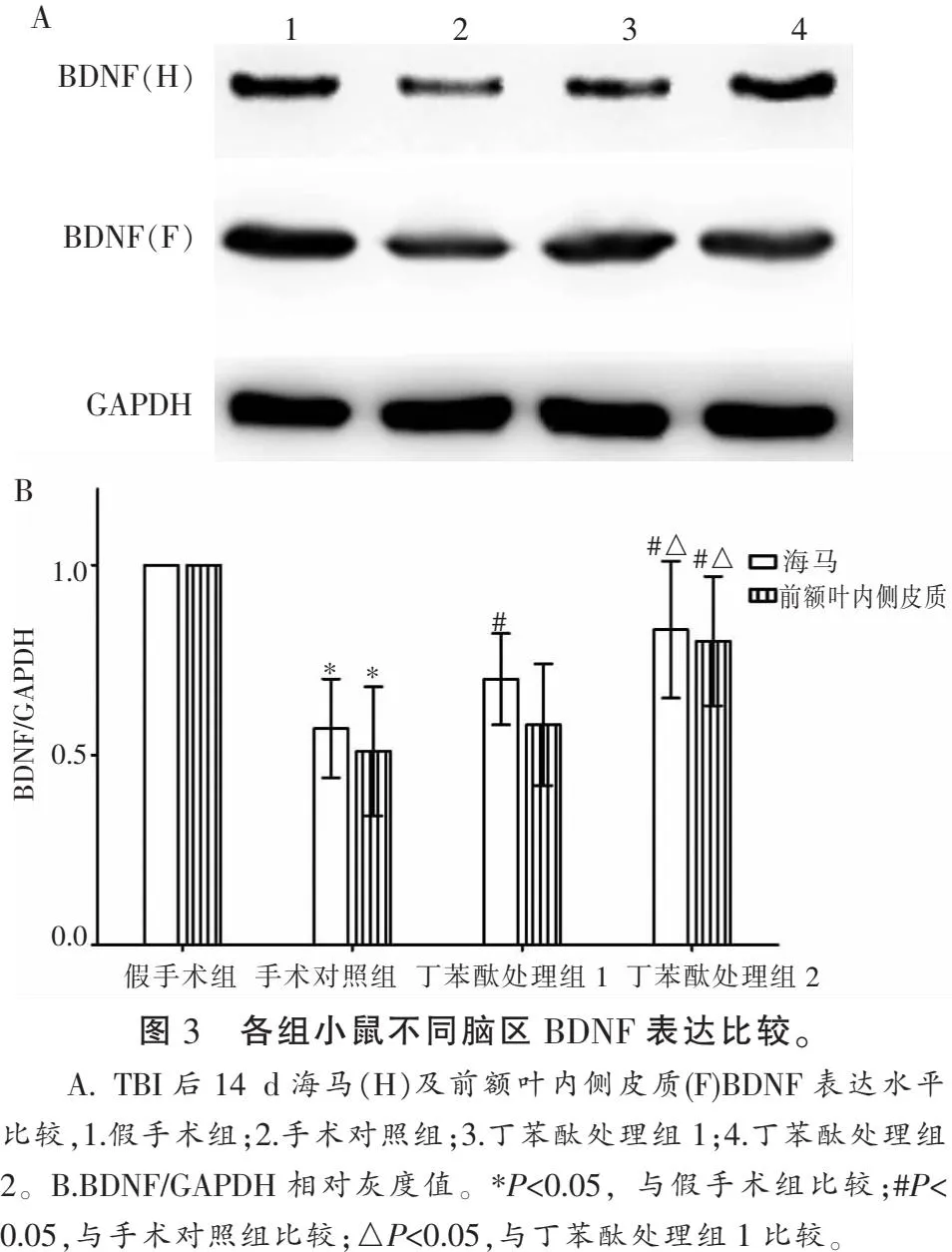
2.2 各组小鼠海马和前额叶内侧皮质BDNF表达比较
TBI后14 d,小鼠海马及额叶前内侧皮质均下调(P<0.05)。与手术对照组相比,丁苯酞处理组1小鼠海马BDNF表达水平上调(P<0.05);丁苯酞处理组2小鼠海马及前额叶内侧皮质BDNF表达水平上调(P<0.05)。两丁苯酞处理组间比较,组2小鼠前额叶内侧皮质BDNF上调高于组1(P<0.05)。见图3。
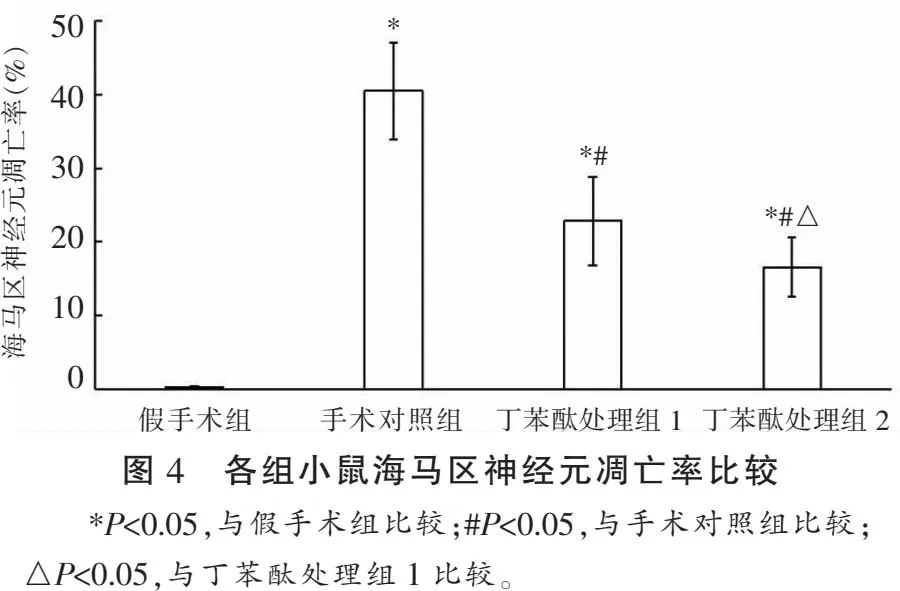
2.3 各组小鼠海马区神经元凋亡情况比较
TBI后7 d,各组小鼠海马区神经元凋亡率比较:假手术组<丁苯酞处理组2<丁苯酞处理组1<手术对照组,差异有统计学意义(P<0.05)。见图4。
3 讨论
颅脑损伤的发生与外部因素作用于脑组织造成的神经系统损伤有关,轻度颅脑损伤患者的神经功能可在短时间内恢复,但受临床症状不明显、影像学表现不典型、治疗延误等因素的影响,部分患者可能出现伤后远期神经退行性变和认知功能障碍,影响患者整体预后,需要引起更多的关注。
丁苯酞是指南[7-8]推荐的神经保护剂,可通过上调NF-E2相关因子2(Nrf-2)/血红素氧合酶1信号通路表达及其他多种机制,对脑损伤大鼠起到神经保护作用。本研究通过构建小鼠颅脑损伤模型,探讨了丁苯酞对脑外伤后认知障碍的保护作用。研究显示,实验小鼠脑组织在遭受外力打击后,出现明显的空间记忆功能损伤,表现为Morris水迷宫试验逃避潜伏时间延长和Y型迷宫试验自发轮替行为减少。丁苯酞干预对这些指标具有改善作用,并至少可持续至颅脑损伤后28 d,提示其在脑外伤后急性期及亚急性期对认知功能受损具有保护作用。
据报道[9]丁苯酞可靶向调控Kelch样环氧氯丙烷相关蛋白1(Keap-1),抑制Keap-1与Nrf-2的相互作用,激活细胞抗氧化活性,减轻氧化应激损伤,发挥脑保护作用。刘俊等[10]研究发现,丁苯酞可通过降低大鼠脑组织炎症因子的表达改善脑水肿状态;Wang等[11]也发现,丁苯酞在脑震荡性脑损伤中可明显降低脑组织含水率,具有较好的脑保护作用。这些机制可能是丁苯酞在脑损伤急性期发挥神经保护作用的机制。
BDNF做为内源性神经保护剂,参与了神经细胞修复和神经功能恢复。颅脑损伤后BDNF可促进神经细胞再生和神经网络重建,减轻继发性损伤的影响[12-13]。本研究发现,小鼠颅脑损伤后14 d,海马及前额叶内侧皮质BDNF表达有明显下调,这可能是外伤的直接影响,并进一步延缓外伤后神经修复。外源性补充BDNF难以通过血脑屏障发挥作用,而丁苯酞干预能明显上调海马及前额叶内侧皮质BDNF的表达、促进内源性BDNF功能,一般认为这两个脑区与学习认知密切相关,因此这可能是丁苯酞发挥脑保护作用的机制之一。本研究发现,与假手术组比,手术对照组、丁苯酞处理1组和2组的神经元凋亡率明显升高;与手术对照组比,丁苯酞处理1组和2组的神经元凋亡率明显降低,这从组织细胞层面表明,丁苯酞可降低颅脑损伤后神经元的凋亡,从而对神经功能起到保护作用。一项有关丁苯酞对脑瘫大鼠海马神经元凋亡的影响的研究[14]发现,丁苯酞可能通过介导磷脂酰肌醇-3激酶/蛋白激酶B信号通路,调控B细胞淋巴瘤-2相关蛋白表达,抑制海马神经元凋亡,促进神经功能康复。但颅脑损伤后,丁苯酞影响神经元凋亡的具体机制仍有待进一步明确。
综上,丁苯酞可改善小鼠TBI后空间记忆功能,对认知损伤具有一定的神经保护作用,上调海马及前额叶内侧皮质BDNF表达及抑制海马区神经元的凋亡可能是其潜在机制。
