miRNA-182、miRNA-200c 和胃蛋白酶原Ⅰ/胃蛋白酶原Ⅱ单独及联合检测对胃癌的诊断价值△
2024-04-07屠俊标魏萍萍叶施雨黄耀
屠俊标,魏萍萍,叶施雨,黄耀
上海市静安区中心医院1 检验科,2 消化内科,上海 200040
胃癌是消化系统最常见的恶性肿瘤,其发病率和病死率均居消化系统恶性肿瘤首位[1]。目前,胃癌患者中晚期所占比例较高,且呈不断升高趋势[2],胃癌的治疗效果较差,因此早期诊断对提高胃癌患者的生存率、改善生活质量尤为重要。有研究发现,微小RNA(microRNA,miRNA)是一种产生于生物体内、具有内源性特征、非编码单链形式的小分子RNA,普遍参与多种肿瘤的发生发展过程,是诊断多种早期肿瘤的标志物[3]。在人胃癌细胞内,miRNA-182 表达水平明显高于正常胃上皮细胞,且miRNA-182 表达水平与胃癌大小、淋巴结转移情况及临床分期密切相关[4]。而miRNA-200c 在胃癌患者血清中水平明显升高,且有学者发现,胃癌细胞中miRNA-200c 水平与上皮-间充质转化及淋巴结转移密切相关[5]。此外,胃蛋白酶原(pepsinogen,PG)是一种胃蛋白酶前体,包括PGⅠ和PGⅡ两种。PGⅠ多由胃底腺的主细胞及黏液颈细胞产生,PGⅡ除可由胃底腺的主细胞和黏液颈细胞分泌外,还可以由幽门腺的黏液颈细胞和十二指肠腺上段分泌。大部分PG 会运转至胃腔,但也有少量的PG 会经过胃黏膜毛细血管转运至血液,因此,PG 能够通过血清进行检测。当胃黏膜病变时,PG 分泌会受到影响,PGⅠ/PGⅡ可间接反映胃黏膜的萎缩程度[6]。因此,深入研究miRNA-182、miRNA-200c 和PGⅠ/PGⅡ在胃癌诊断中的作用不仅有助于胃癌的早期诊断,还可以用来制订新的有效治疗策略以及评估胃癌患者的预后。本研究探讨miRNA-182、miRNA-200c 和PGⅠ/PGⅡ单独及联合检测对胃癌的诊断价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2022 年1—12 月上海市静安区中心医院收治的胃癌患者。纳入标准:①符合《胃癌规范化综合诊疗手册》[7]中关于胃癌的诊断标准,经病理学检查确诊为胃癌;②临床资料完整;③年龄﹥18岁。排除标准:①合并其他恶性肿瘤;②既往接受过其他抗肿瘤治疗;③既往诊断为胃癌,再次入院治疗;④检测血清miRNA-182、miRNA-200c、PGⅠ、PGⅡ水平时已接受过胃癌切除手术。依据纳入和排除标准,本研究共纳入65 例胃癌患者,作为观察组。选取同期在上海市静安区中心医院进行健康体检的61 例健康者,作为对照组。观察组中,男36 例,女29 例;平均年龄(56.39±14.93)岁;平均身高(173.26±16.36)cm;平均体重(78.63±9.03)kg;肿瘤部位:胃体32 例,胃窦33 例。对照组中,男25 例,女36 例;平均年龄(55.94±13.79)岁;平均身高(168.86±15.61)cm;平均体重(76.56±8.62)kg。两组受试者性别、年龄、身高、体重比较,差异均无统计学意义(P﹥0.05),具有可比性。本研究经医院伦理委员会批准通过,所有患者均知情同意。
1.2 逆转录聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)检测miRNA-182、miRNA-200c 水平
抽取两组受试者血清,2000 r/min 离心15 min,取上层血清-80 ℃保存待检。取-80 ℃冻存血清冰上融化后,3000 r/min 离心3 min,采用miRNeasy Serum/Plasma Kit 提取总RNA:吸取200 μl血清,加5 倍体积QIAzol 振荡,室温静置5 min,加氯仿剧烈振荡1 min,室温静置3 min 后4 ℃离心15 min。转移上层水相600 μl,加入1.5 倍体积的100%乙醇,剧烈振荡1 min。加入14 μl 超纯水,2000 r/min 离 心3 min,收集洗脱 液RNA[8]。将-20 ℃的试剂、RNA 模板在室温环境中溶解,并调配均匀,将调配好的混合液4000 r/min 离心3 min,42 ℃培育箱中培育2 min,室温中冷却[9],合成互补DNA(complementary DNA,cDNA),在85 ℃培育箱中培育,5 min 后备用,室温溶解并进一步有效混合后进行后续的两步法PCR:95 ℃10 min;95 ℃15 s,45~72 ℃1 min,40 个循环。以U6为内参,采用2-△△Ct法计算miRNA-182、miRNA-200c 水平[10]。U6上游引物为5'-GCTTCGGCAGCACATATACTAAAAT- 3',下游引物为 5'-CGCTTCACGAATTTGCGTGTCAT-3';miRNA-182上游引物为5'-UCACACUCAAGAUGGUAACGGUUU-3',下游引物为5'-AGUGUGAGUUCUACCAUUGCCAAA-3';miRNA-200c 上游引物 为5'-AGGUAGUAAUGGGCCGUCAUAAU-3',下游 引物为5'-UCCAUCAUUACCCGGCAGUAUUA-3'。
1.3 PGⅠ、PGⅡ水平检测[11]
抽取两组受试者清晨空腹静脉血3 ml,采用酶联免疫吸附试验检测血清PGⅠ、PGⅡ水平,并计算PGⅠ/PGⅡ。
1.4 统计学方法
采用SPSS 26.0 软件对所有数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC),评估miRNA-182、miRNA-200c、PGⅠ/PGⅡ单独及联合检测对胃癌的诊断价值;以P﹤0.05 为差异有统计学意义。
2 结果
2.1 miRNA-182、miRNA-200c 水平的比较
观察组患者血清miRNA-182、miRNA-200c 水平均明显高于对照组,差异均有统计学意义(P﹤0.01)。(表1)
表1 两组受试者血清miRNA-182、miRNA-200c 水平的比较(±s)
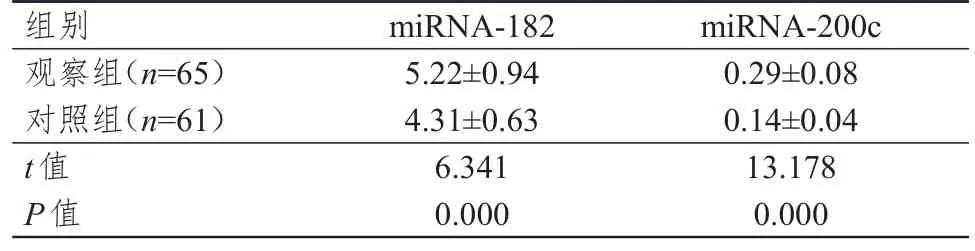
表1 两组受试者血清miRNA-182、miRNA-200c 水平的比较(±s)
组别观察组(n=65)对照组(n=61)t值P值miRNA-182 5.22±0.94 4.31±0.63 6.341 0.000 miRNA-200c 0.29±0.08 0.14±0.04 13.178 0.000
2.2 血清PGⅠ、PGⅡ水平及PGⅠ/PGⅡ的比较
观察组患者血清PGⅠ水平和PGⅠ/PGⅡ均低于对照组,PGⅡ水平高于对照组,差异均有统计学意义(P﹤0.05)。(表2)
表2 两组受试者血清PGⅠ、PGⅡ水平及PGⅠ/PGⅡ的比较(±s)

表2 两组受试者血清PGⅠ、PGⅡ水平及PGⅠ/PGⅡ的比较(±s)
组别观察组(n=65)对照组(n=61)t值P值PGⅠ(ng/ml)37.46±2.24 57.81±2.66 46.552 0.000 PGⅡ(ng/ml)13.17±3.13 11.93±2.27 2.532 0.013 PGⅠ/PGⅡ3.31±0.51 4.64±0.87 12.712 0.000
2.3 miRNA-182、miRNA-200c、PGⅠ/PGⅡ单独及联合检测对胃癌的诊断价值
ROC 曲线显示,miRNA-182、miRNA-200c、PGⅠ/PGⅡ联合检测诊断胃癌的AUC 为0.829(95%CI:0.633~0.859),高于各指标单独检测的0.650、0.722、0.818,此时的灵敏度为0.825,特异度为0.890(表3、图1)。miRNA-182、miRNA-200c、PGⅠ/PGⅡ单独及联合检测诊断胃癌的模型质量评价见图2,﹥0.5 表示该模型的预测价值良好,≤0.5 表示该模型的预测价值并不优于随机预测。
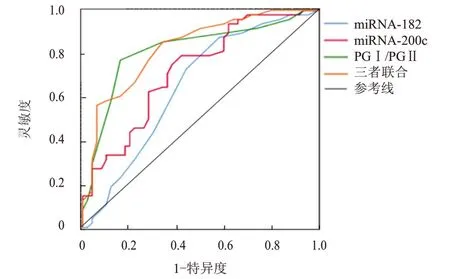
图1 miRNA-182、miRNA-200c、PGⅠ/PGⅡ单独及联合检测诊断胃癌的ROC曲线

图2 miRNA-182、miRNA-200c、PGⅠ/PGⅡ单独及联合检测诊断胃癌的模型质量评价图

表3 miRNA-182、miRNA-200c、PGⅠ/PGⅡ单独及联合检测对胃癌的诊断价值
3 讨论
胃癌是常见的恶性肿瘤之一,中国胃癌发病率和病死率均居所有消化系统恶性肿瘤首位[12],因此,多数研究者认为,早期对胃癌进行诊断十分必要,可以有效预防胃癌进展或复发。胃癌筛查可以有效提高早期诊断率,从而给予早期治疗,以改善患者预后和生活质量。
既往临床诊断肿瘤以检测肿瘤标志物的表达情况为主,但临床实际工作发现,通过检测肿瘤标志物的表达水平来诊断肿瘤存在诸多不足[13]。miRNA 在细胞分化、细胞周期及凋亡过程中发挥着多种生物学功能,同时也可参与伤口愈合、调节免疫系统功能。此外,miRNA 在表达谱上包含组织特异性的特点,部分肿瘤组织中可以存在明显不同的miRNA,因此,对于肿瘤诊断及预后评估的价值较高。目前,研究发现,健康者血清中检测的miRNA,与肿瘤患者血清中的miRNA 有明显不同的表达谱,因此,检测血清中的miRNA 或许是更加准确的肿瘤诊断方法。
有研究发现,miRNA-182 能够抑制cAMP 反应元件结合蛋白1(cAMP responsive element binding protein 1,CREB1)基因的表达从而抑制胃癌细胞的增殖[14]。周怿等[15]通过RT-PCR 检测miRNA-182的表达水平发现,胃癌组织中miRNA-182 的表达水平较高,且存在淋巴结转移胃癌患者胃癌组织中miRNA-182 的表达水平更高,表明miRNA-182可发挥原癌基因的作用,能够导致胃癌发生及转移。miRNA-200c 可通过靶向调控DNA 甲基转移酶3β(DNA methyltransferase 3β,DNMT3B)的表达抑制胃癌细胞生长和增殖。研究显示,miRNA-200c 可直接调控DNMT3B基因的表达,蛋白质印迹法(Western blot)检测发现,miRNA-200c 升高能够抑制DNMT3B 蛋白的表达,从而减少胃癌细胞的生长和增殖[16-17]。本研究结果显示,观察组血清miRNA-182、miRNA-200c 水平均明显高于对照组,差异均有统计学意义(P﹤0.01),表明miRNA-182、miRNA-200c 可能在胃癌发生发展过程中发挥重要作用。
本研究ROC 曲线显示,miRNA-182、miRNA-200c 诊断胃癌的AUC 分别为0.650、0.722,提示其水平升高可能与胃癌的发生发展有关。miRNA-182、miRNA-200c 可一定程度上影响抑癌基因和转录因子的表达,从而发挥调控胃癌发生发展的生物学作用,故检测miRNA-182、miRNA-200 水平,可为胃癌患者选择更优的治疗方案提供参考,并成为评估胃癌患者预后的有效生物标志物。
天冬氨酸蛋白酶可于酸性状态下被激活,转变为PG 并发挥促消化作用[18],而部分PG 经过胃黏膜毛细血管的转运最终到达血液,因此,PG 能够通过血清进行检测。本研究结果显示,观察组患者血清PGⅠ水平和PGⅠ/PGⅡ均低于对照组,PGⅡ水平高于对照组,差异均有统计学意义(P﹤0.05)。慢性萎缩性胃炎是进展为胃癌的重要阶段,研究显示,80%以上的胃癌患者伴有萎缩性胃炎,大多数肠型胃癌可从慢性萎缩性胃炎进展至肠化生,随之进展为不典型增生,最终进展为胃癌[19]。胃黏膜严重萎缩时,胃体腺和胃底腺的数量会随之降低,幽门腺会有所升高,可使PGⅠ水平降低,而PGⅡ水平变化不明显甚至可能会有所增加,因此,PGⅠ/PGⅡ可能会存在一定程度的降低。此外,胃癌导致的胃黏膜损伤和炎症反应,加之幽门螺杆菌感染、药物等,也导致了PG 分泌失衡,导致PGⅠ/PGⅡ升高。
本研究ROC 曲线显示,PGⅠ/PGⅡ诊断胃癌的AUC 为0.818,表明PGⅠ/PGⅡ对胃癌的诊断效能较高,可能是一个较为敏感和特异的胃癌诊断标志物。这可能是因为胃癌的刺激使机体发生免疫反应,使胃黏膜发生炎症、萎缩、癌变等,导致血清PG 水平发生了改变。PGⅠ/PGⅡ可以反映胃黏膜功能和状态,由于胃癌患者胃黏膜受损严重,导致PGⅠ分泌减少,而PGⅡ水平相对稳定或增加,导致PGⅠ/PGⅡ降低,这也在一定程度上使PGⅠ/PGⅡ在诊断胃癌时具有较高的灵敏度和特异度,从而提高了AUC。MiKi[20]的研究发现,PGⅠ水平及PGⅠ/PGⅡ降低能够作为胃癌患者的诊断标志物。还有研究表明,胃癌患者PGⅠ水平降低会被幽门腺或肠上皮化生逆转,因此,胃癌患者血清中PGⅠ水平降低,但产生PGⅡ的腺体增多,PGⅡ水平变化不明显甚至可能有所升高,最终PGⅠ/PGⅡ明显降低,其诊断胃癌具有很高的诊断价值[21]。
本研究结果显示,miRNA-182、miRNA-200c、PGⅠ/PGⅡ联合检测诊断胃癌的AUC 为0.829(95%CI:0.633~0.859),高于各指标单独检测,此时的灵敏度为0.825,特异度为0.890,表明三者联合检测进一步提高了胃癌的诊断价值。这可能是因为虽然PGⅠ/PGⅡ单独检测诊断胃癌的AUC 较高,但PGⅠ/PGⅡ失衡也常见于胃炎、胃溃疡、幽门螺杆菌感染等疾病,三者联合检测可进一步提高诊断准确度。
综上所述,miRNA-182、miRNA-200c、PGⅠ/PGⅡ联合检测对胃癌的诊断价值更高,或可作为胃癌诊断的有效指标。
