转化生长因子-β1、胰岛素样生长因子-1 在食管癌组织中的表达及与患者临床特征和预后的关系△
2024-04-07姜琨荆琼珊刘争李文海
姜琨,荆琼珊,刘争,李文海
西安国际医学中心医院1 胸腔外科,2 消化内镜中心,3 麻醉手术中心,西安 710061
食管癌是发生于食管、来源于食管上皮细胞的恶性肿瘤。食管癌起病隐匿,早期症状不明显,随着肿瘤的不断浸润,肿瘤细胞会逐渐扩散至食管壁,超出范围后,还可能继续侵犯邻近器官。数据显示,全球每年食管癌病死例数约30 万例,中国是食管癌高发国家,食管癌发病率及病死率均居全球第五位[1]。食管癌的发生发展受多种因子的调控,SMAD 蛋白是转化生长因子-β(transforming growth factor-β,TGF-β)信号通路的下游因子,而TGF-β信号通路在肿瘤发生发展过程中有一定作用[2]。TGF-β1 可使肿瘤细胞更容易浸润和转移,且其受体发生基因突变也是引发癌变的一个原因[3]。胰岛素样生长因子(insulin-like growth factor,IGF)-1 由生长激素调控,是雷帕霉素靶蛋白(mechanistic target of rapamycin kinase,MTOR)通路的上游因子,IGF 通路可被白细胞介素-6(interleukin-6,IL-6)和核因子κB(nuclear factor-κB,NF-κB)激活,大量的IGF 可促进肿瘤细胞增殖[4]。大部分肿瘤的发生发展会受到IGF-1 的影响,如肺癌、肝癌及卵巢癌等,但目前临床对食管癌的研究较少[5]。基于此,本研究探讨TGF-β1、IGF-1 在食管癌组织中的表达及与患者临床特征和预后的关系,现报道如下。
1 资料与方法
1.1 一般资料
选取2020 年1 月至2023 年1 月西安国际医学中心医院收治的食管癌患者。纳入标准:①年龄≥18 岁;②经病理学检查确诊为食管癌;③术前未行化疗、放疗等;④临床资料及随访资料完整。排除标准:①意识模糊,不能正常交流;②合并其他恶性肿瘤。依据纳入和排除标准,本研究共纳入81例食管癌患者,其中男59 例,女22 例;年龄38~76岁,平均(56.16±10.23)岁;国际抗癌联盟(Union for International Cancer Control,UICC)TNM 分期:Ⅰ~Ⅱ期45 例,Ⅲ~Ⅳ期36 例;浸润深度:T1~234例,T3~447 例;淋巴结转移44 例,无淋巴结转移37例。本研究经医院伦理委员会批准通过,所有患者均知情同意。
1.2 免疫组化法检测TGF-β1、IGF-1 蛋白的表达情况
取81 例食管癌患者的食管癌组织及相应癌旁组织(距肿瘤组织﹥5 cm),均经4%多聚甲醛固定,石蜡包埋,连续切片,厚度为4 μm,采用抗原修复。采用免疫组化链霉抗生物素蛋白-过氧化物酶(streptavidin-peroxidase,SP)法检测TGF-β1、IGF-1 蛋白的表达情况,全部操作过程严格按照说明书进行。采用0.01 mol/L 磷酸盐缓冲液(phosphate buffered solution,PBS)作为阴性对照,用已知阳性切片作为阳性对照。二氨基联苯胺(diaminobenzidine,DAB)显色,梯度乙醇脱水,二甲苯透明,苏木素复染,中性树胶封片,观察结果。
结果判定[6]:TGF-β1 主要定位于细胞质,IGF-1主要定位于细胞质和细胞膜。每张切片随机观察5 个高倍视野,每个视野计数细胞,取平均值。采用半定量积分法进行评分,阳性细胞所占比例﹤5%且与背景色一致为阴性(-),阳性细胞所占比例为5%~10%且呈淡黄色染色为弱阳性(+),阳性细胞所占比例为11%~50%且呈黄色染色为中等阳性(++),阳性细胞所占比例﹥50%且呈黄褐色或深棕色染色为强阳性(+++),(-)(+)判定为阴性表达,(++)(+++)判定为阳性表达。
1.3 观察指标
①比较食管癌组织和癌旁组织中TGF-β1、IGF-1 的表达情况。②分析TGF-β1、IGF-1 表达与食管癌组织浸润深度及淋巴结转移的关系。③采用到院复查的方式对所有食管癌患者进行为期6个月的随访,发生转移或死亡判定为预后不良,反之为预后良好,比较预后良好与预后不良食管癌患者的临床特征,包括年龄、性别、TNM 分期、分化程度、病理类型、浸润深度、淋巴结转移情况、TGF-β1 表达情况、IGF-1 表达情况。④评估食管癌患者预后不良的影响因素。
1.4 统计学方法
采用SPSS 22.0 软件对所有数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;食管癌患者预后不良的影响因素采用多因素Logistic 回归模型分析;以P﹤0.05为差异有统计学意义。
2 结果
2.1 食管癌组织和癌旁组织中TGF-β1、IGF-1 表达情况的比较
食管癌组织TGF-β1、IGF-1 的阳性表达率均明显高于癌旁组织,差异均有统计学意义(P﹤0.01)。(表1)

表1 食管癌组织和癌旁组织中TGF-β1、IGF-1 表达情况的比较[n(%)]
2.2 不同浸润深度及淋巴结转移情况食管癌患者食管癌组织中TGF-β1、IGF-1 表达情况的比较
浸润深度为T3~4、发生淋巴结转移的食管癌患者食管癌组织中TGF-β1 的阳性表达率分别明显高于浸润深度为T1~2、未发生淋巴结转移的患者,差异均有统计学意义(χ2=19.909、20.555,P﹤0.01)。浸润深度为T3~4、发生淋巴结转移的食管癌患者食管癌组织中IGF-1 的阳性表达率分别明显高于浸润深度为T1~2、未发生淋巴结转移的患者,差异均有统计学意义(χ2=18.179、11.072,P﹤0.01)。(表2)
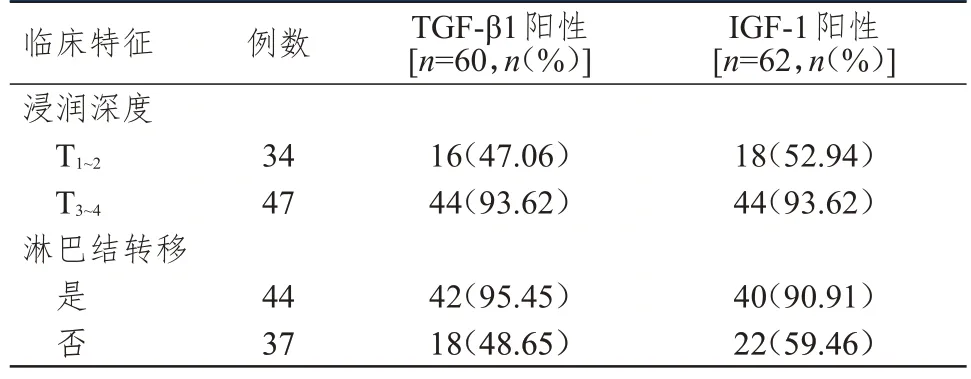
表2 不同浸润深度及淋巴结转移情况食管癌患者食管癌组织中TGF-β1、IGF-1 的表达情况
2.3 食管癌患者预后不良影响因素的单因素分析
随访6 个月,81 例食管癌患者中,预后良好68例,预后不良13 例。预后良好与预后不良患者的年龄、性别、分化程度、病理类型比较,差异均无统计学意义(P﹥0.05);预后良好与预后不良患者的TNM 分期、浸润深度、淋巴结转移情况、TGF-β1表达情况、IGF-1 表达情况比较,差异均有统计学意义(P﹤0.05)。(表3)

表3 食管癌患者预后不良影响因素的单因素分析
2.4 食管癌患者预后不良影响因素的多因素分析
将单因素分析中差异有统计学意义的TNM分期、浸润深度、淋巴结转移情况、TGF-β1 表达情况、IGF-1 表达情况作为自变量,食管癌患者的预后作为因变量,纳入多因素Logistic 回归分析,结果显示,TNM 分期为Ⅲ~Ⅳ期、浸润深度为T3~4、发生淋巴结转移、TGF-β1 阳性表达、IGF-1 阳性表达均是食管癌患者预后不良的独立危险因素(P﹤0.05)。(表4)
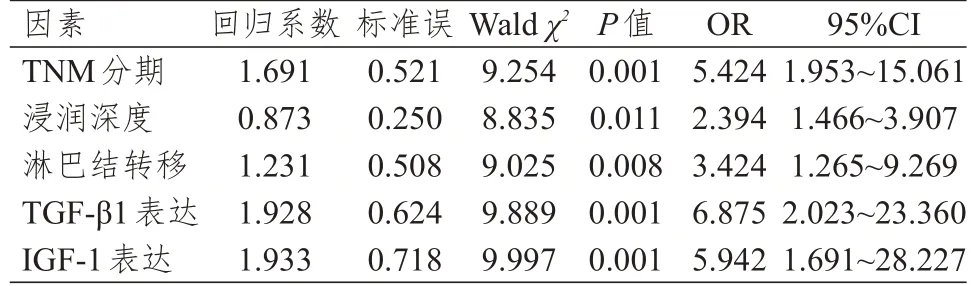
表4 食管癌患者预后不良影响因素的多因素Logistic 回归分析
3 讨论
TGF-β1 属于TGF-β超家族成员,在多种恶性肿瘤中发挥重要的生物学作用,特别是在调节细胞生长、分化、凋亡及免疫应答等方面,如具有抑制免疫细胞增殖及淋巴细胞分化等作用,且上述作用对肿瘤细胞的发生发展具有促进作用[7]。TGF-β1 在调节细胞免疫和肿瘤微环境时,能够促进肿瘤细胞的浸润和转移。TGF-β1 是TGF-β的亚型,其在细胞生长分化、细胞外基质形成、免疫调节、新生血管生成、细胞凋亡以及肿瘤发生发展过程中发挥着重要的调节作用。在生理条件下,TGF-β1 可有效抑制细胞生长,其中也包括肿瘤细胞,其具体机制是通过调节相关基因的表达,使细胞增殖处于休眠状态;但在肿瘤早期,TGF-β1 可通过阻断细胞有丝分裂来抑制肿瘤细胞增殖[8]。但当肿瘤进展至不可控阶段(指肿瘤已经不能被局部控制并开始向周围组织或远处器官扩散)时,TGF-β1 无法抑制多数肿瘤细胞的增殖,且此时的肿瘤细胞会也分泌TGF-β1[9],其通过上调微小RNA(microRNA,miRNA)的表达促进新生血管生成,从而提高肿瘤细胞与细胞黏附分子的结合能力,有利于增强肿瘤细胞的侵袭能力,为肿瘤细胞的生长转移创造良好的微环境[10]。此外,肿瘤进展至不可控阶段时,TGF-β1 还可诱导肿瘤细胞周围的正常细胞凋亡,从而消除其对肿瘤生长的抑制作用[11]。研究发现,TGF-β1 可在多种肿瘤晚期转化为促癌因子,促进肿瘤细胞转移,如食管癌、口腔癌等肿瘤发生远处转移均可能与TGF-β1的表达有关[12-13]。
IGF-1 是一种生长调节剂,能促进细胞增殖和分化,加速细胞周期进程。研究显示,IGF-1 能够抑制肿瘤细胞凋亡,进而发展为肿瘤,多种肿瘤细胞需要IGF-1 来维持其生长和增殖[14]。IGF-1 受体是在细胞质膜中发现的受体酪氨酸激酶,可介导IGF-1 促进肿瘤细胞生长和增殖。有研究发现,早期食管癌中IGF-1 表达水平较低,随着肿瘤进展及转移,IGF-1 水平可明显升高[15]。同时IGF-1 是人体内重要的细胞有丝分裂促进剂,当IGF-1 水平上升时,肿瘤细胞的增殖和转移能力增强,肿瘤进展加快[16]。
本研究结果显示,食管癌组织TGF-β1、IGF-1的阳性表达率均明显高于癌旁组织;浸润深度为T3~4、发生淋巴结转移食管癌患者食管癌组织中TGF-β1、IGF-1 的阳性表达率分别明显高于浸润深度为T1~2、未发生淋巴结转移患者,差异均有统计学意义(P﹤0.01)。提示在食管癌发生发展过程中,TGF-β1、IGF-1 呈阳性表达,可促进食管癌细胞浸润转移。这可能是因为TGF-β1 主要经促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)通路调节细胞的迁移和侵袭,IGF-1则通过结合其受体激活多种肿瘤信号,使肿瘤细胞浸润转移。同时本研究结果显示,TGF-β1 阳性表达、IGF-1 阳性表达均是食管癌患者预后不良的独立危险因素,与既往研究结果相似[17]。表明TGF-β1 及IGF-1 表达与食管癌患者的预后有关,对于判定食管癌患者的预后具有一定的应用价值。
综上所述,食管癌组织中TGF-β1、IGF-1 的阳性表达率较高,其表达与浸润深度及淋巴结转移情况密切相关,且是食管癌患者预后不良的独立危险因素。
