血清甲状腺激素水平与不同肿瘤转移的相关性分析△
2024-04-07那琬琳王艳艳彭晶晶江忠勇许宏宣刘媛常凯
那琬琳,王艳艳,彭晶晶,江忠勇,许宏宣,刘媛,常凯#
中国人民解放军西部战区总医院1 检验科,2 肿瘤科,成都 610083
3 成都市第七人民医院/成都医学院附属肿瘤医院检验科,成都 610041
4 成都市实验外国语学校生物教学与研究组,成都 611134
甲状腺激素(thyroid hormone,TH)是由甲状腺滤泡上皮细胞产生的重要生理激素,参与多个生理过程并发挥着重要作用,其中主要包括新陈代谢(氧化产能、糖脂蛋白代谢、细胞渗透压)调节[1-2]、生长发育(促生长、促变态反应、促进性成熟)调节[3]、免疫系统调控和神经发育[4-5]等。流行病学调查发现,低促甲状腺素(thyroid stimulating hormone,TSH)增加了结肠癌、肺癌、前列腺癌的发病风险,并提示了TH 与肿瘤的发生存在量效关系[6]。TH 的生物活性取决于细胞内三碘甲腺原氨酸(triiodothyronine,T3)异碘化酶催化产物D1 和D2 或降解产物D3。TH 活性产物在不同肿瘤中的表现不尽相同,如肾癌、肺癌组织中D1 低表达而乳腺癌则相反,不同类型脑肿瘤中D2 的表达也明显不同[7]。在有关TH 对原发性肝癌影响的研究中发现,TH 中T3具有明显抑制肝癌进展的作用,但TH 对耐药的肝癌细胞具有促进转移作用[8]。以上研究提示TH 在肿瘤发生发展中具有重要作用,且TH 具有抗肿瘤潜质[9],但缺乏系统性分析总结,且作用机制尚未清楚,导致TH 在肿瘤诊疗中的应用价值尚未有效发挥。本研究探讨不同类型及转移情况肿瘤中TH[TSH、T3、甲状腺素(thyroxine,T4)、游离三碘甲腺原氨酸(free triiodothyronine,FT3)、游离甲状腺素(free thyroxine,FT4)]的表达差异,现报道如下。
1 资料与方法
1.1 一般资料
选取2020—2022 年在中国人民解放军西部战区总医院初诊且确诊的健康人和肿瘤患者。纳入标准:既往未发生过原发性甲状腺相关疾病;未服用过抗肿瘤药物,未行放疗;近半年未使用过激素类药物和碘相关制剂;入院时未发生慢性炎症和急性炎症。排除标准:有高血压、糖尿病、冠心病史;有吸烟史;有药物过敏史;有遗传病史。根据纳入、排除标准,本研究共纳入健康人(TH 指标检测正常,B 超显示甲状腺无明显异常的非肿瘤患者)309 例[男171 例,女138 例;平均年龄(47.60±13.33)岁]和肿瘤患者713 例,其中发生转移(近端和远端)的肿瘤患者317 例(表1)。所有肿瘤患者均通过影像学检查和病理学检查确认肿瘤性质和转移情况。本研究经医院伦理委员会批准通过,所有患者均知情同意。
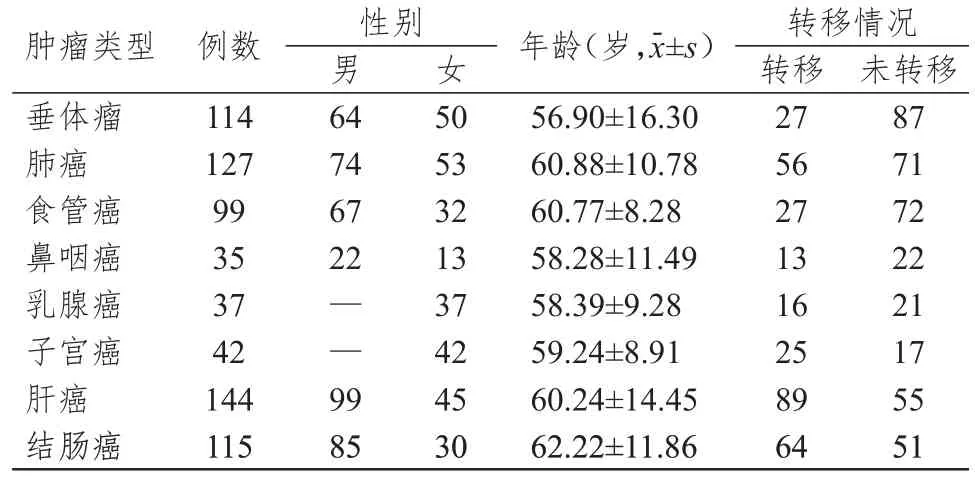
表1 不同肿瘤类型患者的临床特征
1.2 检测方法
所有受试者均于清晨抽取空腹静脉血,采集静脉血5 ml 于分离胶促凝管中,静置10 min后经3000 r/min 离心10 min。分离出血清,采用直接化学发光法检测TSH、FT3、FT4、T3、T4水平。TSH 正常值范围0.55~4.78 mU/L,FT3正常值范围2.38~4.34 pg/ml,FT4正常值范围0.90~1.76 ng/dl,T3正常值范围0.58~1.82 ng/ml,T4正常值范围4.89~11.09 μg/dl。
1.3 统计学分析
采用SPSS 19.0 软件进行统计学分析,正态分布的计量资料以均数±标准差(±s)表示,组间比较采用t检验;非正态分布的计量资料以中位数(四分位数间距)[M(P25,P75)]表示,组间比较采用Wilcoxon 秩和检验;计数资料以例数及率(%)表示,组间比较采用χ2检验;相关性分析采用Pearson 相关分析法;以P﹤0.05 为差异有统计学意义。
2 结果
2.1 不同类型肿瘤患者与健康人各TH指标的比较
肿瘤患者TSH、FT3、FT4、T3水平均明显低于健康人,差异均有统计学意义(P﹤0.01)(表2)。按照不同类型肿瘤统计发现,垂体瘤患者TSH、FT3、FT4、T3、T4,肺癌患者TSH、FT3,食管癌患者FT4、FT3,鼻咽癌患者FT4、FT3,乳腺癌患者FT3,肝癌患者T3、FT3,子宫癌患者FT4、FT3,结肠癌患者TSH、T3、FT3均低于健康人,食管癌患者T4、子宫癌患者TSH 均高于健康人,差异均有统计学意义(P﹤0.05)(表3)。

表2 肿瘤患者与健康人各TH 指标的比较[M(P25,P75)]

表3 不同类型肿瘤患者与健康人各TH 指标的比较[M(P25,P75)]
2.2 不同类型肿瘤转移与未转移患者各TH 指标的比较
在713 例肿瘤患者中,发生转移患者317 例,转移发生率为44.46%。转移与未转移鼻咽癌、乳腺癌、子宫癌、结肠癌患者各TH 指标比较,差异均无统计学意义(P﹥0.05)。转移垂体瘤患者TSH、T4、T3和FT3均低于未转移患者,转移肺癌患者TSH 和FT4均低于未转移患者,转移食管癌患者T4低于未转移患者,转移肝癌患者T4和FT4均低于未转移患者,差异均有统计学意义(P﹤0.05)。(表4)

表4 不同类型肿瘤转移与未转移患者TH 各指标的比较[M(P25,P75)]
2.3 TH 异常表达与转移发生风险的关系
进一步分析TH 异常表达与转移发生风险的关系,结果显示,TSH、T3、T4、FT3异常垂体瘤患者发生转移的风险分别高于TSH、T3、T4、FT3正常的患 者[OR(95%CI)=6.73(2.57~17.62)、6.63(2.56~17.16)、2.92(1.12~7.62)、14.29(4.84~42.20),P﹤0.05],其中FT3风险值最高。TSH 和FT4异常肺癌患者发生转移的风险分别高于TSH 和FT4正常的患 者[OR(95%CI)=5.49(2.12~14.18)、6.78(2.34~19.65),P﹤0.05],其中FT4风险值较高。T4异常食管癌患者发生转移的风险高于T4正常的患者[OR(95%CI)=10.00(3.37~29.60),P﹤0.05]。T4和FT4异常肝癌患者发生转移的风险分别高于T4和FT4正常的患者[OR(95%CI)=4.20(1.70~10.35)、3.37(1.29~8.83),P﹤0.05],其中T4风险值较高。
2.4 不同肿瘤患者TH 指标与脂代谢指标的关系
肿瘤患者总胆固醇(total cholesterol,TC)和低密度脂蛋白(low density lipoprotein,LDL)水平均明显高于健康人,差异均有统计学意义(P﹤0.01);肿瘤患者和健康人甘油三酯(triglyceride,TG)、高密度脂蛋白(high density lipoprotein,HDL)水平比较,差异均无统计学意义(P﹥0.05)(表5)。进一步分析不同类型肿瘤转移和未转移患者脂代谢指标发现,转移垂体瘤、肺癌、食管癌及肝癌患者的TC 和LDL 水平均明显高于未转移患者,差异均有统计学意义(P﹤0.01)(表6)。
表5 健康人与肿瘤患者脂代谢指标的比较(mmol/L,±s)

表5 健康人与肿瘤患者脂代谢指标的比较(mmol/L,±s)
受试者健康人(n=309)肿瘤患者(n=713)t值P值TG 1.20±0.41 1.25±0.63 1.282 0.20 TC 4.75±1.11 5.02±1.23 3.317<0.01 LDL 2.90±0.40 3.33±0.67 10.498<0.01 HDL 1.42±0.29 1.59±0.55 5.132 0.32
表6 不同类型肿瘤转移与未转移患者脂代谢指标的比较(mmol/L,±s)
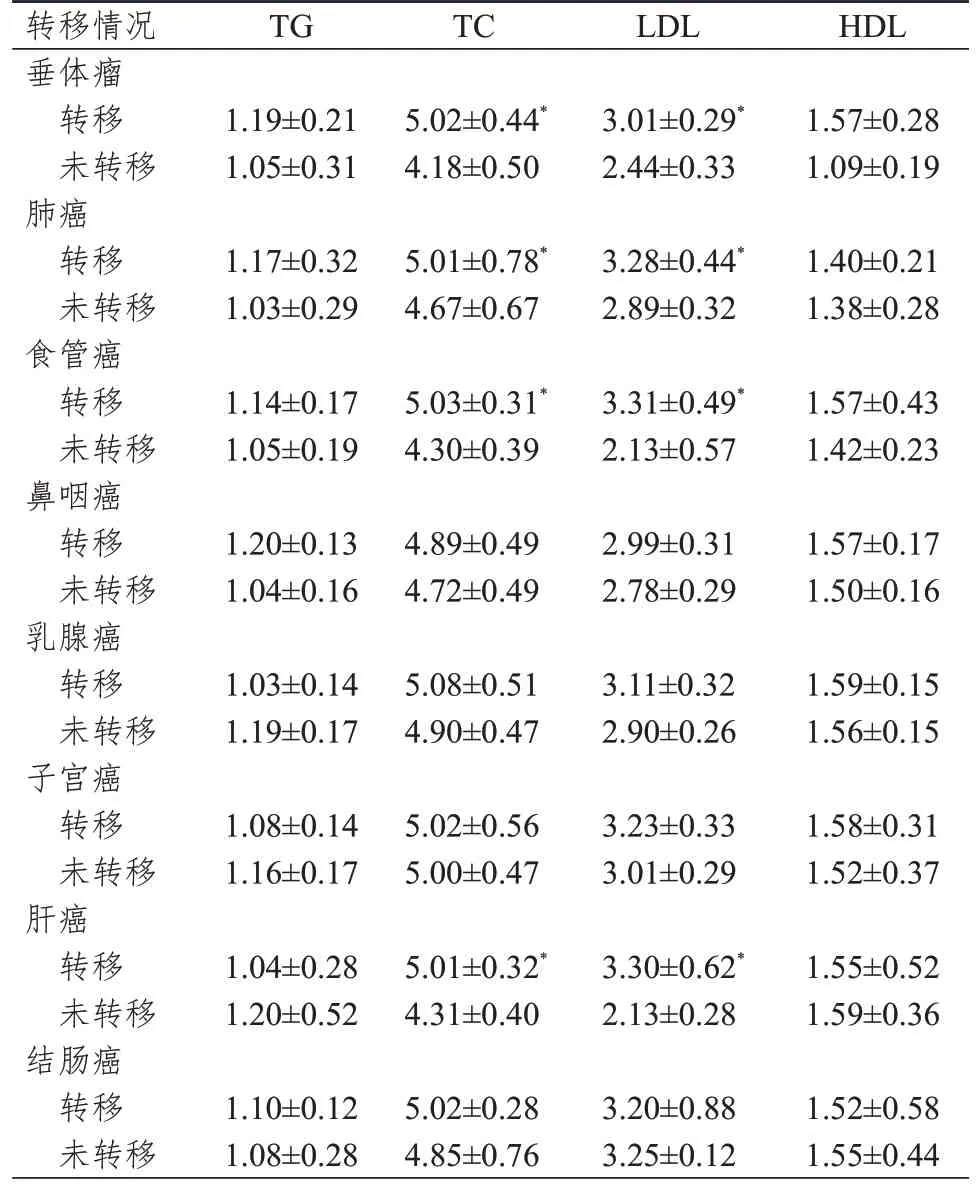
表6 不同类型肿瘤转移与未转移患者脂代谢指标的比较(mmol/L,±s)
注:*与同指标非转移患者比较,P<0.01
转移情况垂体瘤转移未转移肺癌转移未转移食管癌转移未转移鼻咽癌转移未转移乳腺癌转移未转移子宫癌转移未转移肝癌转移未转移结肠癌转移未转移TG TC LDL HDL 1.19±0.21 1.05±0.31 5.02±0.44*4.18±0.50 3.01±0.29*2.44±0.33 1.57±0.28 1.09±0.19 1.17±0.32 1.03±0.29 5.01±0.78*4.67±0.67 3.28±0.44*2.89±0.32 1.40±0.21 1.38±0.28 1.14±0.17 1.05±0.19 5.03±0.31*4.30±0.39 3.31±0.49*2.13±0.57 1.57±0.43 1.42±0.23 1.20±0.13 1.04±0.16 4.89±0.49 4.72±0.49 2.99±0.31 2.78±0.29 1.57±0.17 1.50±0.16 1.03±0.14 1.19±0.17 5.08±0.51 4.90±0.47 3.11±0.32 2.90±0.26 1.59±0.15 1.56±0.15 1.08±0.14 1.16±0.17 5.02±0.56 5.00±0.47 3.23±0.33 3.01±0.29 1.58±0.31 1.52±0.37 1.04±0.28 1.20±0.52 5.01±0.32*4.31±0.40 3.30±0.62*2.13±0.28 1.55±0.52 1.59±0.36 1.10±0.12 1.08±0.28 5.02±0.28 4.85±0.76 3.20±0.88 3.25±0.12 1.52±0.58 1.55±0.44
2.5 不同类型肿瘤患者TH 指标与TC 和LDL 的相关性
相关性研究发现,垂体瘤患者的FT3(r=-0.445)、肺癌患者的FT4(r=-0.521)、食管癌患者的T4(r=-0.401)、肝癌患者的T4(r=-0.601)与TC 均呈负相关(P﹤0.05);垂体瘤患者的FT3(r=-0.337)、肺癌患者的FT4(r=-0.342)、食管癌患者的T4(r=-0.401)、肝癌患者的T4(r=-0.333)与LDL 均呈负相关(P﹤0.05)。
3 讨论
TH 具有保证神经系统、骨骼发育、心血管系统正常生长发育,以及维护正常造血功能等作用。研究发现,TH 和甲状腺激素受体(thyroid hormone receptor,THR)在不同肿瘤的发生和发展中扮演重要角色,在肝癌、肾细胞癌、乳腺癌、垂体瘤、肺癌、结肠癌细胞中均发现THR 的不同程度改变[10],同时结肠癌、肺癌、前列腺癌中还存在TSH低表达。另外有研究发现,乳腺癌、肺癌以及卵巢癌的TH 能够促进肿瘤发生和进展,而肝癌、结肠癌以及食管肿瘤则相反[11],提示了TH 在肿瘤发生发展中具有重要作用,但具体作用在不同肿瘤中表现并不一致[12]。
本研究分析了713 例不同肿瘤及转移情况患者的TH 表达差异,肿瘤患者TSH、FT3、FT4、T3水平均明显低于健康人,差异均有统计学意义(P﹤0.01),且FT3在所有肿瘤中的水平均低于健康人(P﹤0.05)。在713 例肿瘤患者中,发生转移患者317 例,转移发生率为44.46%。转移垂体瘤患者TSH、T4、T3和FT3均低于未转移患者,转移肺癌患者TSH 和FT4均低于未转移患者,转移食管癌患者T4低于未转移患者,转移肝癌患者T4和FT4均低于未转移患者,差异均有统计学意义(P﹤0.05)。这些结果提示了TH 水平的降低与肿瘤发生关系密切。研究进一步分析TH 异常与肿瘤患者发生转移的关系,发现TH 水平降低对垂体瘤、肺癌、食管癌、肝癌发生转移具有重要意义。其具体机制可能与TH 对氧化、糖代谢、脂肪以及免疫调节机制等均有重要的调节作用有关[13]。本研究也发现,转移垂体瘤、肺癌、食管癌及肝癌患者的TC 和LDL 水平均明显高于未转移患者,垂体瘤患者的FT3、肺癌患者的FT4、食管癌患者的T4、肝癌患者的T4与TC 和LDL 均呈负相关。可能的机制是甲状腺功能下调引起的高脂肪代谢促进了肿瘤发展进程中的糖酵解作用[14],一方面为肿瘤发生发展提供重要的脂质等物质基础,包括肿瘤细胞膜脂质以及肿瘤转移过程中所需要的脂肪酸等,另一方面为肿瘤的凋亡抵抗和增殖提供了重要的信号,如TH 激活细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)1/2 和缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)相关的抗凋亡促增殖相关通路[15]。
已有研究发现,TH 降低可通过增加肝细胞内环磷酸腺苷(cyclic adenosine monophosphate,cAMP)含量,激活蛋白激酶A 信号通路,进而磷酸化cAMP 反应元件结合蛋白,促进肝细胞3-羟基-3-甲基戊二酰辅酶A 还原酶(3-hydroxy-3-methylglutaryl-CoA reductase,HMGCR)表达,从而增加机体胆固醇的合成[16]。而机体和细胞内的胆固醇增加会打破代谢平衡,刺激肿瘤转移[17]。同时,细胞内胆固醇蓄积会上调自然杀伤(natural killer,NK)细胞的活化能力[18]。同时NK 细胞内胆固醇蓄积,可增加细胞膜表面的脂筏数量,促进激活性受体向脂筏的移位,进而激活下游信号通路,增强其肿瘤杀伤能力[19]。本研究发现,垂体瘤、肺癌、食管癌、肝癌转移病例中,出现T4、FT3和FT4水平降低;同时,在上述4 种肿瘤患者中发现TC 和LDL 水平增高。进而推论,T4、FT3和FT4降低可通过提高TC 和LDL 水平打破脂代谢平衡,促进肿瘤转移,同时肿瘤进程也加剧反馈调节TC 增高,进而增强肿瘤杀伤能力。因而T4、FT3和FT4具有作为垂体瘤、肺癌、食管癌、肝癌转移标志物的潜力。
