河流弧菌核酸检测试剂国家参考品的建立
2024-04-07任珊珊麻婷婷许四宏
任珊珊 麻婷婷 许四宏★
河流弧菌(Vibrio flurialis)是海洋中的一种常见致病菌,又名河流菌,河川弧菌等。该菌属于革兰氏阴性菌,是一种具有弯曲细胞形态和极性鞭毛的运动嗜盐菌,是在弧菌属中仅次于霍乱弧菌和副溶血性弧菌的致病性弧菌,可引起人类散发或爆发腹泻。河流弧菌在许多国家的自然海水和海产品中相继被检出,其可引起鱼类、虾蟹类、贝类的败血症和脓包症等。同时河流弧菌也可通过不洁海产品引起人类严重的流行性腹泻,其被认为是一种全球性的人兽共患的新型病原菌[1]。河流弧菌抵抗力较强,在抹布和面板上能存活30 天以上,在冰箱中能存活76 天以上,被污染的食品、鱼类均可成为传播媒介[2]。中毒者多以恶心、呕吐、腹痛、腹泻为主要症状,并多数伴有发热,白细胞总数升高[3]。虽然河流弧菌可以进行培养,但因其与霍乱弧菌或气单胞菌的表型相似,所以在鉴定上仍具有挑战性。然而,利用分子检测技术,可以准确的从临床和不同的环境样本中鉴别出河流弧菌[4]。目前我国虽已有相关企业成功研发河流弧菌核酸检测试剂,但该类产品均无系统的质量评价和统一的质量标准,故尚未有核酸诊断试剂产品上市。国家参考品是相关诊断试剂质量评价的基础,是审评审批的重要依据,建立创新型的质量评价方法,是评估诊断试剂产品性能的重要保障[5-7]。本研究拟开展河流弧菌核酸检测试剂国家参考品的研制工作并制定其质量评价标准,用于评价河流弧菌核酸检测试剂的阳性符合率、阴性符合率、检测限及重复性,助力推进国内企业在研产品的质量优化。
1 材料与方法
1.1 材料
1.1.1 参考品原料来源
河流弧菌核酸检测试剂参考品的样本共计18份,均为培养的菌液经灭活后稀释至生理盐水中制备而成。所有样本均来源于中国疾病控制中心(Chinese Center for Disease Control and Prevention,CDC)传染病所。见表1。霍乱弧菌和副溶血弧菌样本经56℃、30 min 灭活处理,其他临床分离株样本均经60℃、1 h灭活处理,并于-70℃及以下保存备用。
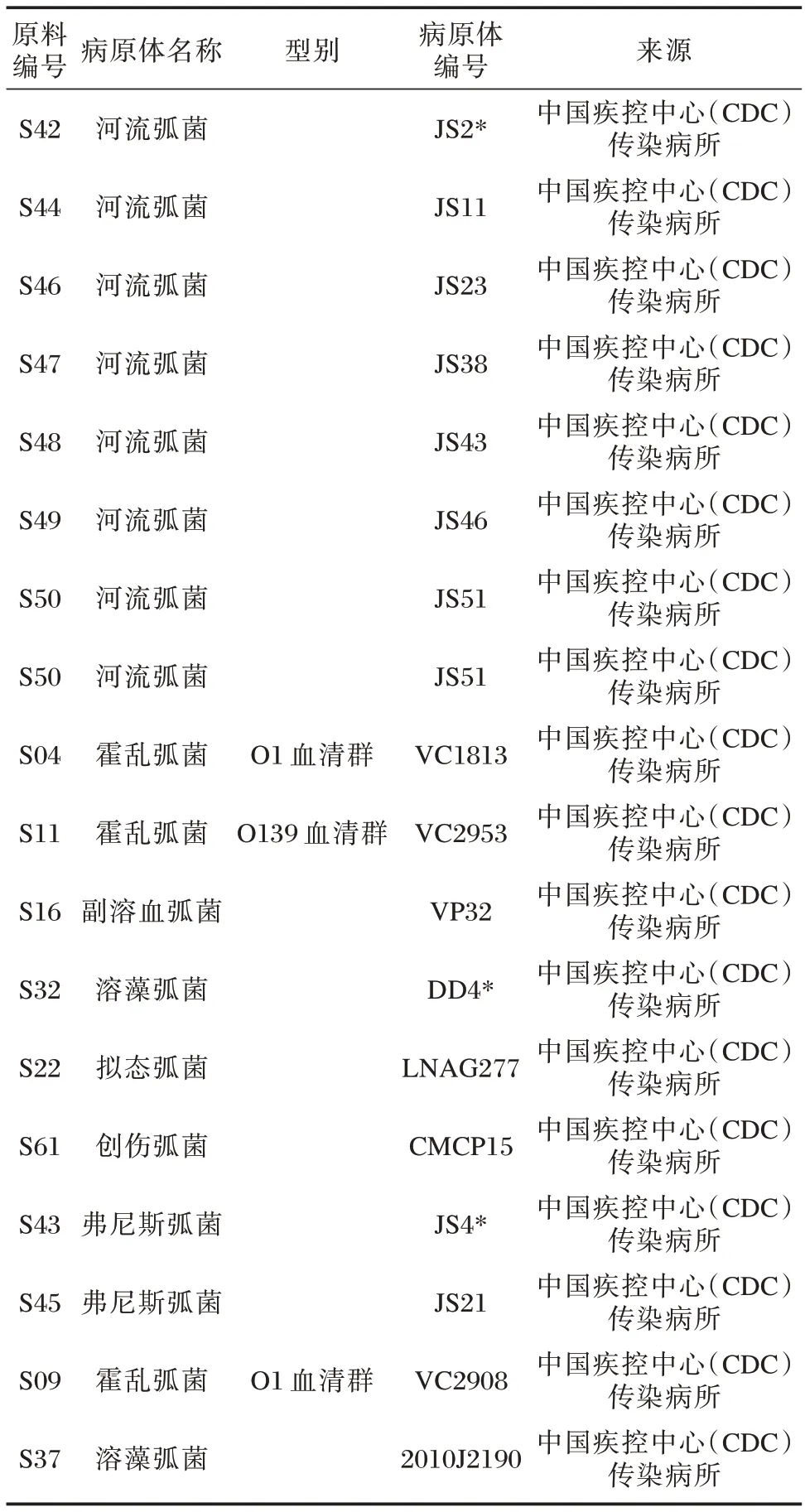
表1 临床病原菌分离株信息Table 1 clinical pathogenic bacteria isolates information
1.1.2 检测试剂
本研究使用试剂包括中山大学达安基因股份有限公司的河流弧菌核酸检测试剂盒(PCR-荧光探针法)(批号:2020001,规格:48 反应/盒)、江苏硕世生物科技股份有限公司的河弧菌核酸检测试剂盒(荧光PCR 法)(批号:20220802,规格:50 反应/盒)、苏州天隆生物科技有限公司提的河弧菌核酸检测试剂盒(荧光PCR 法)(批号:742210410,规格:50 反应/盒)共3 家企业的产品。
1.2 试验方法
1.2.1 原料筛选
从-80℃甘油保存管中复苏至普通琼脂培养基平板,在平板上挑单菌落至Luria-Bertani 培养基增菌液中增菌,取增菌液鉴定,对临床病原菌进行初筛。
通过宏基因16S rRNA 测序方法对临床病原菌进行复核,测序平台为illumina Novaseq,PE150测序。测序获得的原始数据,质控去除含adapter的reads、含N 比例大于10%的reads 和低质量reads,采用BWA 的分析方法,进行宿主过滤分析,组装基因组序列,导入微生物数据库比对,进行注释与鉴定。
使用江苏硕世生物科技股份有限公司的河弧菌核酸检测试剂盒(荧光PCR 法)对临床病原菌进行确认,并按照说明书规定的方法进行阴阳性判定。随机抽取部分河流弧菌阳性样本送至广州微远基因科技有限公司进行序列同源性分析。
1.2.2 参考品制备
将确认后的病原菌经离心、过滤、稀释及分包装后作为参考品的组盘样本,分别编号为8 份阳性参考品P1~P8,10 份阴性参考品N1~N10,1 份检测限参考品L 和1 份重复性参考品R。
1.2.3 协作标定
协作标定使用试剂包括中山大学达安基因股份有限公司、江苏硕世生物科技股份有限公司、苏州天隆生物科技有限公司共3 家企业的产品。盲编为A、B 和C,按照各自的产品说明书操作。评价项目包括阳性参考品符合率、阴性参考品符合率、检测限和重复性。
1.2.4 稳定性与均匀性研究
随机抽取一套完整的河流弧菌核酸检测试剂国家参考品和三支检测限参考品L 放置于2~8℃和室温环境中,并于第1、3、5、7 d 分别取出检测限参考品L 用无RNA 酶的去离子水进行1∶101~1∶106倍稀释,第7 天取出完整的参考品使用河弧菌核酸检测试剂盒对2~8℃和室温稳定性进行评估。另随机抽取检测限参考品L 一支,-20℃冻融1 次后用无RNA 酶的去离子水进行1∶101~1∶106倍稀释,对冻融稳定性评估。
随机抽取5 支重复性参考品R,使用河弧菌核酸检测试剂盒对均匀性评估,用无RNA 酶的去离子水进行1∶10 和1∶100 稀释,重复测定10 次,要求均为河流弧菌阳性。
1.3 统计学分析
使用SPSS 16.0 软件进行统计分析。计量资料采用(),组间采用单因素方差分析。计算重复性参考品R(1∶10)和R(1∶100)各10 次。通过计算Ct 值的平均值(M)和标准差(SD),计算变异系数(CV,%),公式为CV=SD/M×100%,且其Ct 值的变异系数CV 均不大于5.0%。以P<0.05 为差异有统计学意义。
2 结果
2.1 样本初筛、复核及确认
8 份河流弧菌毒株、10 份其他弧菌毒株进行初筛、复核、确认后均为其对应菌种。见图1。
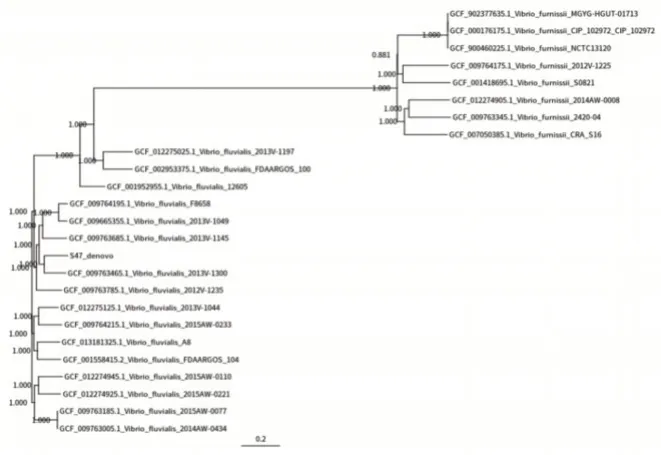
图1 河流弧菌阳性样本进化树Figure 1 Evolutionary tree of Vibrio flurialis positive samples
2.2 参考品组成
经确定的河流弧菌核酸检测试剂国家参考品由20 份样本组成:8 份阳性参考品P1~P8、10份阴性参考品N1~N10、1 份检测限参考品L 和1份重复性参考品R,L 经菌落计数法测定浓度为1×108CFU/mL。
2.3 协作标定结果
河流弧菌核酸检测试剂的阳性符合率、阴性符合率、检测限及重复性的协作标定结果显示,3 种检测试剂的阳性符合率(+/+)均为8/8,阴性符合率(-/-)均为10/10。检测限指标,1∶104稀释或更高浓度时应均为河流弧菌阳性,厂家A 为1∶107稀释及以上浓度均能检出,厂家B 为1∶106稀释及以上浓度均能检出,厂家C 为1∶105稀释及以上浓度均能检出。重复性指标,变异系数CV 均不大于5%。见表2。
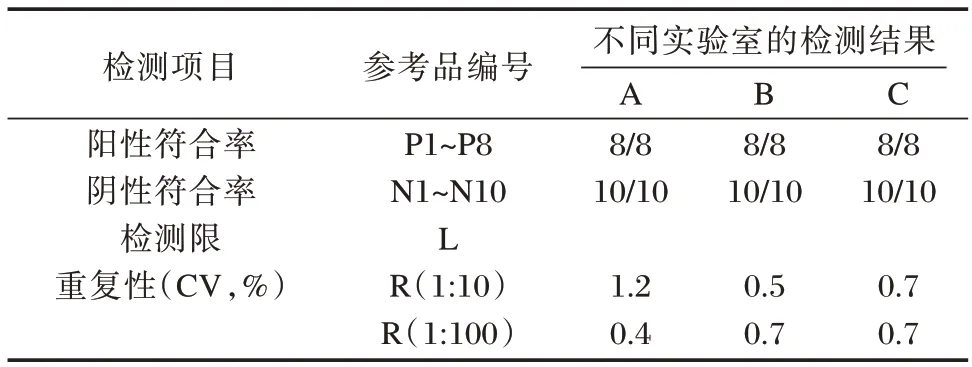
表2 3 种试剂协作标定结果Table 2 Collaborative test results of 3 reagents
2.4 稳定性与均匀性结果
稳定性检测结果显示,检测限参考品L 稀释后,在2~8℃及室温放置1 d、3 d、5 d 和7 d 检测结果为1∶106稀释及以上浓度均为阳性。放置于2~8℃和室温7 d 的整套参考盘,阳性参考品P1~P8 和重复性参考品R 均为阳性,且Ct 值与0 d 相比差异无统计学意义(P>0.05);检测限参考品L 为1∶106稀释及以上浓度均为阳性;阴性参考品N1~N10 均为阴性。冻融1 次的检测限参考品L 为1∶106稀释及以上浓度均为阳性。结果见表3。均匀性检测结果显示,R(1∶10)和R(1∶100)的均匀性符合要求。
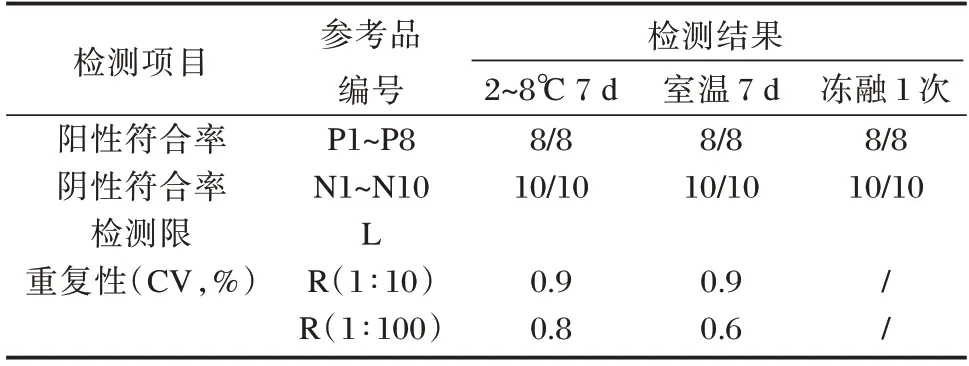
表3 河流弧菌核酸检测试剂国家参考品稳定性考核结果Table 3 stability test on reference panel for Vibrio flurialis uncleic acid detection kits
3 讨论
目前河流弧菌的检测方法主要有传统的细菌分离培养鉴定、荧光抗体检测和以PCR 为基础的分子生物学方法。使用传统的河流弧菌检测方法耗时长、操作复杂,不宜做大批量样本的检测。Hurtle W 等[8]报道了应用变性高效液相色谱快速鉴定细菌16SrRNA基因保守区的DNA 序列变异,周妍妍等[9]应用PCR 检测河流弧菌的毒力基因vfh、hupO、vfp及toxR,发现导致腹泻的河流弧菌主要携带vfh和hupO,而toxR具有种属特异性,菌株携带toxR 为100%,可以作为特征性基因用于河流弧菌的鉴定[10-11]。曹际娟等[12]对河流弧菌的toxR基因的特异基因序列进行PCR 扩增,然后利用DHPLC 检测阳性吸收峰,达到自动化快速检测的目的。戚莉芳等[13]对河流弧菌水产品分离株OmpU基因进行克隆测序和生物信息学分析,为建立该菌的检测方法和研制疫苗奠定基础。
实时荧光定量PCR(Quantitative PCR,qPCR)检测方法一种快速、灵敏的分子检测方法,对有效防治因河弧菌引起的腹泻病具有重要的应用价值。现有的科研用途的河流弧菌检测试剂盒均是基于qPCR 的方法进行的检测。目前我国还未有河流弧菌核酸诊断试剂的行业标准、审评指导原则和标准物质,也未有商业化的河流弧菌核酸检测试剂。为对此类产品进行系统的质量评价并建立统一的质量标准,本研究研制了河流弧菌核酸检测试剂定性用国家参考品(编号为370081-202001)[14]。
本参考品的研制确定了我国河流弧菌核酸检测试剂的最低质量要求,通过对该参考品相关检测性能的考核,可对企业研发试剂的性能进行评估及质量控制,为临床诊断试剂提供坚实有力的质量保证。
