KRAS、NRAS、BRAF、PIK3CA、NTRK1 基因联合检测在结直肠癌中的表达
2024-04-07杜劲齐妍曾妍邱瑾王吉林庄斯慧黄政华
杜劲 齐妍 曾妍 邱瑾 王吉林 庄斯慧 黄政华
结直肠癌(colorectal carcinoma,CRC)是临床最常见的消化道恶性肿瘤,相关数据显示,中国的结直肠癌发病率处于较高的水平,在所有的癌症中发病率位居第五,且呈逐年上涨的趋势[1]。近年来,CRC 的潜在基因改变被大量发现,精准预测患者预后,不仅有利于制定医疗方案,同时也有利于提高患者生存情况和生活质量[2-3]。表皮生长因子受体(epidermal growth factor receptor,EGFR)单克隆抗体的发明使临床CRC 治疗迈入个体化靶向精准治疗的时代,但是在临床治疗中,仅有少部分CRC 患者对抗EGFR 靶向药物敏感[4-5]。KRAS、NRAS、BRAF、PIK3CA、NTRK为CRC 患者抗EGFR治疗疗效的有效预测分子。其在CRC 患者中均具有不同程度的突变比例。对KRAS、NRAS、BRAF、PIK3CA、NTRK等基因突变状况的检测对于提高CRC 患者治疗效果及预测其预后具有重要作用。本研究 主要探 究KRAS、NRAS、BRAF、PIK3CA、NTRK1基因突变与CRC 患者临床病理特征存在的关系,报道如下。
1 资料与方法
1.1 研究对象
选取CRC 患者200 例作为研究对象,收集所选取研究对象的临床资料。并收集其CRC 手术切除或穿刺活检标本提取DNA。纳入标准:①所有患者均通过病理证实为CRC;②术前均未接受放、化疗及免疫治疗;③均接受根治性切除手术;④患者对本次研究知情同意。排除标准:①有明显的系统性炎症或感染;②存在血液系统疾病、高热;③合并肠穿孔、肠梗阻或其它恶性疾病。本研究符合伦理委员会批准。
1.2 检测方法
收集所选取CRC 患者手术切除或穿刺活检标本提取DNA,采用人类癌症多基因突变联合检测试剂盒检测KRAS、NRAS、BRAF、PIK3CA、NTRK1基因突变状态,严格按照试剂盒操作说明书进行,主要步骤为文库构建→杂交捕获→上机测序,以检测结果为准。
1.3 临床资料收集及随访
收集所选取CRC 研究对象的临床资料包括年龄、性别、肿瘤TNM 分期、组织学分类、分化程度等临床病例资料。所有患者均在门诊执行常规随访:第一年每3~6 个月随访一次,接下来毎6 个月随访一次,通过影像学检查了解肿瘤复发情况,并最后通过病理学检测确诊。总生存时间为由首次确诊日期到死亡日期或存活的患者至末次随访日期。无瘤生存时间为由手术日期到疾病复发日期或无复发的患者至末次随访日期。
1.4 统计学方法
采用SPSS 22.0 软件进行数据分析。计数资料采用n(%)表示,行χ2检验。计量资料采用()表示,两组间比较采用t检验。KRAS、NRAS、BRAF、PIK3CA、NTRK1基因突变间的相关性采用Spearman 等级相关分析。绘制ROC 曲线分析相关指标单一检测及联合检测的诊断价值,同时采用Kaplan-Meier 生存曲线和Log-rank 法比较两组患者的生存率,Cox 回归综合生存分析影响患者预后的危险因素。以P<0.05 为差异有统计学意义。
2 结果
2.1 KRAS、NRAS、BRAF、PIK3CA、NTRK1 突变基因分别在不同CRC 患者临床病理特征中的比较
KRAS、BRAF基因突变率与pTNM 分期有关(P<0.05),NRAS、PIK3CA、NTRK1基因突变与患者的性别、年龄、CRC 组织学分级、淋巴结转移、pTNM 分期比较,差异无统计学意义(P>0.05)。见表1。

表1 KRAS、NRAS、BRAF、PIK3CA、NTRK1 基因突变与CRC 患者临床病理特征的关系[n(%)]Table 1 Relationship between KRAS,NRAS,BRAF,PIK3CA,NTRK1 gene mutations and clinical pathological characteristics of CRC patients[n(%)]
2.2 KRAS、NRAS、BRAF、PIK3CA、NTRK1 基因突变的相关性
200 例CRC 患者KRAS 与BRAF 基因突变存在负相关性(r=-0.157,P=0.027),其余基因间突变均无相关性(P>0.05)。见表2。
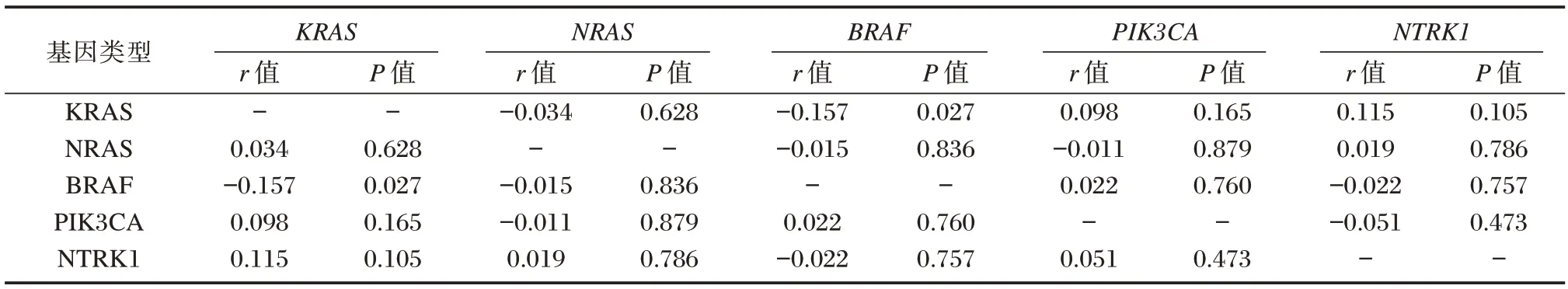
表2 KRAS、NRAS、BRAF、PIK3CA、NTRK1 基因突变的相关性Table 2 Correlation of Mutations in KRAS,NRAS,BRAF,PIK3CA,and NTRK1 Genes
2.3 KRAS、NRAS、BRAF、PIK3CA、NTRK1 基因检测对CRC 复发情况的预测价值
KRAS、NRAS、BRAF、PIK3CA、NTRK1单一基因检测与多基因联合检测对CRC 复发情况均具有一定价值,但多基因联合检测价值更高,其中KRAS、NRAS、BRAF、PIK3CA与NTRK1基因联合检测对CRC 复发情况的诊断准确性最高(AUC=0.797),但KRAS、BRAF、PIK3CA与NTRK1联合检测灵敏度最高(0.861),PIK3CA单一检测特异度最高(0.969)。
2.4 KRAS、NRAS、BRAF、PIK3CA、NTRK1 基因突变与CRC 患者预后间的关系
KRAS突变患者第3 年和第5 年总生存率及无瘤生存率最高,总生存率中其次为NRAS基因突变患者;无瘤生存率中PIK3CA基因突变者最高。见表3。

表3 KRAS、NRAS、BRAF、PIK3CA、NTRK1 基因突变与CRC 患者预后间的关系Table 3 Relationship between KRAS,NRAS,BRAF,PIK3CA,NTRK1 gene mutations and prognosis in CRC patients
2.5 CRC 患者总生存时间的危险因素分析
单因素分析结果显示,年龄>60 岁,KRAS、BRAF、PIK3CA、NTRK1基因突变为影响CRC 患者总生存时间的危险因素(P<0.05)。多因素分析结果显示,年龄>60 岁,KRAS、BRAF、PIK3CA、NTRK1基因突变为影响CRC 患者总生存时间的独立预测因子(P<0.05)。见表4。
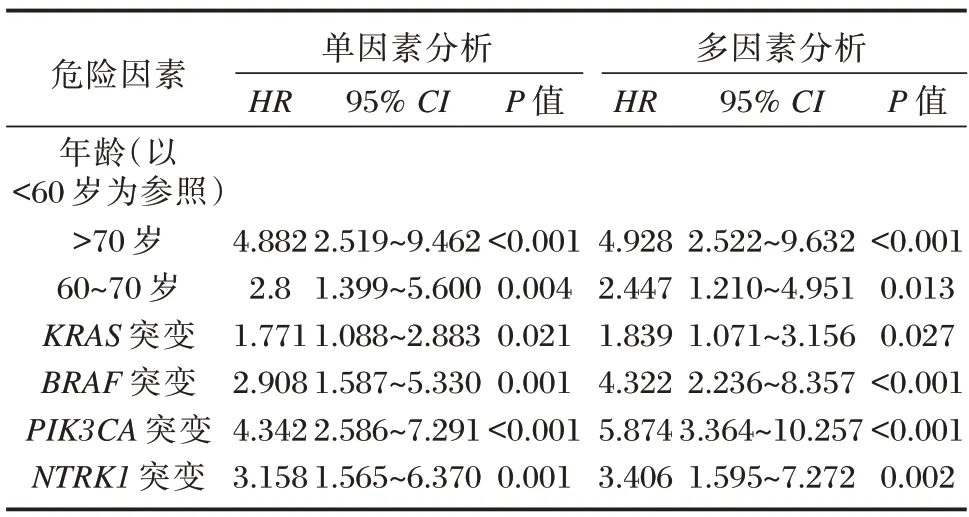
表4 单因素和多因素Cox 回归综合生存分析Table 4 Comprehensive survival analysis of univariate and multivariate Cox regression
3 讨论
目前个体化精准治疗在CRC 治疗中备受重视。其中基因检测指导下的靶向药物联合治疗是CRC 治疗的热门方向之一[6-7]。该方法采用不同的靶向药物阻断CRC 调控通路的不同位点,在临床试验过程中获得了很好的疗效[8-9]。KRAS、NRAS、BRAF、PIK3CA、NTRK1等基因是现阶段CRC 预后预测较热门的分子标志物。KRAS与NRAS均为EGFR 下游信号转导通路的重要调控基因。当KRAS与NRAS发生突变时将激活RAS 蛋白,进而激活MAPK下游信号因子,使抗EGFR 治疗疗效降低或丧失。大约有60%的转移性CRC 患者携带对抗EGFR单克隆抗体耐药的KRAS或NRAS突变,这严重影响患者的治疗效果,使预后不良[10-11]。而BRAF为KRAS下游分子,同样参与MAPK 信号通路的调控,在CRC 的突变率为10%~25%,是早期及晚期复发性非高度微卫星不稳定肿瘤的强力不良预后指标[12]。PIK3CA属于PI3K-Akt信号通路,是关键的原癌基因,当PIK3CA突变会引起PI3K酶处于持续激活状态,增强细胞内信号的传导,导致整个通路的紊乱,促进结直肠癌干细胞的存活和增殖,导致细胞抵抗化疗药物。
确定CRC 患者各突变基因与临床特征的关系,有助于针对不同患者制定个体化精准治疗方案,提高患者治疗效果。本研究中,KRAS、BRAF基因突变与pTNM 分期有关,与患者的性别、年龄、CRC 组织学分级、淋巴结转移、血清CEA 及CA199 水平无明显相关,NRAS、PIK3CA、NTRK1基因突变与患者的性别、年龄、CRC 组织学分级、淋巴结转移、pTNM 分期、血清CEA 及CA199 水平等均无明显相关。同时本研究对各基因突变的相关性进行研究,结果显示KRAS与BRAF基因突变存在一定的相关性,其余基因间突变均无相关性。该结果表明,KRAS、NRAS、BRAF、PIK3CA、NTRK1等基因的突变相互独立,虽有部分患者基因检测结果存在两个或多个基因突变,但各基因间突变存在各自独立的致病机制并不存在关联。本研究结果显示KRAS、NRAS、BRAF、PIK3CA、NTRK1单一基因检测与多基因联合检测对CRC 复发情况均具有一定价值,但多基因联合检测 价值更高,其中KRAS、NRAS、BRAF、PIK3CA、NTRK1基因联合检测对CRC 复发情况的诊断准确性最高,但KRAS、BRAF、PIK3CA与NTRK1联合检测灵敏度最高,PIK3CA单一检测特异度最高,各院可根据具体需求对CRC 患者进行基因检测。
综上所 述,CRC 患 者KRAS、NRAS、BRAF、PIK3CA、NTRK1基因突变无明显相关性,但各基因单一或联合检测对对CRC 复发情况具有一定价值,且各基因突变患者的生存时间减少,可作为患者预后评估的重要指标。
