黄芪多糖对HD11鸡巨噬细胞转录组和代谢组的影响
2024-04-02陈富斌徐国伟冯海鹏郭志廷韩松伟刘佳惠古雪艳张景艳李建喜HuubSavelkoul
陈富斌,徐国伟,王 磊,刘 琴,冯海鹏 ,张 康,郭志廷,韩松伟,刘佳惠,古雪艳,张景艳*,李建喜*,Huub F. J. Savelkoul
(1.中国农业科学院兰州畜牧与兽药研究所,兰州 730050;2.甘肃农业大学动物医学院,兰州 730070;3.荷兰瓦赫宁根大学细胞生物与免疫学教研组,荷兰瓦赫宁根市)
黄芪多糖(APS),作为豆科黄芪属植物的主要成分之一,是免疫活性最强的一类生物大分子[1],具有免疫调节、促进免疫器官发育[2-3],增加免疫球蛋白和T淋巴细胞的数量、增强疫苗保护效力等生物学功能[4-5],已被广泛应用于畜禽生产中[6]。天然免疫是机体重要的防御屏障,对抵抗病原微生物感染发挥至关重要的作用[7-8]。巨噬细胞是机体天然免疫调控的主要执行者,并参与特异性免疫过程[9],能消灭侵入机体的细菌、吞噬异物颗粒,消除体内衰老、损伤的细胞和细胞间质变性、杀伤肿瘤细胞,并参与免疫反应[10]。研究表明,APS对正常小鼠的细胞免疫、体液免疫及巨噬细胞功能均有明显的增强作用[11]。然而有关其对鸡巨噬细胞(HD11细胞)的调节作用机制研究尚不深入。HD11细胞是一种通过复制缺陷型禽白血病病毒MC29毒株转化鸡骨髓细胞形成的永生化细胞系,常被作为开展家禽天然免疫调控研究的模式细胞。作者研究发现,12.5~800.0 μg·mL-1APS对HD11细胞增殖活性有促进作用;100 μg·mL-1APS处理HD11细胞12 h,可能通过识别TLR2、TLR4及TLR15促进HD11细胞增殖与极化,发挥免疫增强作用[12-13]。然而相关分子机制有待于进一步的研究证实。
研究表明,巨噬细胞的糖酵解、氧化磷酸化等糖代谢途径与其极化、免疫增强等生物学过程有紧密的相关性[14-15]。刘小琳等[16]研究发现在RAW264.7细胞中PI3K/AKT信号通路通过激活mTOR信号通路,激活糖酵解,从而激活巨噬细胞M1极化过程。转录组学与代谢组学是一门新兴技术,该技术的应用可为疾病发生、药理学作用等领域的深入研究提供重要依据[17-18]。通过转录组学和代谢组学分析发现,在β-葡聚糖(β-glucan)和卡介苗(BCG)诱导的单核巨噬细胞训练免疫形成中糖酵解代谢过程的重编程发挥关键作用[19]。当糖酵解途径被抑制后,天然免疫细胞的表观遗传修饰及免疫记忆均会被抑制[20]。在进一步研究发现,50 μg·mL-1APS可诱导HD11细胞形成训练免疫,并对随后LPS再刺激产生免疫增强的记忆特征。然而APS的这种训练免疫作用是否与代谢重编程有相关性,尚未见文献报道。因此,本试验拟通过转录组与代谢组分析,探究50 μg·mL-1APS是否通过膜受体的识别,进而介导相关信号通路和代谢重编程发挥对HD11的免疫调节作用。
1 材料与方法
1.1 材料
试验所用APS由中国农业科学院兰州畜牧与兽药研究所中兽医实验室制备,测得试验 用APS总多糖含量为95.31%±3.55%;还原性多糖含量1.96%±0.03%;蛋白质含量为6.50%±0.80%;HD11细胞由西北农林科技大学动物医学院王晶钰老师馈赠;细胞培养液RPMI 1640、鸡血清、胎牛血清和胰蛋白酶-EDTA购自Gibco公司;青链霉素和PBS购自索莱宝公司。
1.2 方法
1.2.1 HD11细胞复苏 将冻存的HD11细胞在37.5 ℃下水浴解冻,1 000 r·min-1离心5 min,弃上清,取沉淀,接于1640培养基(含10%胎牛血清、2.5%鸡血清和1%青链霉素)重悬并移入细胞培养瓶中,标记为第1代,置于41 ℃、体积分数为5%的CO2培养箱中进行培养,每隔48 h更换1次培养基,在显微镜下观察细胞的形态及生长状况。
1.2.2 HD11细胞传代 当细胞融合度达80%~90%以上时,弃上清,用预热的PBS洗一遍,使用胰蛋白酶-EDTA消化3 min,在镜下可见细胞回缩呈圆形、轻拍细胞瓶可见细胞滑动时,弃去胰蛋白酶-EDTA,加1640培养基(含10%胎牛血清、2.5%鸡血清和1%青链霉素)1 000 r·min-1离心5 min,弃上清,加入1640培养基轻轻吹打混悬细胞,使用细胞计数器计数,并调整浓度后,分装到新的细胞培养瓶中,标记为第2代,贴壁培养24 h。传至3~5代可进行后续试验。
1.2.3 HD11细胞的处理与分组 将消化后的HD11细胞1 000 r·min-1离心5 min,弃上清,取沉淀,接于1640培养基(含10%胎牛血清、2.5%鸡血清和1%青链霉素)中,调整细胞浓度为1×106·mL-1,按5 mL·瓶-1接于T25细胞培养瓶中,置于41 ℃、体积分数为5%的CO2培养箱中培养36 h,弃上清。将细胞分为空白对照组(CON组)和APS处理组(A50组)。①空白对照组细胞中加入1640培养基(含10%胎牛血清、2.5%鸡血清和1%青链霉素)培养12 h;②50 μg·mL-1APS试验组中用1640培养基(含10%胎牛血清、2.5%鸡血清和1%青链霉素)将APS浓度调整为50 μg·mL-1后加入细胞中培养12 h;收集各组上清和细胞,并进行后续试验。
1.2.4 转录组学、代谢组学及二者关联分析 将培养的细胞去除培养基,用预冷的PBS清洗2~3次,弃去上清,最后加入1 mL预冷的80%的甲醇水溶液,使用细胞刮将培养容器中所有细胞都刮干净,转入2 mL冻存管中,置于液氮中速冻15 min后,保存于-80 ℃冰箱中;转运过程中,将细胞样本置于足量干冰中运输。
1.2.5 统计学分析 转录组学差异基因的筛选标准是|log2(Fold change)|≥1且Padj≤0.05。代谢组学差异代谢物的筛选主要参考VIP、FC和P-value 3个参数,VIP是指PLS-DA模型第一主成分的变量投影重要度,VIP值表示代谢物对分组的贡献;FC指差异倍数(Fold change),为每个代谢物在比较组中所有生物重复定量值的均值的比值;P-value是通过T-test计算得到,表示差异显著性水平。采用一维方差分析,设定阈值为VIP>1.0,FC>1.5或FC<0.667的方法筛选差异代谢物。并计算出差异代谢物在两组间的差异变化倍数 FC(fold change),通过差异变化倍数判断差异代谢物的上调或者下调。
2 结 果
2.1 APS处理组与空白对照组的转录组分析
2.1.1 差异表达基因分析 转录组测序结果中的共表达维恩图展示了每个组中唯一表达的基因数量,重叠区域展示了两个组中共表达的基因数量。APS处理组(A50)与空白对照组(CONT)的唯一表达基因数量与共表达基因数如图1所示,空白对照组总共鉴定出11 116个表达基因,而APS处理组共鉴定出11 021个表达基因,其中二者共同表达的基因数为10 592个。
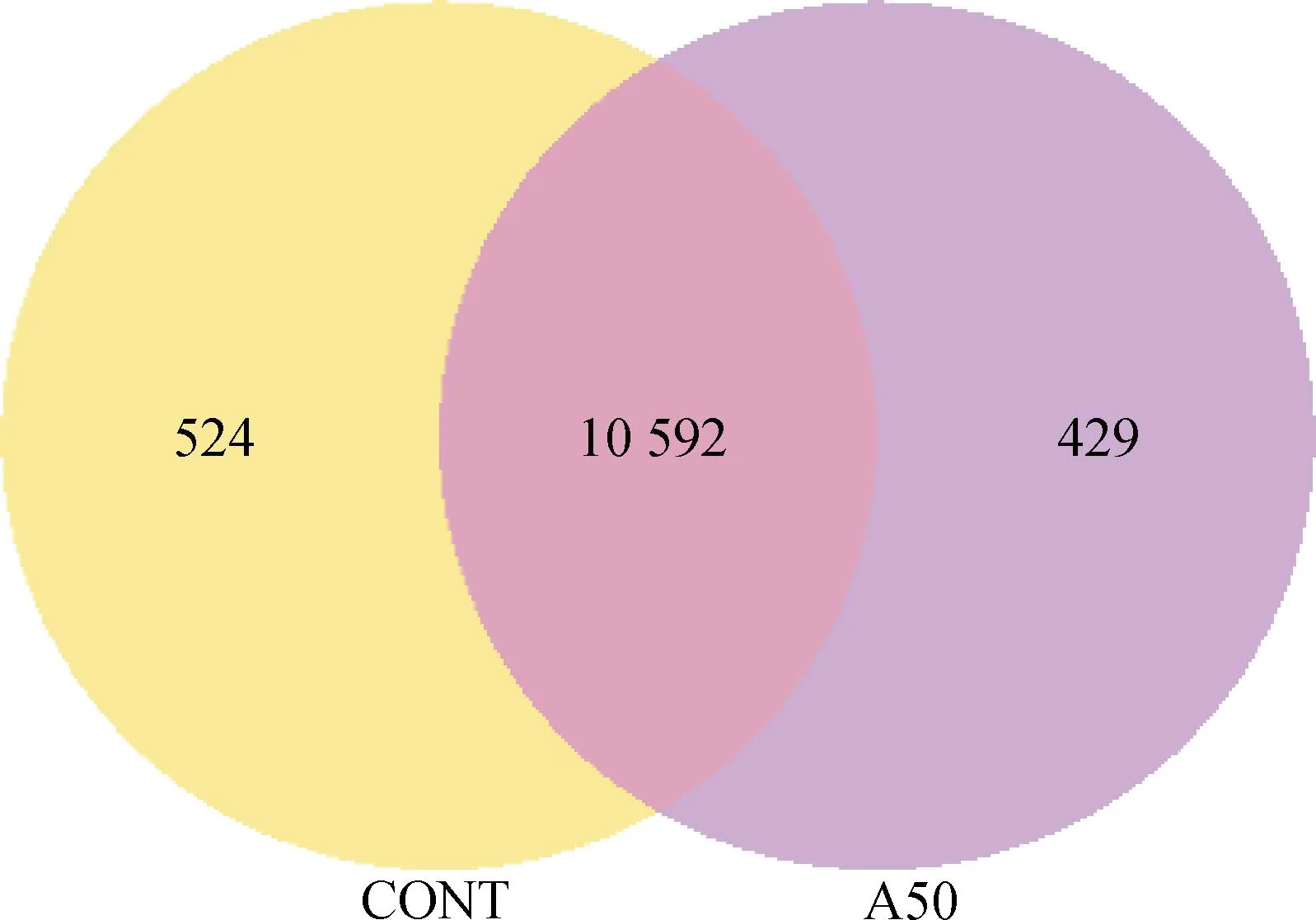
图1 共表达韦恩图Fig.1 Co-expression Venn diagram
如图2所示,以|log2(Fold change)|≥1且Padj≤0.05为标准,APS处理组与空白对照组相比较,共筛选到差异基因845个,其中上调基因415个,下调基因430个。
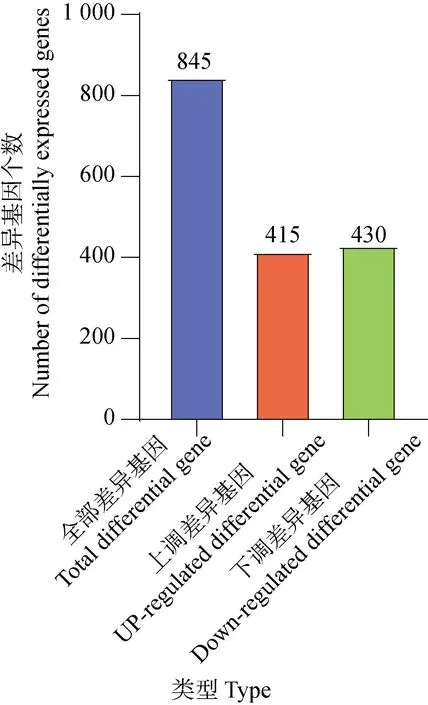
图2 差异表达基因统计Fig.2 Statistics of differentially expressed genes
2.1.2 差异表达基因KEGG富集分析 KEGG通路数据库包括各种生物通路中分子相互作用网络和生物体所特有的变化形式,从而确定蛋白质参与的最重要的信号转导通路和生物代谢通路。将APS处理组与空白对照组的差异表达基因进行KEGG通路富集分析发现,APS处理组与空白对照组的224个差异基因富集于113条KEGG通路,差异表达基因主要富集在细胞因子-细胞因子受体相互作用、Toll样受体信号通路、吞噬体、AGE-RAGE等信号通路,其中细胞因子-细胞因子受体相互作用、Toll样受体信号2条通路最为显著性(图3)。
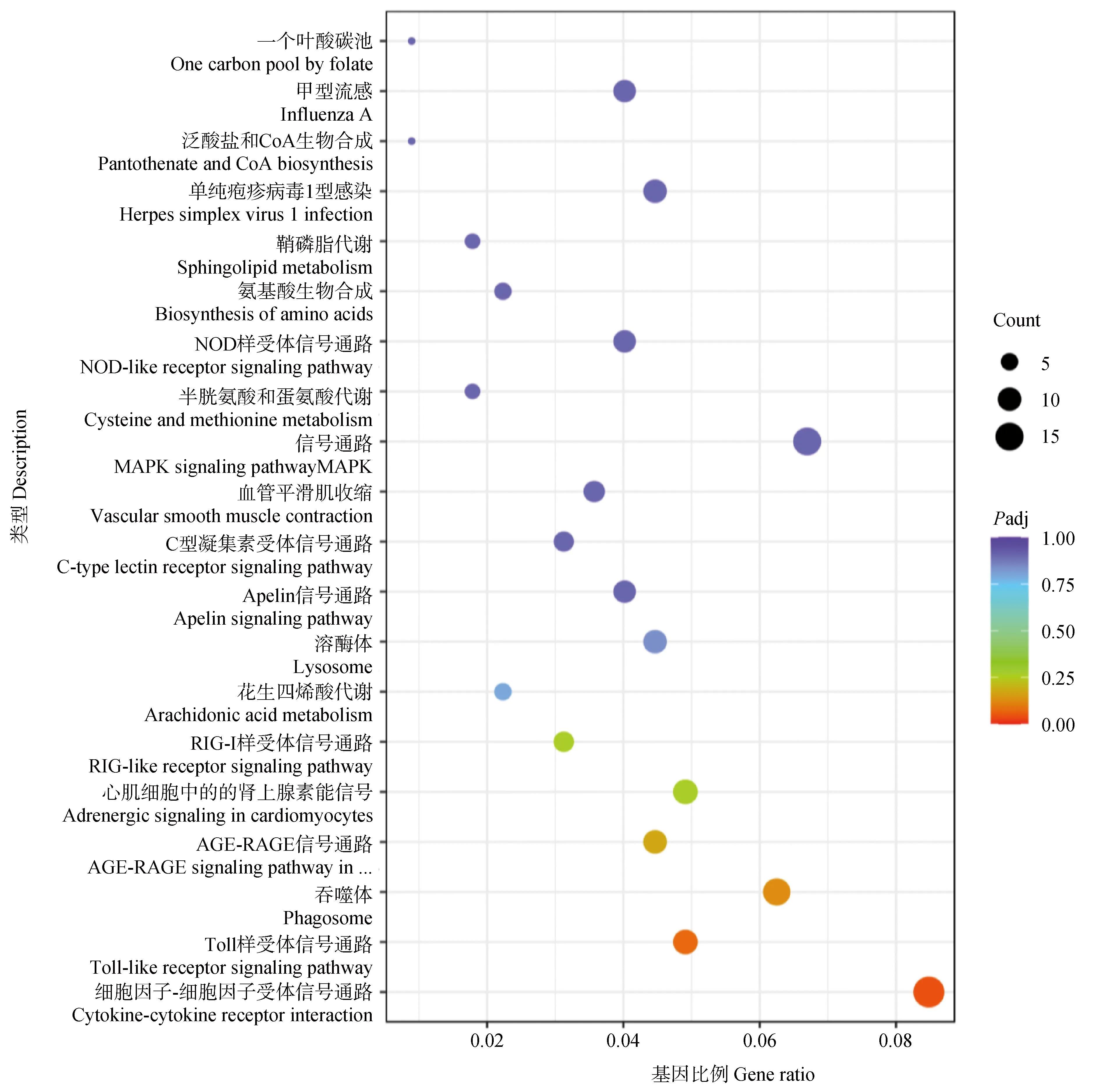
点的大小代表注释到GO term上的基因数,颜色从红到紫代表富集的显著性大小The size of the dots represents the number of genes annotated onto the GO term, and the colors from red to purple represent the significance size of enrichment
2.1.3 关键信号通路中差异基因的表达情况 细胞因子-细胞因子受体信号通路与Toll样受体信号通路是两条对HD11胞免疫调节作用影响的重要途径,与细胞的免疫调节等密切相关。对APS处理组与空白对照组的差异基因表达进行分析,发现在细胞因子-细胞因子受体信号通路中富集了19个差异基因,其中上调基因17个,包括IL-8、CXCL13、CSF1、TNFSF8等,下调基因2个,包括IL-12B和CCR5(表1);在Toll样受体信号通路中主要富集了11个差异基因,其中上调基因5个,包括IL-8、IL8L1、TLR1B、CCL4和TLR1A,下调基因6个,包括TLR2A、TLR2B、IL-12B、FOS、TLR3和MAP2K7(表2);在其他代谢通路富集的差异基因中ACSS2、iNOS、ATP6V0、MTA为上调基因,H6PD、PRPS2、CA、MSA为下调基因(表3)。
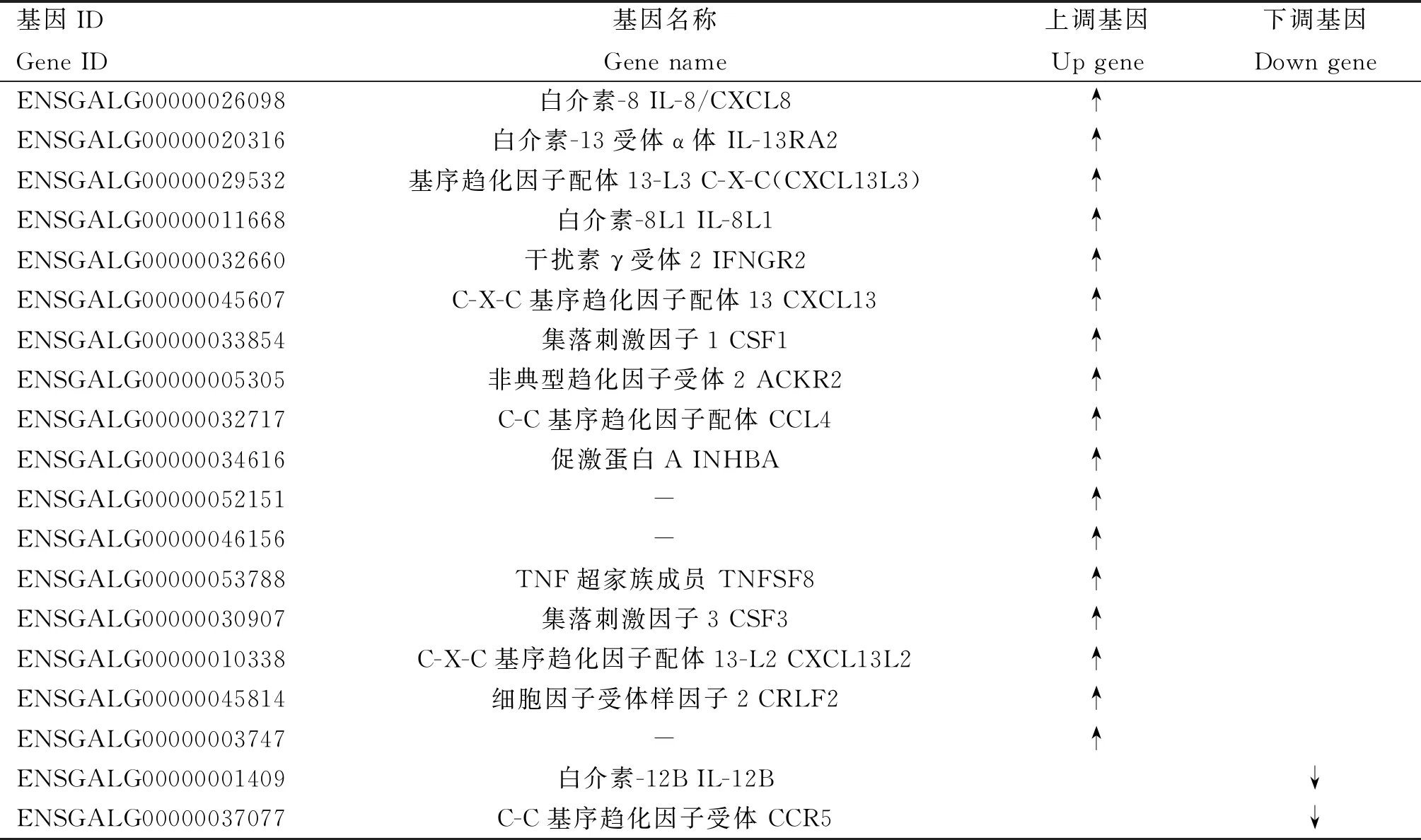
表1 细胞因子-细胞因子受体相互作用的基因表达情况

表3 其他代谢途径基因的表达情况
2.2 APS处理组与空白对照组代谢组分析
2.2.1 代谢组学多元统计分析 主成分分析(principal component analysis, PCA)是将一组可能存在相关性的变量,通过正交变换转换为一组线性不相关变量的统计方法,转换后的这组变量即称为主成分。依据PCA模型显示,第一主成分可显示30.68%的代谢物信息,第二主成分可显示25.55%的代谢物信息,APS处理组与空白对照组代谢物的第一主成分和第二主成分在空间中的分布相对独立,存在显著差异(图4)。

图4 代谢组学样本PCA分析图Fig.4 PCA analysis of metabonomic samples
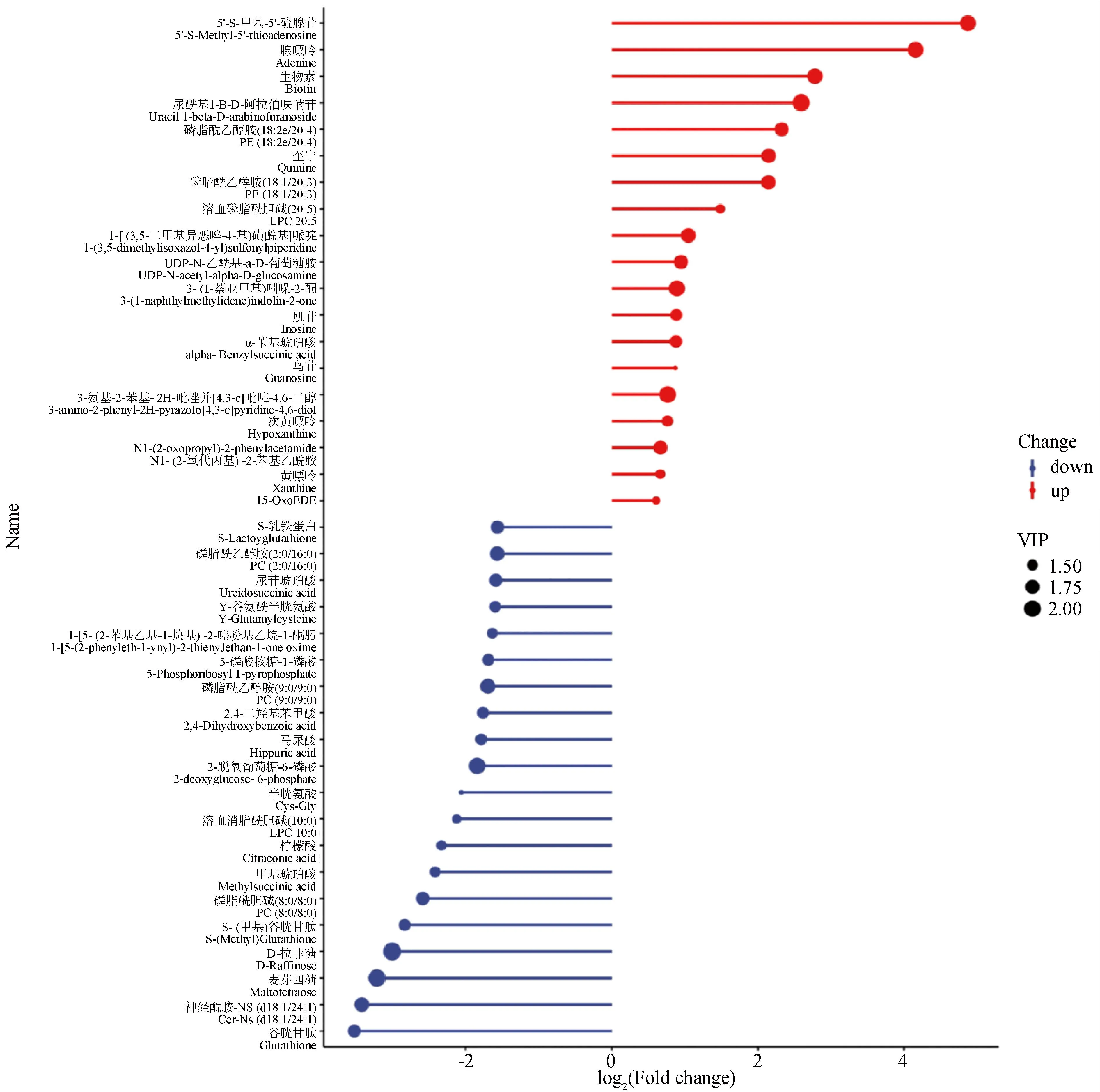
(图5 Fig.5)
2.2.2 差异代谢物分析 利用液相色谱-质谱技术,参比空白对照组,APS处理组共筛选出623个差异代谢物,其中差异显著的代谢物总数为89个。在差异显著的代谢物中,下调的差异代谢物为70个,上调的差异代谢物为19个。根据组间差异比较组合得到的差异代谢物绘制火柴杆图,能够较为清晰的表示代谢物的上、下调以及差异倍数变化较大的物质。以log2(Fold change)进行排序,分别取前20的上调/下调代谢物进行火柴杆图的展示。其中5′-S-甲基-5′-硫腺苷、腺嘌呤、生物素等显著上调;谷胱甘肽、神经酰胺、麦芽四糖等显著下调(图5)。
2.2.3 差异代谢物KEGG通路富集分析 对APS处理组和空白对照组的差异表达代谢进行KEGG通路富集分析,主要涉及的通路包括细胞转化、环境信息过程、遗传信息过程、代谢和有机系统5类,包括氨基酸代谢、类脂物代谢、辅助因子和维生素的代谢、核苷酸代谢等20条通路发生变化(图6)。
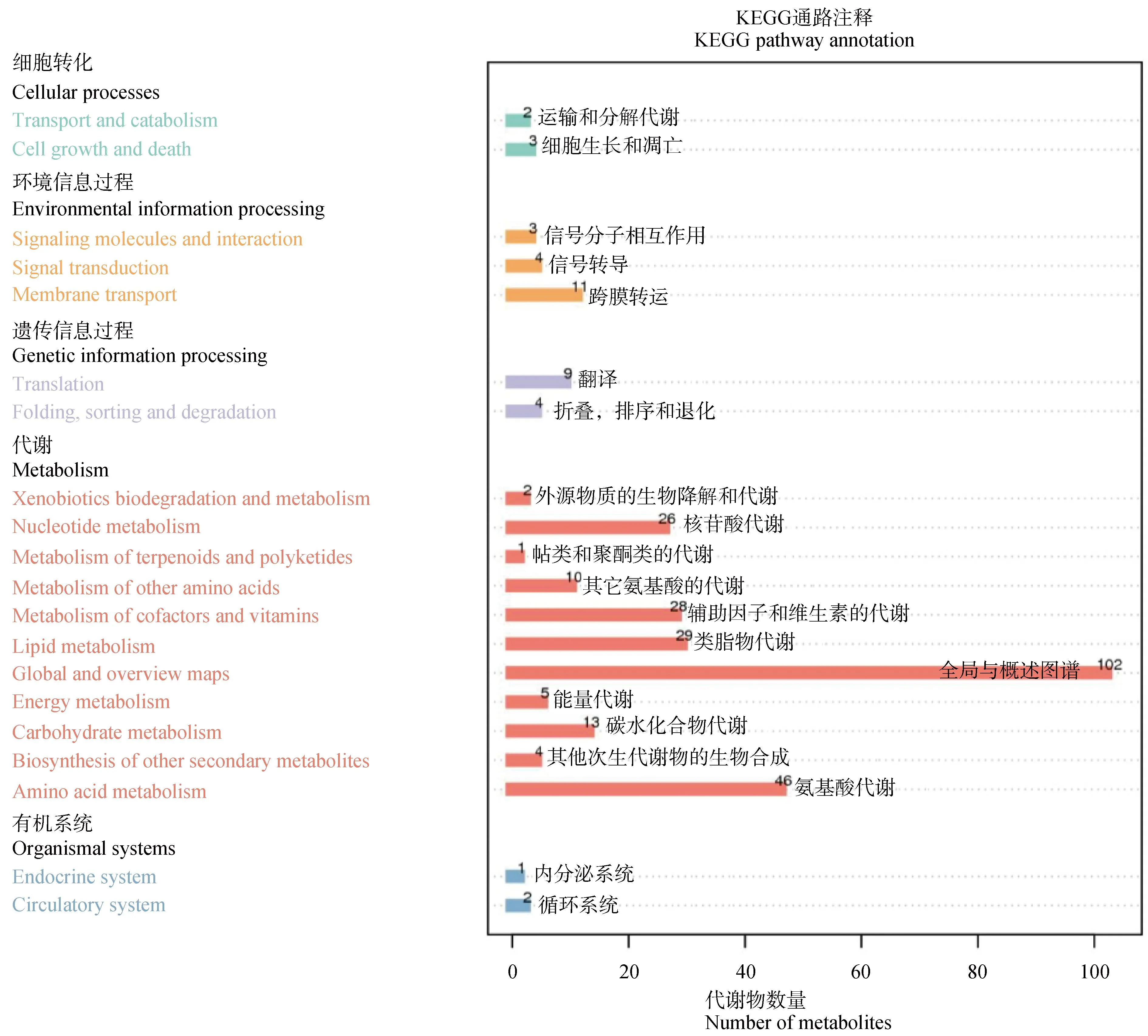
图6 KEGG富集柱状图Fig.6 KEGG enrichment bar graph
2.3 APS处理组与空白对照组的转录组和代谢组联合分析
2.3.1 基因分析差异结果 转录组与代谢组是检测特定状态下生物个体、组织或细胞的基因和代谢物的表达水平。APS处理组与空白对照组比较在上调中有415个显著差异的基因,有19个显著差异的代谢物;在下调中有430个显著差异的基因,有70个显著差异的代谢物。
2.3.2 代谢与转录KEGG富集分析 基于代谢与转录同一比较对的KEGG富集结果,以KEGG pathways为条目,获取代谢、转录共同富集到的通路,可信度排名前十的代谢通路主要有嘌呤代谢、碳代谢、磷酸戊糖途径、谷胱甘肽代谢、组氨酸代谢、氨基糖和核苷酸糖代谢、α-亚麻酸代谢、ABC转运体、铁死亡和酪氨酸代谢(图7)。
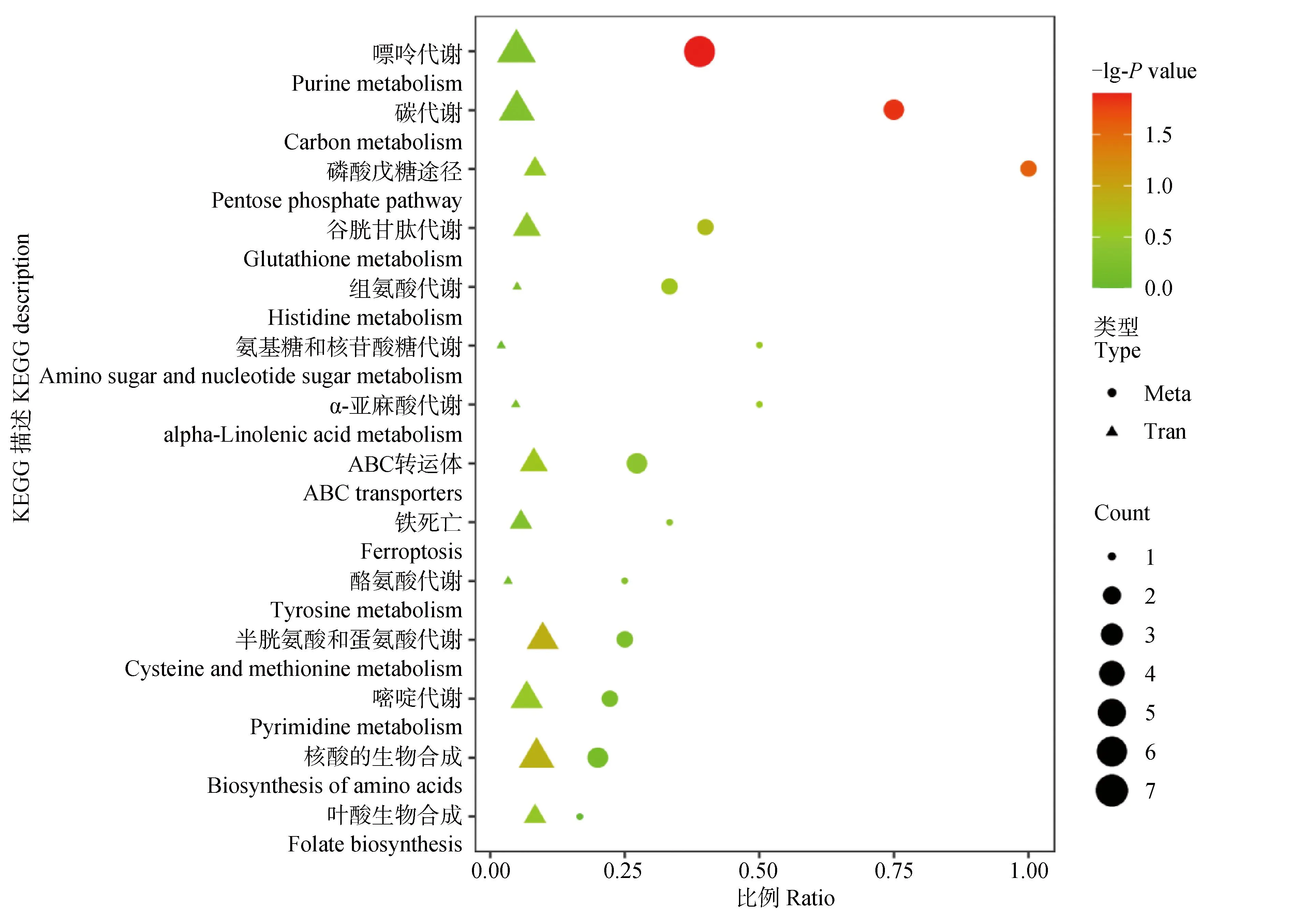
Meta 代谢(圆点是代谢数据),Tran 转录(三角是转录数据;P value是通路富集(转录或代谢)的P value;value是通路中富集的代谢物或基因的个数,通路中富集的是该通路中富集到的差异代谢物或差异基因与该通路中注释到的代谢物或基因个数的比值Meta metabolism (dots are metabolic data), Tran transcription (triangles are transcriptional data; P value is the pvalue of pathway enrichment (transcription or metabolism); Count is the number of metabolites or genes enriched in the pathway, and Ratio is the ratio of differential metabolites or genes enriched in the pathway to the number of metabolites or genes annotated in the pathway
3 讨 论
APS是一种具有免疫调节活性的多糖,其对机体巨噬细胞的调节作用机制研究是近年来的研究热点。然而有关其对鸡巨噬细胞的调节作用机制尚不明确。基于前期研究结果,作者推测APS可能是通过相关信号通路和糖代谢相关途径的调控,对HD11细胞发挥免疫增强和训练免疫作用。因此,本研究利用转录组和代谢组学技术,对50 μg·mL-1处理的HD11细胞与对照组HD11细胞进行差异分析,旨在为APS的天然免疫调节机制研究提供理论和科学依据。在转录组结果中,APS处理组与空白对照组共筛选出差异基因845个,APS处理组415个基因表达较空白对照组上调、430个基因表达下调;APS处理组与空白对照组的224个差异基因富集于113条KEGG通路,差异表达基因主要在细胞因子-细胞因子受体相互作用、Toll样受体信号通路、吞噬体、AGE-RAGE等信号通路上富集。
炎症因子主要是由单核/巨噬细胞或淋巴细胞产生的细胞因子,包括IL-1或、IL-6、IL-8、TNF-或等[21-22],参与机体多种疾病的炎症、感染和免疫等多种生理病理过程[23]。结果发现,APS处理组促进IL-8、CXCL13及CCL4的转录,抑制CCR5、IL-12的转录。Toll样受体是一类天然免疫模式识别受体,在病原微生物免疫和诱导快速防御反应激活中具有重要作用[24]。TLRS在不同宿主中存在多态性,且由于宿主生存环境存在的差异,导致TLRS信号途径介导的宿主免疫系统调节分子机制具有差异性[25]。在Toll样受体信号通路中,以往植物多糖的研究主要集中在TLR4上[26-28],而本研究结果显示,APS促进HD11鸡巨噬细胞IL-8L1、TLR1B、CCL4和TLR1A的转录,抑制TLR2A、TLR2B、IL-12B、FOS、TLR3和MAP2K7的转录。作者在前期研究中也发现,与哺乳类动物不同,APS和LPS抑制TLR2和TLR4的转录,且APS对TLR2 mRNA更加敏感[29]。另在LPS处理12 h的HD11细胞转录组分析中,也发现TLR2信号通路受到主要富集,其中,TLR1和TLR2为下调差异基因;CCL5、IL-8为上调差异基因[30-31]。通过与已有试验结果和相关文献的比对,作者推测50 μg·mL-1APS对HD11细胞的免疫调节作用与TLR2信号通路调控相关。
近年来研究表明,糖代谢重编程是巨噬细胞极化的根本原因[32],其作为免疫刺激与表观遗传修饰的重要链接,也是训练免疫形成的重要机制[33]。在转录组结果中,作者还发现ACSS2 (糖酵解关键酶基因)、iNOS(参与细胞传导和免疫调节的关键酶基因)、ATP6V0(在细胞代谢功能和抑炎性表型都具有重要作用)、MTA(一种甲基转移酶抑制剂)显著性上调,H6PD(H6PDH,是磷酸戊糖途径NAPDH合成的关键酶,与G6PDH具有相似的反应特点)、PRPS2(核苷酸合成途径中一种重要的限速酶)显著性下调。在代谢组结果中,作者发现APS处理组显著性上调差异表达代谢物主要有5′-S-甲基-5′-硫腺苷、腺嘌呤、生物素等;显著性下调差异表达代谢物主要有谷胱甘肽、神经酰胺、麦芽四糖等,且差异代谢物主要在5-磷酸核糖-1-焦磷酸代谢、腺嘌呤、次黄嘌呤等通路上富集。在转录组与代谢组联合分析结果中,作者发现嘌呤代谢、碳代谢(包括三羧酸循环、糖酵解)、磷酸戊糖途径、谷胱甘肽代谢等是APS处理组的主要富集代谢途径。研究发现在免疫作用刺激下,细胞中代谢重新编程包括葡萄糖摄取增加,糖酵解速率提高,磷酸戊糖途径上调以及通过TCA循环的氧化磷酸化水平降低[34]。因此,可以看出50 μg·mL-1APS对HD11细胞的免疫调节作用与糖酵解、磷酸戊糖的代谢重编程相关。
4 结 论
50 μg·mL-1APS对HD11细胞的免疫调节作用机制与TLR2受体信号通路、糖酵解、磷酸戊糖的代谢重编程相关,但其分子调节机制仍需在蛋白水平、关键代谢基因及代谢产物表达水平上进一步验证。
