脯氨酸羟化酶(PHDs)对动物骨骼肌发育和脂肪沉积的调控作用及其机制
2024-04-02梁淑怡江青艳王松波
梁淑怡,李 凡,江青艳,王松波
(华南农业大学动物科学学院 广东省动物营养调控重点实验室 优百特脂立方功能性脂肪酸研究中心,广州 510642)
骨骼肌和脂肪是动物机体的主要组成部分,同时,骨骼肌发育及脂肪沉积也会直接影响畜禽的产品品质。动物骨骼肌发育和脂肪沉积都是复杂且有序的生理过程。骨骼肌的大小主要由肌纤维的数量以及肌纤维的肥大决定,肌纤维的数量在动物胚胎期就基本固定了,而肌纤维的肥大以及肌纤维的类型对畜禽的产肉性状起着重要作用[1]。脂肪沉积主要通过脂肪细胞的数量增加和体积增大来实现[2]。骨骼肌发育和脂肪沉积过程受到多种因素的调节,具体的调控机制尚不完全明了。脯氨酸羟化酶(proline hydroxylases,PHDs)是一类非血红素铁依赖性双加氧酶,可使靶蛋白的脯氨酸发生羟基化。近年的研究表明,PHD在肌肉发育和脂肪沉积过程中发挥着重要作用,其可以通过调控血管生成、肌肉纤维化、脂质代谢等多种生理过程,从而间接影响畜禽胴体品质和肉品质。
1 PHD的结构与功能及活性调节
1.1 PHD的结构与功能
脯氨酸羟化酶(proline hydroxylases,PHDs)作为一类非血红素铁依赖性双加氧酶,是缺氧诱导因子(hypoxia inducible factor,HIF)信号通路的重要调控因子。此外,它还可以通过多种机制调节细胞内氧适应水平、细胞凋亡、细胞代谢和细胞转运等方面,从而参与多种生理活动的发生。现已发现4个家族成员,分别是PHD1、PHD2、PHD3和PHD4,已有的研究大多涉及PHD1、PHD2和PHD3的生理功能,对PHD4的研究报道较少[3]。这几种亚型的氨基酸序列相似性为42%~59%,在C末端结构域具有较高的序列同源性,在N端有明显不同[4]。因此,他们虽结构相近,但也有不同。PHD2在氨基端具有一个PHD1和PHD3都不具备的特殊催化结构——锌指结构,这个结构在线虫EGL-9(egg laying-9)基因中也存在。并且编码PHD1、2、3的基因与EGL-9基因同源[5-6]。可以推测PHD2与EGL-9的同源性更高,因此,PHD2具有和EGL-9蛋白相同的羟基化HIF蛋白的功能,且在PHDs家族中该成员生理活性最高。
PHDs在动物机体内主要的生理功能为羟基化目标蛋白的脯氨酸残基,从而影响靶蛋白的稳定性和功能。最典型的就是羟基化HIF-1α,其中活性最强的是PHD2,PHD3次之,PHD1活性最小[5]。HIF-1是由α和β亚基组成的异源二聚体,常氧条件下,PHDs以O2和α-酮戊二酸为底物,以Fe2+作为辅助因子,可以识别HIF-1α上第402位和第564位的脯氨酸残基,使之发生羟基化,进而经希佩尔林道蛋白(von Hippel-lindau tumor suppressor protein,pVHL)介导而进行泛素化降解。在缺氧条件下,PHDs羟基化活性下降,阻碍了HIF-1α的降解,使HIF-1α稳定表达并积累,从而激活下游靶基因,开启相应的表达调控,如图1所示[7-9]。此外,PHDs还可以羟基化其他蛋白,例如PHD2可以羟基化UCP1的Pro-33,133,232位点,以调控脂肪产热等。
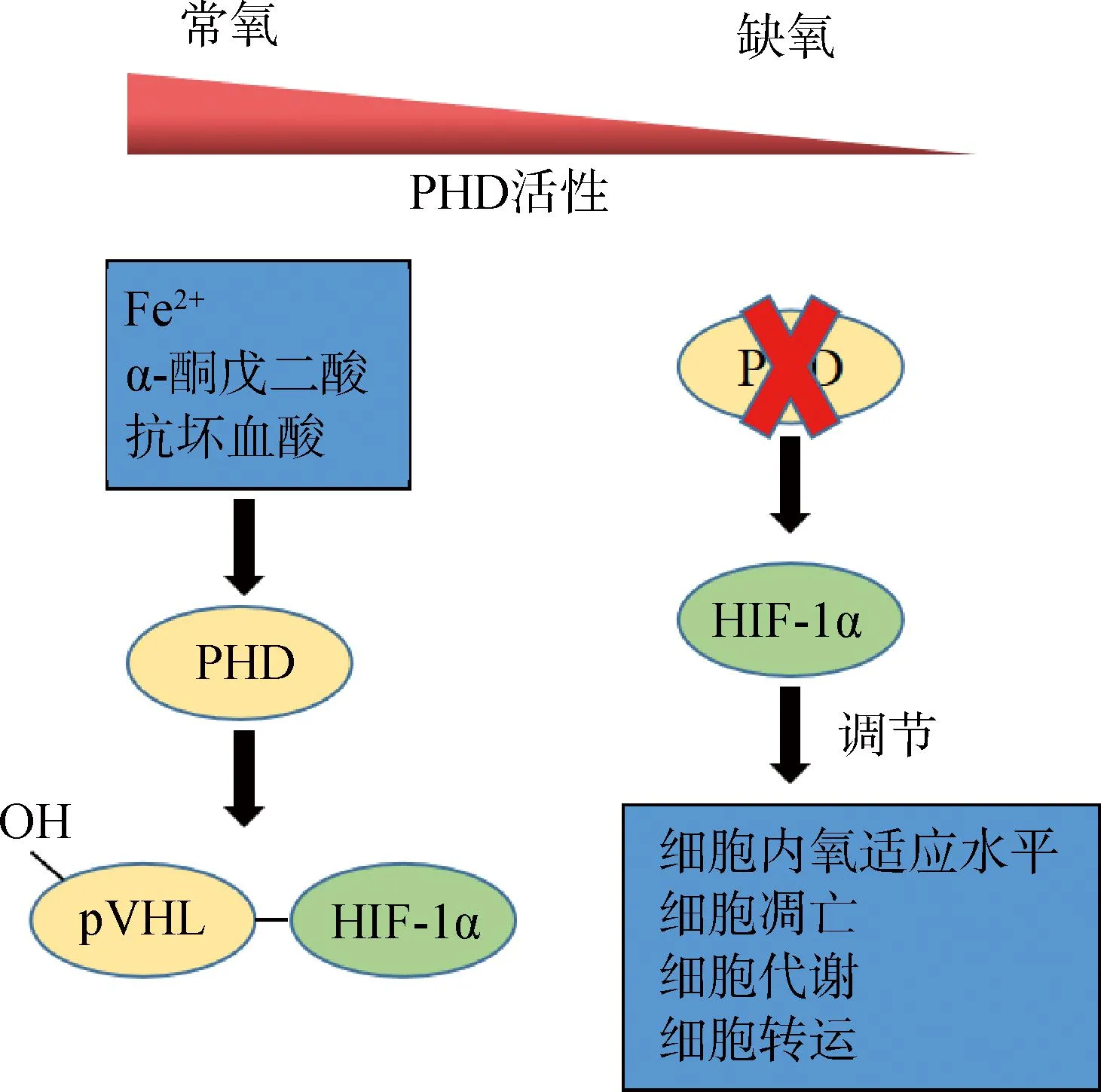
图1 脯氨酸羟化酶的生理功能Fig.1 Physiological function of proline hydroxylase
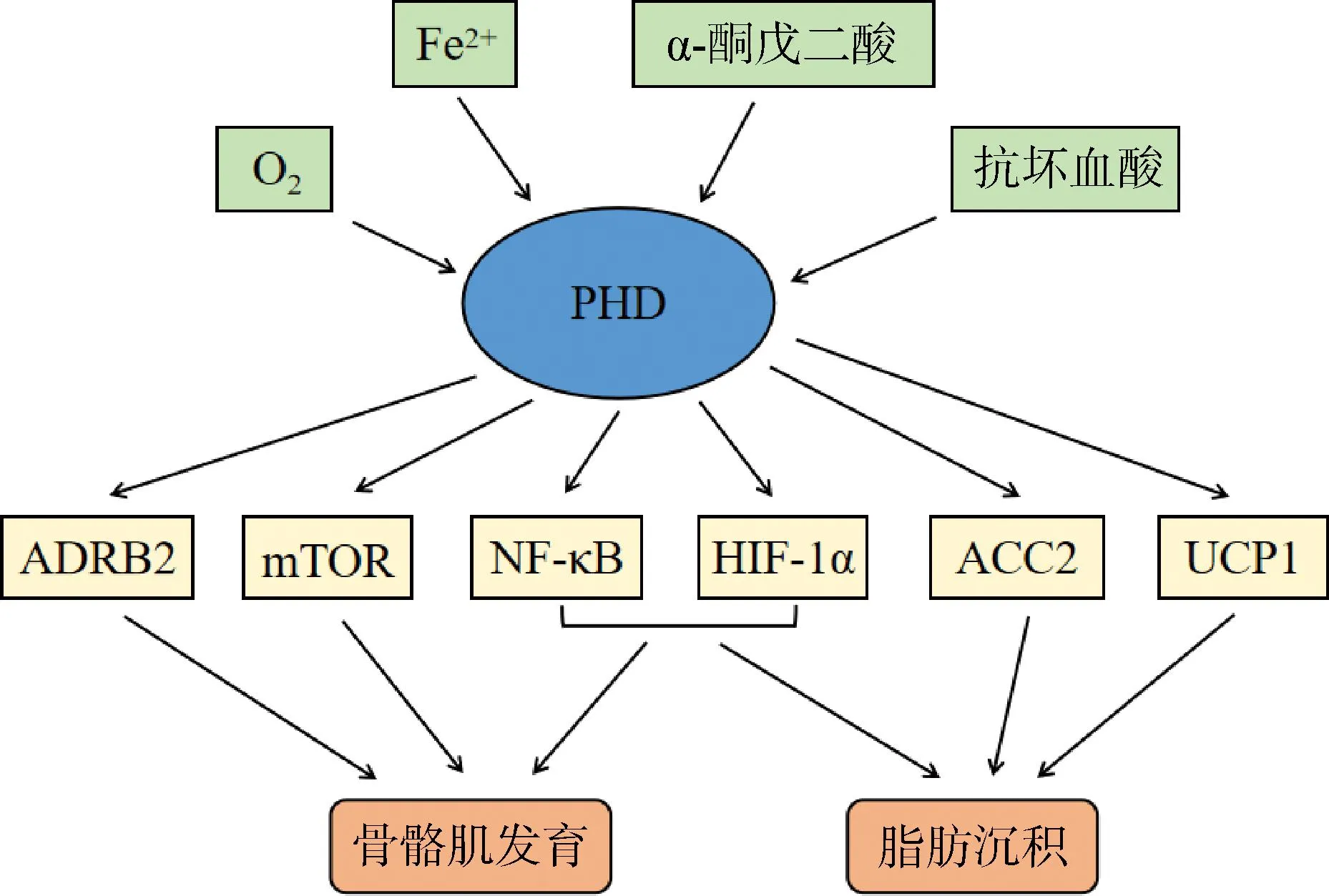
图2 PHD调控骨骼肌发育和脂肪沉积的可能机制Fig.2 Possible mechanisms of PHD regulating skeletal muscle development and fat deposition
1.2 影响PHD活性的因素
研究表明,PHDs的活性受氧分压、铁的螯合物、抗坏血酸、α-酮戊二酸、一氧化氮(NO)、胰岛素、血管紧张素等多种因素的调节[9-11]。
PHD作为细胞氧感受器,活性受到氧气浓度的调节。有研究发现,在缺氧的条件下,PHD的活性下降,导致HIF-1α蛋白的累积,进而激活HIF信号通路,而持续激活的HIF信号通路,又会通过负反馈作用调控PHD的表达[12]。此外,NO对PHD的活性也有一定调控作用。在常氧条件下,NO通过稳定HIF来调节PHD活性[10]。
研究发现,在网织红细胞的裂解产物中,铁含量越少,PHD的活性就越大。铁与PHD之间的关联复杂,具体机制还有待进一步探究[13]。此外,一些二价金属离子,如Co2+、Ni2+、Mn2+等,也可以抑制PHD的活性[14]。
α-酮戊二酸作为PHD发挥酶活性重要的辅助因子起着关键作用。α-酮戊二酸可被谷氨酰胺酶和谷氨酸脱氢酶催化,这些酶可以协调Fe2+的活性,导致底物的电子氧化,激活PHD下游基因。α-酮戊二酸的类似物,如甲基乙二酰基甘氨酸(dimethyloxalglycine,DMOG),可竞争性抑制PHD的活性[10-11,15-16]。此外,三羧酸循环的中间产物如延胡索酸、琥珀酸盐、草酰乙酸等的积累也可以抑制PHD的活性[17]。
抗坏血酸在常氧条件下可以减少HIF-1α的积累,但在用α-酮戊二酸类似物阻断PHD活性时其效果消失,这表明抗坏血酸与PHD活性有关[18]。
2 PHD对骨骼肌生长发育的调控作用及机制
骨骼肌是动物体的重要组成部分,在调控机体运动和代谢稳态方面起着非常重要的作用[19-20]。在畜禽生产当中,骨骼肌的发育直接决定了畜禽产品的产量及品质。动物骨骼肌的生长是一个较为复杂的生理过程,在胚胎期骨骼肌生长主要体现在肌纤维的生成和数量增加,而动物出生以后,骨骼肌的生长主要依靠肌纤维的肥大来实现[21]。动物骨骼肌的生长受到不同的内源性基因和转录因子的调控,此外,一些信号通路可以介导骨骼肌生长的调控,例如,Wnt信号通路[22]、PI3K-AKT信号通路[23]和HIF信号通路[24]等。
2.1 PHD对骨骼肌发育的调控
骨骼肌的发育涉及成肌细胞的增殖、分化和肌纤维的形成等。PHD各个亚型在骨骼肌以及在C2C12成肌细胞中均有表达,并且,在C2C12分化的过程中,PHD3的表达水平增加[25]。成肌细胞培养过程中,氧分压变化可以影响成肌细胞的增殖分化能力[24],而PHD的活性受氧分压的调控。骨骼肌的形成主要由生肌调节因子(myogenic regulatory factors,MRFs)协调,包括肌细胞生成素(myogenin,MyoG)、成肌分化抗原(myogenic differentiation antigen,MyoD)、生肌因子5(myogenic factor 5,Myf5)和MRF4[26]。而据报道,PHD3可与这些调节因子相互作用[25],进一步证实了PHD3对骨骼肌生长的调控作用。
在PHD1敲除的小鼠中,肌肉质量减少[27]。PHD1敲除对亮氨酸的反应显示mTORC1(mechanistic target of rapamycin complex 1)激活受损,mTORC1是一种重要的肌肉质量调节器。PHD1促进mTORC1活性的能力与其羟基化活性无关[28],而与亮氨酰tRNA合成酶(LRS)亮氨酸传感器蛋白含量的降低有关[29]。PHD1在机制上与LRS相互作用并稳定LRS。这种相互作用在氧和氨基酸消耗期间被促进,并保护LRS免于降解。
此外,有一些研究指出,PHD可以通过调节毛细血管的密度参与调控肌纤维的生成。例如,PHD2缺失导致骨骼肌中肌纤维的转化,并且在I型纤维的比例增加的区域,其毛细血管密度也增加[30]。在该团队的后续研究中,对小鼠进行为期4周的跑步训练,发现与对照组相比,PHD2骨骼肌特异性敲除不仅增加了毛细血管的数量,骨骼肌中每个区域的肌纤维数量也有所增加[31]。
PHD还可以影响骨骼肌代谢,例如,PHD3可以通过ACC2的羟基化介导骨骼肌组织中脂肪酸的氧化,从而影响肌肉的运动能力。在高能量条件下,ACC2羟基化可以抑制脂肪酸氧化[32]。PHD3缺失的小鼠骨骼肌中ACC2羟基化缺失,从而导致脂肪酸氧化升高。AMPK在许多细胞类型的低营养条件下都很活跃,在低葡萄糖条件下ACC2磷酸化增加[33],而在ACC2中观察到的相反的羟基化则受AMPK负调控。ACC2物理结合PHD3[34],磷酸化ACC2会降低PHD3的活性。另外,PHD3可以介导AKG调节骨骼肌蛋白转换的过程,当PHD3过表达时,PHD3羟基化ADRB2,阻断AKG在C2C12肌管中的抗蛋白降解作用[35]。PHD3还可以通过羟基化NF-κB信号通路关键因子来调节肌肉发育过程中的蛋白质转化,从而抑制肌肉发育过程中的蛋白质合成[36]。
此外,本团队对猪不同骨骼肌组织中PHDs、骨骼肌生长相关信号分子的表达进行检测,猪腰大肌中PHD3表达水平远高于背最长肌。骨骼肌生长基因的表达与PHD3水平呈负相关,而骨骼肌蛋白质降解基因的表达与PHD3水平呈正相关(数据未发表)。说明PHD3可能在猪骨骼肌生长发育中发挥重要作用,提示PHDs可能参与肉品质调控。
2.2 PHD对骨骼肌损伤和再生的调控
骨骼肌组织在肌外伤后具有很高的再生能力,机械性软组织创伤有缺血性和炎症性缺氧两种,这表明HIF在肌外伤中有一定作用[37]。而PHD作为HIF通路的重要调控因子,对骨骼肌的再生可能存在一定影响。确有研究证明,PHD1和PHD3的敲除可以通过激活HIF-1α,促进骨骼肌内的血管生成,并改善缺血性的骨骼肌损伤和炎症反应[38-39]。PHD2缺失可增强小鼠软组织创伤后骨骼肌组织的再生[40]。
而在PHD1敲除的小鼠中,PHD1氧传感器的丢失会减少肌肉质量[27]。此外,干扰PHD1或PHD3活性的小鼠表现出腓肠肌纤维化程度降低,并缓解缺血损伤后的肌肉质量损失[39]。类似的,肌肉注射红景天苷来抑制PHD3的转录活性,可激活骨骼肌细胞的旁分泌信号,进而激活骨骼肌细胞、内皮细胞和平滑肌细胞之间的通讯,促进内皮细胞和平滑肌细胞的活性[38]。
肥胖会导致肌肉质量下降和肌肉再生受损,据研究显示,在肥胖状态下病理性增加的PHD2会导致肌肉再生受损,同时观察到血管内皮生长因子(vascular endothelial growth factor,VEGF)表达水平显著下降,而在肥胖状态下抑制PHD2活性可使肌肉恢复再生潜力[41]。
综上所述,PHD缺失可以促进成肌细胞增殖分化、肌纤维类型转化、肌纤维数量增加以及骨骼肌再生等,对骨骼肌生长发育起着重要调控作用。
3 PHD对脂肪沉积的调控作用及机制
脂肪组织是机体内重要的能量存储、内分泌以及代谢器官,对于维持机体能量稳态和产热供能具有重要作用。动物体内脂肪的沉积主要靠脂肪细胞数量增加、脂肪细胞肥大两种途径[42-43]。
3.1 PHD对脂肪生成与代谢的调控
PHDs可能是脂肪细胞的成脂分化以及脂肪代谢过程中重要的调控因子。
在对脂肪细胞的研究中发现,在诱导3T3-L1前脂肪细胞成脂分化过程中,PHD的3个亚型均有表达。PHD1在脂肪生成早期表达,PHD2和PHD3则在脂肪生成晚期表达[44]。在脂肪生成的初始阶段,抑制PHD的活性,会降低PHD的基因表达,进而阻断脂肪细胞的形成[44]。还有研究探索了PHD在罗格列酮诱导的脂肪细胞分化期间所起的作用,发现在脂肪细胞分化期间,3种PHD亚型在脂肪细胞中表达上调,而抑制PHD可使抗脂肪生成蛋白如GATA-3、KLF-2的水平增加[45]。以上结果说明,PHD可能参与调控脂肪的生成。
在活体上,有研究表明,不论是在普通日粮还是在高脂日粮饲喂的条件下,PHD2敲除的小鼠与野生型小鼠相比,脂肪组织减少,脂肪细胞也相对更小。PHD2敲除小鼠白色脂肪组织(white adipose tissue,WAT)中脂解标记物Lipe和Pnpla2的mRNA水平增加[46]。此外,PHD抑制剂也可导致肥胖症小鼠WAT的质量显著降低,脂肪细胞大小减少,同时伴随着血浆脂联素的恢复以及脂质代谢的改善[47]。脂联素是脂肪细胞分泌的一种具有生物活性的蛋白质,其表达水平与胰岛素抵抗、肥胖和2型糖尿病呈负相关。有报道显示,PHD是脂联素产生和多聚化所必需的[48]。另外,PHD3缺失会激活促炎IKKβ/NF-κB信号通路,而减轻脂肪组织炎症可以介导脂质代谢的改善[47]。PHD3通过阻断IKKβ的磷酸化来抑制NF-κB信号,而这些磷酸化不依赖于羟基化。
此外,PHD可影响肝的脂肪沉积。缺氧影响肝脂质代谢并扰乱肝脂质积累,缺氧信号传导也是脂肪组织功能障碍的关键,会导致脂肪组织纤维化、炎症和胰岛素抵抗。而PHD作为主要的细胞氧传感器,自然也是关键调节因子[49]。PHD1敲除小鼠在正常饲喂条件下肝的重量降低,肝组织脂肪变性和炎症增加[50]。在PHD2或PHD3敲除的小鼠肝中,脂肪酸合成以及脂肪生成减少[46,51-52]。
本团队对猪不同脂肪组织中PHDs、脂肪沉积相关信号分子的表达进行检测,发现PHD2在猪不同脂肪组织中的表达存在差异,且与脂质合成相关基因的表达呈正相关(数据未发表)。说明PHD2可能在猪脂肪沉积中发挥重要作用。
3.2 PHD对脂肪产热的调控
目前,激活褐色脂肪产热被认为是减少肥胖的一种思路,通过激活脂肪产热来减少脂肪的沉积。褐色脂肪组织是哺乳动物体内非颤栗产热的主要来源,对于维持动物的体温和能量平衡起重要作用。解偶联蛋白1(uncoupling protein 1,UCP1)作为褐色脂肪产热的标志性蛋白,通过将氧化磷酸化与ATP合成解偶联,把底物氧化产生的能量转化为热能,以此促进棕色脂肪产热[53]。
而有研究表明,PHD2在褐色脂肪组织中的表达明显高于在白色脂肪组织中的表达,并且小鼠全身脂肪PHD2选择性敲除,通过激活HIF信号通路激活了小鼠的褐色脂肪并增加能量消耗[54]。不同的是,在本实验室的研究中,在活体小鼠褐色脂肪上特异性敲除PHD2,显著抑制了褐色脂肪的产热过程,发现PHD2可以直接与线粒体产热蛋白UCP1结合,通过促进UCP1蛋白的羟基化修饰,增加UCP1蛋白稳定性和表达,并协同AMPK信号通路促进褐色脂肪产热,以减少脂肪沉积[55]。然而,PHD对脂肪沉积的调控机制复杂多样,更多的调控路径仍有待进一步研究。
综上所述,抑制PHD可减少动物体脂肪沉积、脂肪酸摄取及脂肪变性等,PHD还可以参与褐色脂肪组织的产热,这为PHD作为营养调控靶点改善畜禽产品品质提供了科学依据。
4 小 结
本文在介绍PHD生理功能的基础上,阐述了其在骨骼肌发育及脂肪沉积方面的调控作用及可能机制,为生产上提高畜禽产品的产量以及品质提供了新的靶点。此外,PHD抑制剂也有望在畜禽生产中起到作用。目前的PHD抑制剂大多是广泛的抑制,但PHD家族各个成员的作用都有不同,其具体机制并不十分明确,有待进一步研究。因此,寻找PHD亚型特异性的抑制剂,或能为将来应用于生产开辟新的道路。
