冷热应激对肉牛生理指标及基因表达影响的研究进展
2024-04-02栾庆江王婷月田如刚
王 潇,张 昊,栾庆江,李 慧,杨 鼎,王婷月,田 菁,赵 濛,陈 陆,田如刚*
(内蒙古自治区农牧业科学院,呼和浩特 010031)
应激反应是指动物在受到外界频率较大,持续时间较长(或短但变化剧烈)的刺激时,机体内环境稳定性、生理指标等发生改变,进而影响到机体健康程度的一种反应,产生的主要原因包括极端温度、运输和转场等方面[1],而由外界温度变化产生的冷热应激,是诸多应激反应中较为常见的一种,可从多个方面对机体健康产生不利影响。
在肉牛产业中,饲养环节既是基础部分,又是最重要的环节,而在饲养过程中产生的冷热应激,可对肉牛的能量代谢产生影响并降低群体健康状况。已有研究发现,在热应激状态下肉牛群体的采食量、生长效率较非应激状态普遍降低[2-3],而严重的冷应激也会对干物质摄入量(DMI)和耗水量产生负面影响[4]。总之,冷热应激可从生产效能、存活率、繁殖率等多个方面造成经济损失,进而影响肉牛产业的发展。所以,如何降低冷热应激对机体产生的影响,改善肉牛冷热应激情况下的健康状况,是肉牛产业发展亟需解决的问题。
在动物体内,生理生化和免疫指标可表征机体的生理功能状况与健康程度。在应激状态下,动物个体的内环境稳定性会发生变化,进而造成血液生理生化和免疫指标较非应激状态下出现显著差异[5]。本文从冷热应激的评判标准和产生地域入手,基于冷热应激的产生机制,对冷热应激下不同地区、不同品种的肉牛血液内分泌、免疫、抗氧化等生理生化指标变化情况进行概述,挖掘对冷热应激起到调控作用的基因和调控因子,讨论并展望了缓解肉牛冷热应激的可行性方法,从而为促进我国肉牛产业的高质量发展提供理论参考。
1 冷热应激的评判标准及调控机理
1.1 肉牛冷热应激的评判标准
外界温度变化是否对机体产生冷热应激的辨别标准包括温湿度指数(temperature humidity index,THI)和综合气候指数(comprehensive climatic index,CCI)等[6-7]。
THI可基于温度和湿度评价肉牛机体应激状况,其计算公式为THI=(Td + Tw) + 40.6(Td为干球温度;Tw为湿球温度),当THI<72时,肉牛群体为无应激状态;当THI>72时,可分为轻度(72~79)、中度(79~88)和严重热应激(大于88)3个程度。不同程度的高温高湿气候可导致肉牛的自身散热功能受到不同程度的阻碍,进而产生非特异性的生理防御应答,并导致热应激的产生[6,8]。
而CCI的评价方法,除了考虑温度和湿度,还将风速和阳光辐射度考虑在内,在评价冷应激时,更具有说服意义[4]。此外,风寒指数(wind chill index,WCI)和热负荷指数(heat load index,HLI)也可分别用来评判冷、热应激[9]。
1.2 冷热应激出现的范围
冷应激根据环境低温程度和机体暴露在寒冷气候的时长,可进一步分为急性冷应激和慢性冷应激2种类型[10],这2种冷应激均会对肉牛群体的健康情况产生影响。我国大部分地区属于大陆性季风气候,冬季受到西伯利亚冷气团的控制,气候寒冷,在内蒙古自治区呼伦贝尔市、赤峰市、通辽市、锡林郭勒盟等地,以及新疆、黑龙江、吉林等一些纬度可达北纬45°左右的重要肉牛养殖地区,冬天的室外温度会降至-20 ℃以下,部分地区甚至可达-30 ℃~-40 ℃,不同品种的肉牛在此环境下,均会产生冷应激现象。而在国外如加拿大阿尔巴塔省、安大略省,以及美国俄亥俄州五大湖附近等同纬度的部分地区,冬季极端低温和频繁出现的暴风雪也可导致肉牛群体出现冷应激状况,而在更高纬度的加拿大北部的魁北克省和俄罗斯远东地区纬度可达50°以上,极端温度会降至更低,且一天内暴露在极冷环境下的时间更长,造成的冷应激现象较低纬度地区就更为严重。
肉牛群体热应激现象在我国大部分地区夏季均会出现。主要分布在北纬30°附近及以南的四川、重庆、云南河谷以及长江中下游平原等地,这些地区夏季的平均温度均可达到30 ℃左右,湿度可达70%以上,且持续时间可达20 d以上,长时间的高温高湿可对肉牛机体内环境产生影响,进而产生热应激。而在赤道附近如东南亚的印度北方邦、中央邦等地区,以及非洲尼日利亚等国家的部分地区,这些地区年平均气温更高,且湿度更大,热应激现象常年都会出现,严重制约了当地肉牛产业的发展。
1.3 冷热应激的调控机理
机体在受到外界刺激产生应激后,可通过下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA)、下丘脑-垂体-甲状腺轴(hypothalamus-pituitary-thyroid axis,HPT)和交感神经-肾上腺髓质轴(sympathetico-adrenomedullary,SAM)对应激进行调节[11-13]。
由HPA轴组成的调节系统为机体最主要的应激响应和调节系统[14],其作用机制为下丘脑接受到外界刺激后,产生促肾上腺皮质激素释放激素(corticotropin releasing hormone,CRH),CRH可刺激垂体前叶产生肾上腺皮质激素(adrenocorticotropic hormone,ACTH),ACTH可促进肾上腺皮质产生更多的糖皮质激素(glucocorticoid,GC),GC可提高机体肝糖原的异生作用,降低细胞因子的表达量,进而维持机体内环境稳定[15](图1)。
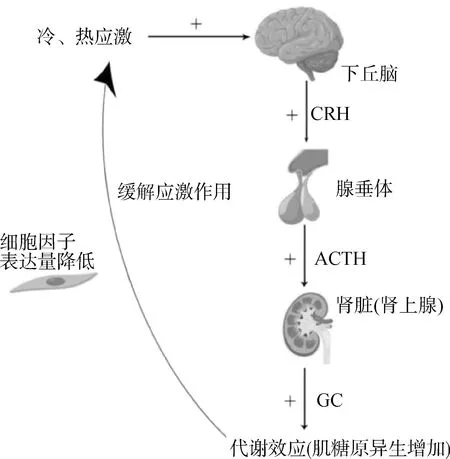
图1 HPA轴调节冷、热应激的机制Fig.1 The mechanism of HPA axis regulating cold and heat stress
HPT轴作用机制为在机体受到外界刺激产生应激后,下丘脑释放促甲状腺激素释放激素(thyrotropin-releasing hormone,TRH),TRH可刺激垂体产生促甲状腺激素(thyroid stimulating hormone,TSH),TSH可作用于甲状腺调控三碘甲状腺原氨酸(triiodothyronine,T3)和四碘甲状腺原氨酸(thyroxine,T4)激素的分泌水平[16-17],而T3和T4可调节细胞对糖原的利用,进而达到调节机体机能、改善应激状况的目的(图2)。此外,血液中的血清素可通过调节SAM轴对肉牛的冷、热应激产生影响[18]。
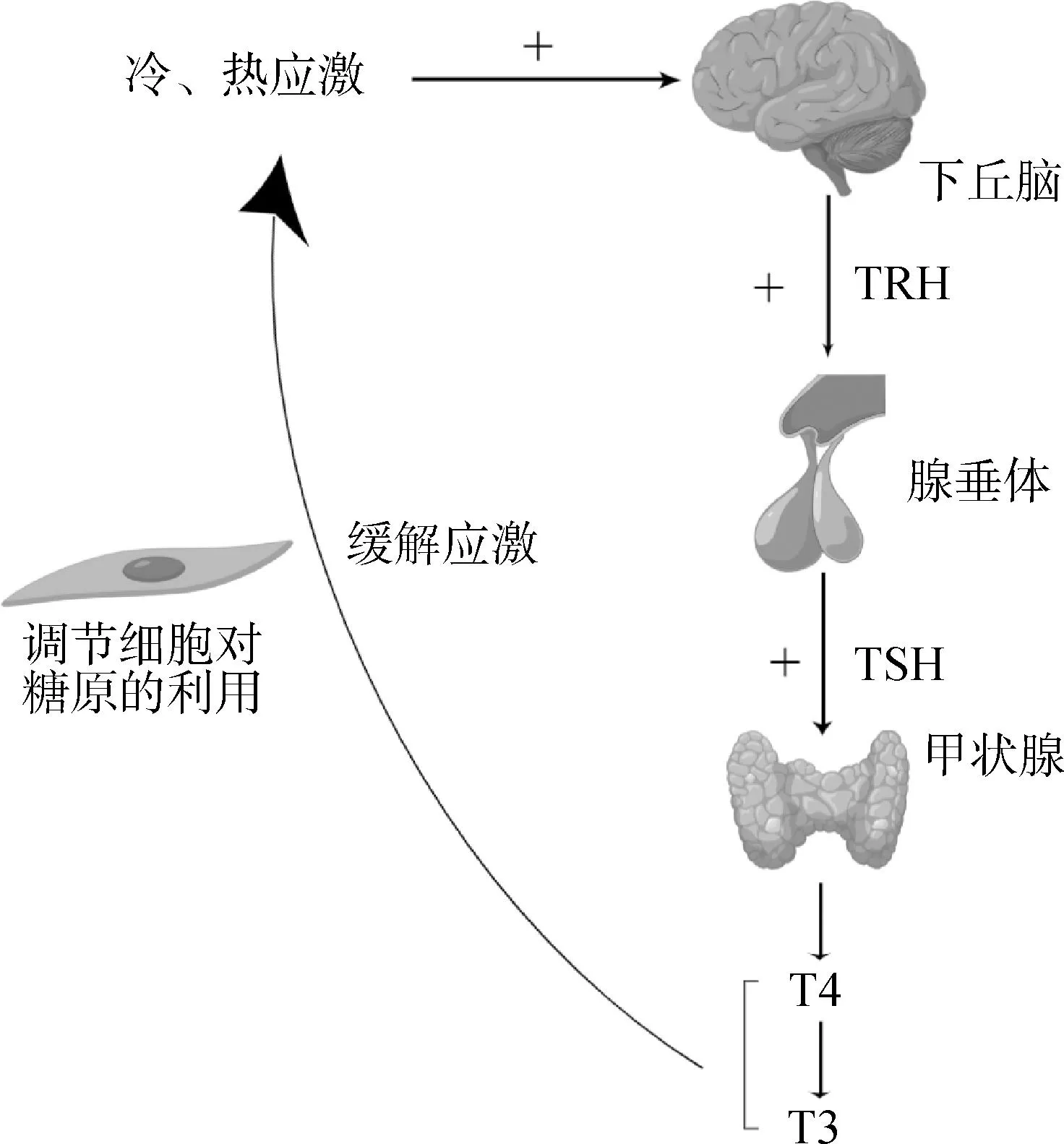
图2 HPT轴调节冷、热应激的机制Fig.2 The mechanism of HPT axis regulating cold and heat stress
2 冷热应激对肉牛血液生理生化指标的影响
2.1 冷热应激对肉牛血液内分泌相关指标变化的影响
当外界温度刺激导致机体产生冷热应激后,体内的交感神经系统可降低生殖系统和肾上腺系统的血流量,增加脑部、心脏和肌肉的血流量,从而缓解机体的应激情况,达到维持机体内环境稳定的目的[19]。这种途径可通过机体内HPA轴和HPT轴的调节完成,与之相关的激素表达量也随之发生变化。
在冷应激对肉牛血液内分泌相关指标影响的研究中,陈浩等[16]通过比对秋季和冬季锡林郭勒盟苏尼特左旗地区蒙古母牛血清中T3、T4、ACTH、GH、GC等激素指标,发现在冬季冷应激情况下,蒙古牛血清中ACTH、GC、T3、T4的含量显著升高,表明蒙古牛可通过HPA轴和HPT轴增强机体的糖原异生作用,从而提高机体对低温环境的抵抗力和适应性。此外,同一地区的西门塔尔牛在冷应激情况下与非冷应激情况相比,ACTH和GC的含量也会显著增高,表明西门塔尔牛也可通过HPA轴缓解冷应激[20],此外,已有研究发现荷斯坦牛在寒冷的环境下也可通过HPA轴调控冷应激[21]。
热应激同样会引起到血液内分泌指标的改变。蒙古牛和西门塔尔牛在发生热应激时,体内的T3、T4、ACTH、GC含量较热应激恢复期均出现不同程度的下降[20,22-23],表明这2个品种的肉牛均可通过降低体内代谢的方法缓解热应激。罗宗刚等[24]检测不同品种的杂交肉牛热应激后的内分泌指标,发现热应激情况下的红西本肉牛T4值显著低于其它群体,且部分体征指标较其它杂交群体和纯种群体相比趋于正常,表明此类杂交牛对热应激有更强的适应性,既肉牛品种与冷热应激之间可能存在一定联系。此外,Johnson和Vanjonack[25]研究发现,在31~35 ℃下的热应激时期,荷斯坦牛的甲状腺活动情况显著低于16.8 ℃的非应激时期,表明荷斯坦牛也可通过降低体内代谢率的方法减少产热,从而增加机体对炎热环境的适应性。
2.2 冷热应激对肉牛血液抗氧化相关指标变化的影响
动物机体在产生冷热应激时,会导致体内产生大量自由基,这些自由基导致细胞内脂质过氧化物改变,进而产生氧化应激反应[26]。超氧化物歧化酶(superoxide dismutase,SOD)是机体内重要的抗氧化酶,可通过清除体内多余的超氧阴离子自由基达到阻止细胞损伤的目的[27-28]。此外,由脂质过氧化物反应产生的丙二醛(malondialdehyde,MDA)也与机体抗氧化程度存在密切联系[29],而总抗氧化能力(Total antioxidant capacity,T-AOC)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)等指标的值也可反映机体的抗氧化能力水平[30]。
一般情况下,冷应激会造成不同年龄段肉牛血清中SOD和GSH-Px含量下降,MDA和T-AOC含量上升[31]。孟祥坤等[32]研究了慢性冷应激对西门塔尔杂交犊牛的影响,得到了相同的结论,并发现犊牛月龄越大,其对温度变化的适应越好。
热应激研究方面,郑海英等[33]对在夏季科尔沁肉牛的抗氧化指标进行检测,发现在夏季热应激情况下,科尔沁肉牛血液中SOD、T-AOC、GSH-Px含量较春季非应激情况下降,但MDA含量上升,表明机体为维持内环境稳定,SOD等大部分抗氧化酶被大量消耗,且发生脂质反应,从而导致MDA含量增加。此外,科尔沁肉牛与同地区的科尔沁牛相比,热应激时SOD、T-AOC、GSH-Px等抗氧化指标要明显偏高,表明科尔沁肉牛有更强的热应激适应性。也有研究发现,蒙古牛与西门塔尔牛和安格斯牛相比,具有更强的免疫性能和抗氧化性能[34-35]。以上研究可表明,热应激对抗氧化指标影响与肉牛品种有关,黄德均等[36]对红安格斯牛和其它肉牛杂交品种的研究也证实了该结果,而Tejaswi等[37]通过对印度不同品种瘤牛的研究也得到了相同结论。
2.3 冷热应激对肉牛血液免疫相关指标变化的影响
动物机体在受到外界冷热刺激后,体内的免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白G(IgG)等表达量上升,起到调节机体的作用,但过度的冷热应激会导致血清中IgA、IgM、IgG含量下降,从而导致免疫机能的下降。此外,机体在受到冷热应激时,体内的Toll样受体(toll-like receptors, TLR)可产生抗原呈递细胞,这些细胞可对机体固有的免疫应答产生关键调控,进而导致TLR2和TLR4、IL2和IL4等调控因子释放出预炎症因子,引起宿主的免疫反应[38-39]。
冷应激主要影响的免疫指标包括IL-2、IL-4、IgG[40]。Ebrahimi和Towhidi[41]通过对比西门塔尔牛、三河牛和荷斯坦牛在冷应激下免疫指标的变化,发现3个品种肉牛血液中IL-2、IL-4、IgG的含量均出现一定程度的下降,格日乐其木格[10]的研究也发现冬季冷应激时期的西门塔尔母牛较秋季非应激时候相比,IL-2、IgG指标变化显著,二者均证实了冷应激可对肉牛机体的免疫性能产生影响。
热应激方面,Bharati等[42]的研究发现塔帕卡牛在经过短期热应激刺激后其血液内TLR2、TLR4、IL2和IL4的含量较非热应激时均出现明显上升,表明这些指标与热应激存在密切关系。但是陈浩等[22]通过对热应激状况下西门塔尔牛的研究发现,其IL-2的表达量与非热应激情况下相比含量显著下降,IL-4无明显变化,IL-6的表达量显著上升,此外,IgA、IgM和IgG等球蛋白含量也出现下降,表明与塔帕卡牛相比,热应激对西门塔尔牛的免疫系统造成的影响更为显著,且不同品种的牛在热应激下IL2和IL4的表达量之间存在差异性[43]。
3 冷热应激相关调控基因及分子机制
冷热应激的分子调控受到多个基因的共同调节,在这些基因中,热休克蛋白(heat shock proteins,HSPs)作为一个大的基因家族,在维护机体内环境稳定、抵御冷热应激影响时发挥着重要作用[44-45]。目前,国内外已有许多关于HSPs家族相关基因的研究,这些研究可为挖掘调控冷热应激的关键基因及其分子机制提供参考依据[46]。
HSPs家族基因最早发现于果蝇体内,主要功能包括体内蛋白质的折叠、运输和组装等。其中,HSP70基因作为家族的代表性成员,是机体对冷热应激调节作用的分子标志物[47],并在调控冷热应激方面发挥着重要作用。这种作用表现为当机体受到外界冷热应激时,体内的HSF被蛋白激酶磷酸化,并形成三聚体,这些HSF三聚体复合物进入细胞核并与HSP70基因启动子区域的热休克元件(HSE)结合,使得机体内HSP70 mRNA的表达量上调[48],高表达的HSP70 mRNA随后被转录并离开细胞核进入细胞质合成HSP70等热休克蛋白,这些蛋白可辅助异常的蛋白质恢复其构象,还可激活抗细胞凋亡信号通路,从而降低机体受到的应激损害[49](图3)。在机体内,HSP70基因的表达存在时空差异性[50],随着冷热应激的加重,体内细胞受损或坏死,氧化应激反应出现,此时胞内的HSP70蛋白释放到机体内,从而引起免疫系统的迅速反应[51],达到调节冷热应激的效果,但是这种调节有一定限度,过度的冷热应激可使HSP70基因表达量下降,进而导致机体功能受损[52]。
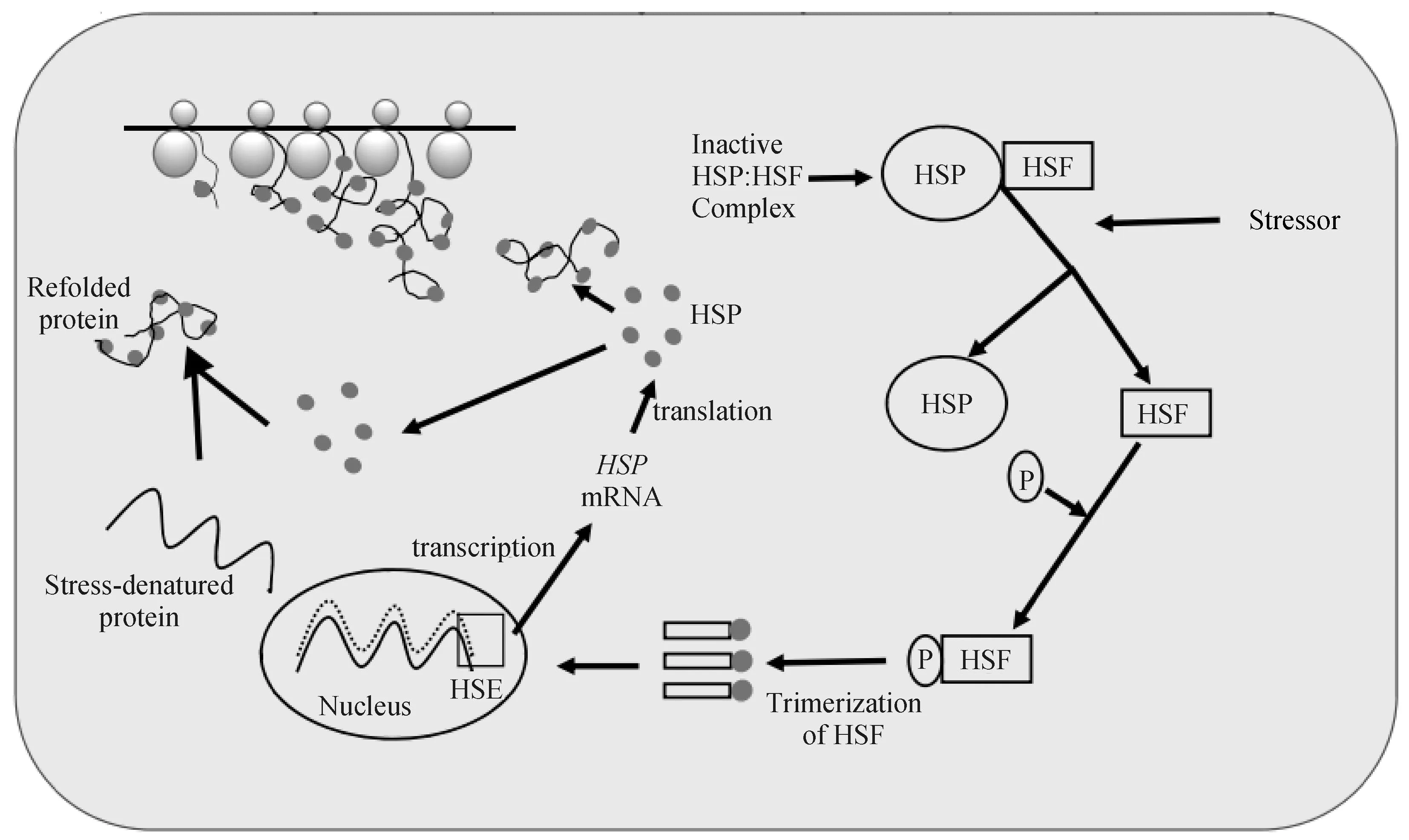
图3 体内HSP70基因的调控机制[53]Fig.3 Regulation mechanism of HSP70 gene in vivo
HSP70家族包含HSPA1A、HSPA1B、HSPA6、HSPA7、HSPA8等8个以上的基因,其中HSPA1A、HSPA1B属于诱导型基因,可在外界刺激的情况下实现诱导表达[54-55]。白丹丹等[56]以三河牛为研究对象,对HSP70家族的基因开展研究,发现受到冷热应激时,三河牛血液淋巴细胞中的HSPA1A、HSPA1B内表达量较非应激时显著上升,李玮等[57-58]的研究也获得了同样的结果。Kumar等[59]对印度瘤牛开展了研究,也发现与春季相比,夏季和冬季HSPA1A、HSPA1B基因的表达量显著升高,Behl等[60]也获得了相同的结果[61],且耐热性越好的品种表达量变化越显著。
已有研究报道,HSP70的SNP差异可影响到其表达量的高低,进而对肉牛机体冷热应激的产生和调控造成影响。在三河牛体内,HSP70基因启动子上游的SNP差异可影响其表达活性,进而影响到冷应激时体内T3、T4指标的变化[62]。印度塔帕卡牛HSP70基因的多态性与其耐热性之间存在密切联系,具有AA基因型的个体较具有BB和AB基因型个体的耐热性强,该位点A等位基因的频率可作为此品种肉牛耐热性的检测指标之一[63]。甘佳等[64]研究了蜀宣花牛、荷斯坦牛和娟荷杂交牛HSP70基因在热应激下的表达情况和个体间的SNP差异,发现HSP70基因存在3个SNPs位点,这些SNP位点可影响HSP70基因的表达量从而使蜀宣花牛对热应激有更好的耐受性。此外,利木赞牛、比利时蓝牛和不同品种的瘤牛在HSP70基因启动子和上游区域也存在基因多态性,导致其拥有不同的冷热应激耐受性,表明HSP70基因多态性可受到品种差异的影响[65-66]。从以上研究可以推断出,HSP70基因在受到冷热应激时的高表达对维持机体正常功能和细胞内稳态具有重要作用,且不同品种间的SNP位点差异可对其表达量高低产生影响,进而造成不同品种肉牛耐冷热应激能力的差异[67]。这些位点的基因多态性可作为肉牛抗冷热应激的分子标记,用于肉牛分子育种和相关基因芯片的开发工作[68]。
HSP基因大家族的其它基因也可直接或间接影响到肉牛对冷热应激的耐受力。如HSP90基因家族表达的蛋白可通过对TLR2/TLR4和IL2/IL6的影响调节反刍动物的热应激[69-70],而在肉牛体内,HSP90家族的HSP90β与HSP70位于同一染色体上[46],可对HSP70家族基因的表达起到调控作用。在尼日利亚婆罗门牛体内,位于HSP90第三个外显子上的SNP差异对其热应激的耐受力影响显著[53]。HSF1作为一类调控因子,也可调控热休克蛋白的表达[71]。此外,不同品种肉牛micro RNA的表达差异,也可对热应激蛋白的表达起到调控作用,进而影响其冷热应激耐受能力[72]。
除了HSP家族的基因,其它家族的基因也可对肉牛的冷热应激产生调控。Tian等[73]用全基因组测序的方法研究了65头红安格斯牛和45头蒙古牛对冷热应激的适应情况,最终筛选出TRPM8、NMUR1、PRKAA2、SMTNL2、OXR1等多个可能与冷应激相关的基因。Jia等[74]对安格斯牛和印度瘤牛的MYO1A基因开展了研究,发现安格斯牛与印度瘤牛相比,随着纬度由北向南的变化,MYO1A上有4个SNPs位点发生突变,并证明了这些突变均与热应激有直接或间接的关系。一些与细胞修复相关的基因也可对冷热应激起到调节作用,EIF2AK4基因已被证实能够通过限制p53因子的表达水平和转录活性从而降低因冷热应激导致的细胞氧化造成的损伤[75-76],而Edea等[77]通过全基因组扫描的方法也发现该基因可能与牛的适应性存在一定联系。此外,DGAT1、PPP1R16A、SOD1、FOXH1、PRLH、PLEC等基因在山羊、奶牛等物种中做为机体调节冷热应激的候选基因已被证实[78-80],但在肉牛体内的研究有待进一步验证。
4 讨论与展望
肉牛机体在受到外界冷热应激刺激后,可作用于HPA、HPT、SAM等途径,此时机体处于应激状态,T3、T4、ACTH、GH、GC等血液内分泌相关指标,SOD、MDA、T-AOC、GSH-Px等抗氧化相关指标,IgA、IgM、IgG、IL2、IL4等免疫相关指标会产生变化,造成机体产生不良反应,进而影响到肉牛的健康程度,降低生产效率。目前,可通过调节饲喂方式和分子育种改良的方法,提高肉牛机体对冷热应激的适应性,从而降低相关损失。
已有研究证明,补充饲料添加剂和改变饲喂方式可调节机体内免疫应答,进而达到降低冷热应激严重程度的目的。李进春和何振富等[81-82]分别通过补充酒糟和复合酶菌制剂的方法,提高了西门塔尔牛IgA、IgG和IL2等免疫指标的表达量,可从饲料添加剂角度为降低冷热应激提供参考,而在不同季节有针对性地改变饲养管理方式也可以缓解冷热应激,降低相关损失[83]。
不同品种肉牛表现出对冷热应激不同的耐受力,这种耐受力的调控是一个较为复杂的性状,受到多个基因的共同影响,其中HSP70基因家族的基因在肉牛冷热应激的分子调控中起到重要作用,且这些基因在不同肉牛品种中存在SNP差异,进而导致不同品种肉牛冷热应激耐受力的差异性。此外,HSP90家族的部分基因和HSF1等调控因子也可对肉牛的冷热应激耐受性产生影响,而HSP70、HSP90-α和HSP90-β等基因在绵羊、山羊等偶蹄动物的冷热应激调节中也起着很重要的作用[69]。对这些基因的研究有助于更好地挖掘和探索与冷热应激适应性相关的分子因子及调控机制,从而进一步改良肉牛对恶劣环境气候的耐受性。生产实际中,可通过极进杂交或导入杂交等方法完成对冷热应激耐受力较差肉牛群体的遗传改良。
目前,国外已有许多研究采用全基因组关联分析(genome-Wide association study,GWAS)的方法将内分泌、抗氧化、免疫指标等表型数据和基因型进行关联分析,进一步挖掘出与冷热应激相关的候选调控基因[84-86],但GWAS方法在我国肉牛冷热应激的研究中报道较少,后期可基于GWAS方法挖掘我国特有肉牛品种中与冷热应激等抗逆性相关的候选基因,并将这些基因作为分子标记位点,开发相应的基因芯片,并采用全基因组选择(genomic selection,GS)的方法找到优秀个体,通过杂交的方式构建具有优良抗逆性状的肉牛群体,从而产生更好的经济和社会效益[87-88]。
