液态芯片技术筛选胸腔积液细胞因子对结核性胸膜炎的诊断价值
2024-04-01杜凤娇杜博平贾红彦邢爱英李自慧朱传智李华
杜凤娇 杜博平 贾红彦 邢爱英 李自慧 朱传智 李华
摘要:目的 應用液态芯片技术筛选结核性胸膜炎(plTB)胸腔积液结核特异性细胞因子建立诊断模型,并探讨其应用价值。方法 纳入plTB患者(plTB组)86例,其中确诊plTB组41例,临床诊断plTB组45例;其他胸腔积液患者(对照组)42例。采用液相芯片技术分析胸腔积液17个细胞因子,包括白细胞介素(IL)-1β、IL-2、IL-4、IL-5、IL-6、IL-8、IL-9、IL-10、γ-干扰素诱导蛋白10(IP-10)、IL-15、IL-17F、IL-27、肿瘤坏死因子(TNF)-α、单核细胞趋化蛋白-1(MCP-1)、巨噬细胞炎症蛋白-3a(MIP-3α)、巨噬细胞集落刺激因子(M-CSF)、β-干扰素(IFN-β)的表达量。筛选确诊plTB组和对照组组间差异因子,并在确诊plTB患者中绘制受试者工作特征(ROC)曲线,将AUC>0.850、特异度>80%的IP-10、IL-27和MCP-1联合诊断plTB,并同胸腔积液腺苷酸脱氨酶(ADA)检测和结核感染T细胞斑点试验(T-SPOT.TB)比较,评估诊断效能。结果 确诊plTB组IL-2、IP-10、IL-27、TNF-α和MCP-1水平均高于对照组(P<0.05);IP-10、IL-27和MCP-1三因子联合确诊plTB的敏感度为87.8%,特异度为81.0%;三因子联合诊断在45例临床诊断plTB组中的敏感度仍高达86.7%,与确诊plTB组的敏感度比较,差异无统计学意义(P>0.05)。plTB组中,TIP-10、IL-27和MCP-1三因子联合检测的敏感度为87.2%,高于T-SPOT.TB单独检测(81.4%)和ADA单独检测(54.7%)。结论 应用液态芯片技术对胸腔积液IP-10、IL-27和MCP-1联合检测,可为plTB诊断提供帮助。
关键词:结核;胸腔积液;胸膜炎;白细胞介素-27;液态芯片技术;γ-干扰素诱导蛋白10;单核细胞趋化蛋白-1
中图分类号:R521文献标志码:ADOI:10.11958/20230793
Study on the value of screening cytokines in pleural effusion by liquid array technology in the diagnosis of tuberculous pleurisy
DU Fengjiao1, DU Boping1, JIA Hongyan1, XING Aiying1, LI Zihui1, ZHU Chuanzhi1, LI Hua2△
1 Beijing Key Laboratory of Drug Resistance Tuberculosis Research, Beijing 101149, China; 2 Department of Tuberculosis Two, Beijing Chest Hospital, Capital Medical University, Beijing Tuberculosis and Thoracic Tumor Research Institute
△Corresponding Author E-mail: lhlbw1997@hotmail.com
Abstract: Objective To screen the specific cytokines of tuberculous pleural effusion (plTB) by using liquid array technique to establish a diagnostic model and discuss its application value. Methods A total of 86 patients with plTB (plTB group) were included, including 41 patients in the confirmed plTB group and 45 patients in the clinically diagnosed plTB group. There were 42 other patients with pleural effusion in the control group. Seventeen cytokines in pleural effusion were analyzed by liquid array technology. Interleukin (IL) -1β, IL-2, IL-4, IL-5, IL-6, IL-8, IL-9, IL-10, gamma-interferon-induced protein 10 (IP-10), IL-15, IL-17F, IL-27, tumor necrosis factor (TNF) -α, monocyte chemotactic protein-1 (MCP-1), the expression levels of macrophage inflammatory protein-3a (MIP-3α), macrophage colony-stimulating factor (M-CSF) and β-interferon (IFN-β) were detected. Difference factors between the confirmed plTB group and the control group were screened, and the receiver operating characteristic (ROC) curve was drawn in the confirmed plTB patients. IP-10, IL-27 and MCP-1 with AUC > 0.850 and specificity > 80% were combined to diagnose plTB, and were compared with adenylate deaminase (ADA) and T-SPOT.TB in pleural effusion to evaluate the diagnostic efficacy. Results The levels of IL-2, IP-10, IL-27, TNF-α and MCP-1 were higher in the confirmed plTB group than those in the control group (P<0.05). The sensitivity and specificity of IP-10, IL-27 and MCP-1 in the diagnosis of plTB were 87.8% and 81.0%. The sensitivity of three-factor combined diagnosis in 45 patients with plTB was still as high as 86.7%, and there was no significant difference in sensitivity compared with that in the diagnosed plTB group (P>0.05). In the plTB group, the sensitivity of IP-10, IL-27 and MCP-1 combined detection was 87.2%,which was higher than that of T-SPOT.TB (81.4%) and ADA (54.7%). Conclusion The application of liquid array technology to the joint detection of pleural effusion IP-10, IL-27 and MCP-1 can provide help for the diagnosis of plTB.
Key words: tuberculosis; pleural effusion; pleurisy; interleukin-27; liquid array technology; IP-10; MCP-1
结核病(tuberculosis,TB)是仅次于新型冠状病毒肺炎(COVID-19)的第二大致死性传染病,位列全球疾病死因第13位[1]。结核性胸膜炎(tuberculous pleurisy,plTB)是一种常见的TB类型,发病率呈上升趋势。plTB可引起胸膜增厚、结核性脓胸、乳糜胸、气胸等并发症,导致肺功能损害、慢性胸痛或呼吸困难,对患者造成极大伤害。早期诊断是控制plTB的关键环节[2-3]。细菌学和病理学结果是plTB诊断的金标准,但抗酸杆菌涂片检测阳性率低于5.8%,结核分枝杆菌(Mycobacterium tuberculosis,M.tb)培养周期长(4~8周),而组织病理学检查多为有创,因此都不适于普及。分子生物学检测技术仍存在假阳性及技术等方面问题,难以推广[4]。近年来,偶有潜在细胞因子可诊断plTB的研究[5]。液态芯片技术(Luminex)可多指标并行分析,具有操作简便、灵敏度高、通量高等优点,为疾病特异性标志物的发现和新诊断方法的建立提供了研究思路和平台[6]。目前尚缺乏胸腔积液大样本、同时检测多个细胞因子的相关研究。本研究应用液态芯片技术检测胸腔积液细胞因子,筛选plTB敏感度高、特异度好的辅助诊断标志物,并同传统的胸腔积液腺苷酸脱氨酶(adenosine deaminase,ADA)檢测及结核感染T细胞斑点试验(T-SPOT.TB)比较,评估其临床应用价值。
1 对象与方法
1.1 研究对象 选取2018年7月—2021年12月在北京胸科医院住院或门诊就诊的X线检查显示有胸腔积液,疑似结核性胸膜炎的患者155例。收集患者病历资料,剔除资料不全和诊断不明确者27例,最终纳入128例患者,其中男80例,女48例,年龄18~86岁,中位年龄54(37,66)岁;分为plTB组(86例)和对照组(42例)。plTB组男54例,女32例,年龄18~86岁,中位年龄44(33,59)岁,26例合并肺结核,13例合并糖尿病。依据WS196—2017肺结核诊断指南[7],将病原学(包括细菌学和分子生物学)或病理学确诊的plTB者作为确诊plTB组(41例),临床诊断plTB者作为临床诊断plTB组(45例)。对照组为确诊其他胸膜疾病,排除plTB,且既往无TB史和结核接触史,均未经过放化疗和手术治疗者,包括肺癌39例(腺癌26例、鳞癌5例和小细胞癌8例),胸膜间皮瘤2例和细菌性胸膜炎1例;男26例,女16例,年龄26~76岁,中位年龄64(57,72)岁;5例合并糖尿病。以上患者均无妊娠、严重肝肾功能损害、急性病毒感染、肝炎、人免疫缺陷病毒感染和免疫抑制剂应用史。本研究通过首都医科大学附属北京胸科医院伦理委员会批准,批件号:(2021)年临床审第(06)号。
1.2 方法
1.2.1 试剂与仪器 Human 17-plex免疫因子分析试剂盒(美国Panomics公司);T-SPOT.TB试剂盒(英国Oxford Immunotech公司);Luminex20液相芯片分析仪(美国Millipore公司);5417R低温高速离心机(德国Eppendorf公司);705超低温冰箱(日本三洋公司)。
1.2.2 样品采集及处理 收集2 h内采集的每位患者胸腔积液2 mL于EP管中,4 ℃、10 000×g离心5 min后,收集上清液于1.5 mL EP管,-80 ℃冻存备用。
1.2.3 液相芯片分析胸腔积液的细胞因子水平 按照试剂盒说明书稀释标准品、质控品、偶联抗体珠。96孔板每孔加入洗液200 μL,室温避光水平振摇10 min。弃上清液,吸水纸上拍净。制备2 000、400、80、16、3.2和0 ng/L的标准品加入对应孔,然后将室温平衡的样本加入对应孔后,加入预混磁珠25 μL,避光,4 ℃振摇2 h。在磁性板架上弃上清液,洗板2次。每孔加入检测抗体25 μL,室温避光振摇1 h。每孔加入链亲和霉素-藻红蛋白25 μL,避光室温振摇30 min,洗板2次。每孔加入150 μL鞘液重悬磁珠,避光室温振摇 5 min,在液相芯片分析仪上检测白细胞介素(IL)-1β、IL-2、IL-4、IL-5、IL-6、IL-8、IL-9、IL-10、γ-干扰素诱导蛋白10(interferon-gamma inducible protein of 10,IP-10)、IL-15、IL-17F、IL-27、肿瘤坏死因子(TNF)-α、单核细胞趋化蛋白-1(MCP-1)、巨噬细胞炎症蛋白-3a(MIP-3α)、巨噬细胞集落刺激因子(M-CSF)、β-干扰素(IFN-β)共17个细胞因子的表达量。
1.2.4 T-SPOT.TB检测 按照T-SPOT.TB试剂盒说明书进行操作。用肝素抗凝管采集4 mL外周血,4 h内用淋巴细胞分离液分离得到外周血单个核细胞并制备成2.5×106/mL的细胞悬液。分别取100 μL细胞悬液放于空白对照孔(无血清培养基)、阳性对照孔(植物血凝素)、早期分泌靶向抗原(early secretory antigenic target,ESAT)-6和培养滤液蛋白(culture flit protein,CFP)-10孔中进行过夜培养,通过美国CTL公司的酶联免疫斑点系统(CTL ImmunoSpop S5 Versa Analyzer)计数斑点形成细胞(spots forming cells,SFCs)。结果判定标准:当空白对照孔SFCs<6时,ESAT-6或CFP-10任一个实验孔SFCs≥6即为阳性;若空白对照孔SFCs≥6,ESAT-6或CFP-10任一个实验孔SFCs≥2倍空白孔SFCs,结果为阳性;若空白对照孔内SFCs≥10或阳性对照孔内SFCs<20,试验无效。
1.2.5 ADA测定 采用抗凝管收集10 mL胸腔积液,1 000×g离心5 min,取上清液,用酶法(北京九强生物技术股份有限公司试剂盒)测定ADA活性,参照试剂盒说明书进行诊断,ADA≥45 U/L定义为阳性。
1.3 统计学方法 采用SPSS 24.0软件进行数据分析,符合正态分布的计量资料以[x] ±s表示,2组间比较采用独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,2组间比较采用Mann-Whitney U检验。计数资料以例(%)表示,3组间阳性率比较采用Cochrans Q检验,组间多重比较采用配对χ2检验,绘制受试者工作特征(ROC)曲线。P<0.05为差异有统计学意义。
2 结果
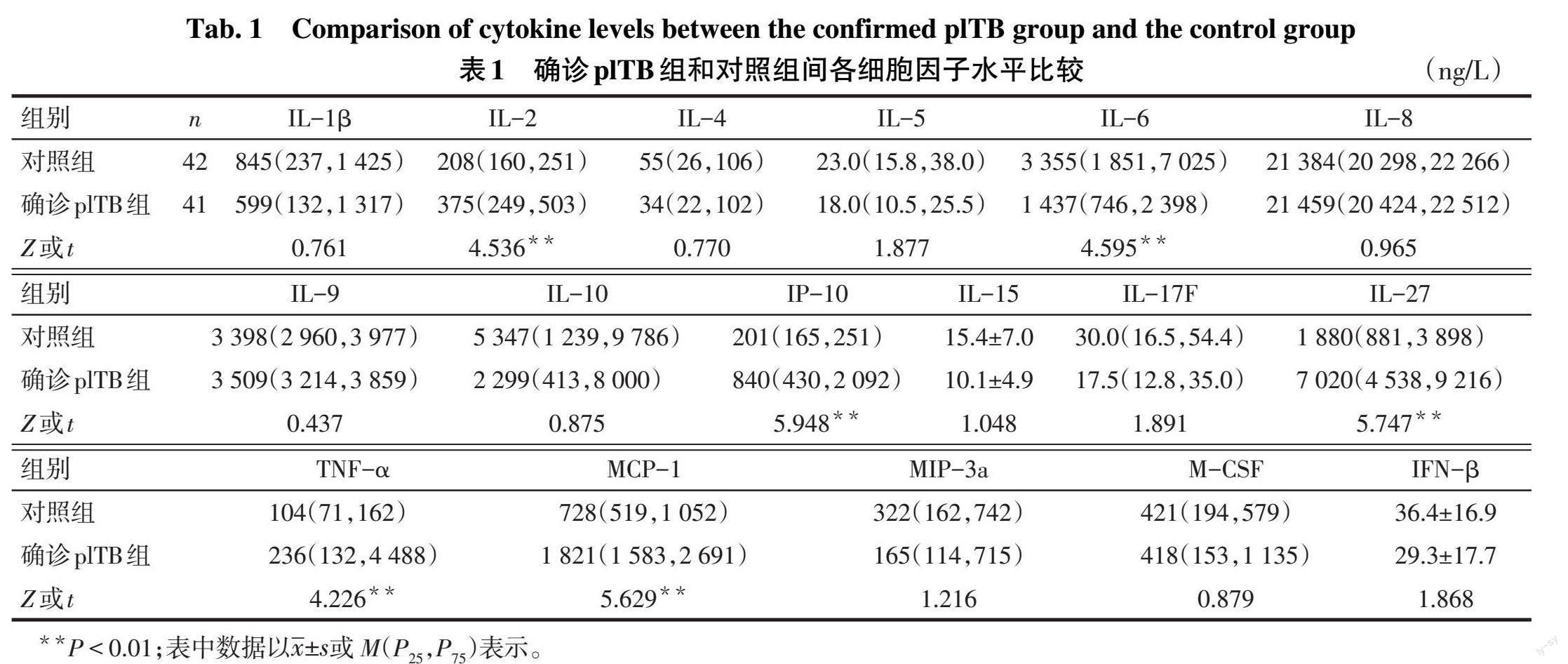
2.1 确诊plTB组和对照组胸腔积液的细胞因子水平比较 确诊plTB组IL-2、IP-10、IL-27、TNF-α和MCP-1水平均高于对照组(P<0.05),确诊plTB组IL-6水平低于对照组(P<0.05),见表1。
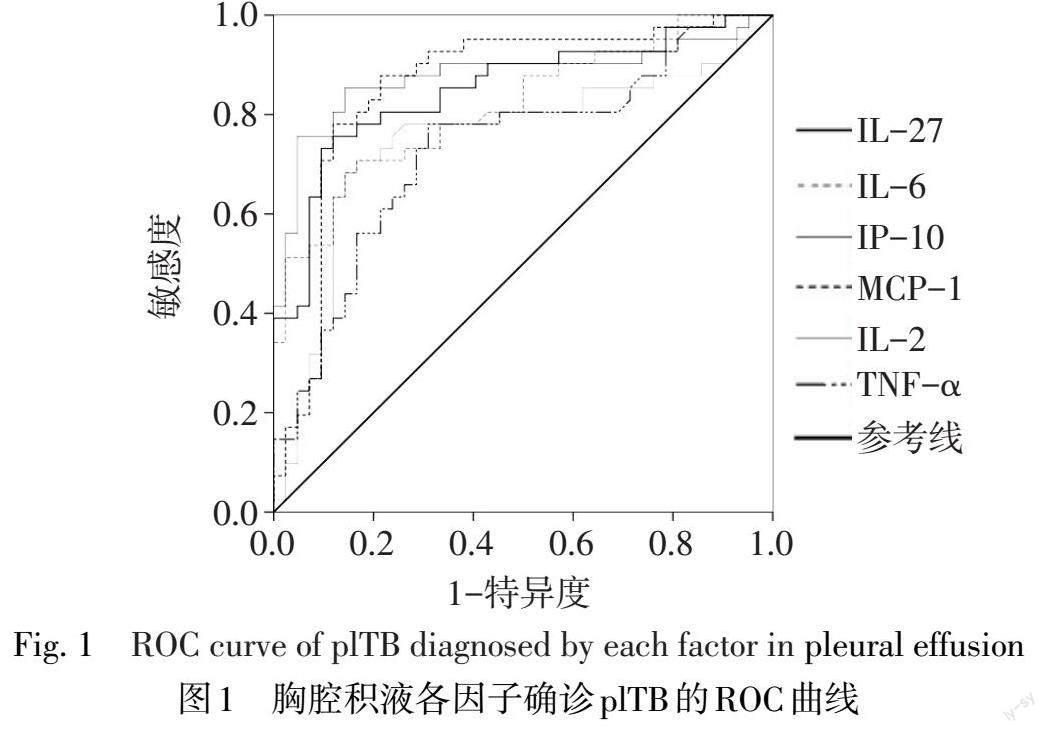
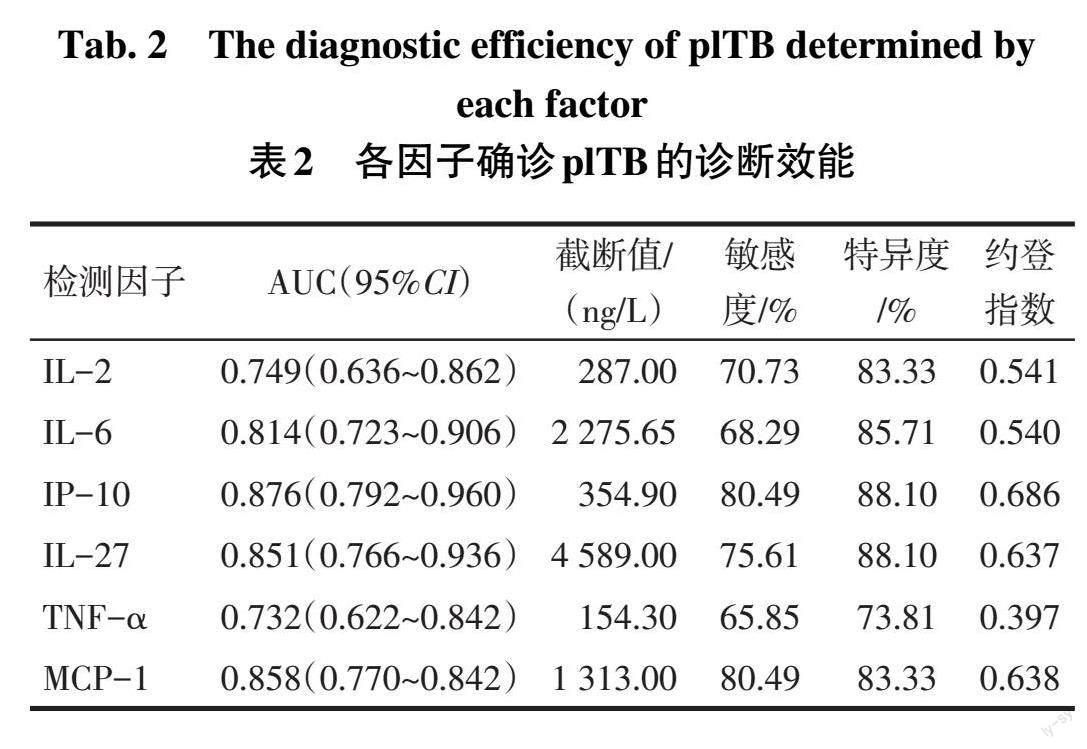
2.2 胸腔积液IL-2、IL-6、IP-10、IL-27、TNF-α和MCP-1对确诊plTB的诊断效能 各因子单独诊断41例确诊plTB的AUC、敏感度和特异度见图1、表2。将AUC>0.850且特异度>80%的IP-10、IL-27和MCP-1联合确诊plTB,其中任一因子为阳性则判定为联合诊断阳性,三因子均为阴性则判定为联合诊断阴性,联合确诊plTB的敏感度为87.8%(36/41),特异度为81.0%(34/42)。三因子联合诊断在45例临床诊断plTB患者中的敏感度仍高达86.7%(39/45),與确诊plTB组的敏感度比较,差异无统计学意义(χ2=0.025,P>0.05)。三因子联合诊断plTB的敏感度为87.2%(75/86),特异度为81.0%(34/42)。
2.3 各指标诊断效能比较 IP-10、IL-27和MCP-1三因子联合检测和T-SPOT.TB的敏感度均高于ADA检测(Cochrans-Q=39.813,χ2分别为12.777和57.695,P<0.01),且三因子联合检测的敏感度高于T-SPOT.TB(χ2=11.631,P<0.01);三因子联合检测、T-SPOT.TB和ADA检测的特异度差异无统计学意义(Cochrans-Q=6.000,P>0.05),见表3。
3 讨论
plTB是M.tb及其代谢产物由近胸膜的原发病灶直接波及胸膜,或经血液、淋巴途径传播至胸膜而引起的渗出性炎症,与机体复杂的细胞因子网络被激发产生免疫反应有关。大量的胸腔积液降低了M.tb的浓度,从而导致胸腔积液M.tb体外培养阳性率极低[8]。宿主参与抗M.tb免疫应答中的各类细胞及其因子具有潜在的开发免疫学诊断试剂的价值[5]。鉴于传统方法检测免疫因子效能有限,仅有少数单个指标的研究报道。本研究应用液态芯片技术检测胸腔积液中的17种免疫因子并进行比较,发现确诊plTB组中IL-2、IP-10、IL-27、TNF-α和MCP-1水平均高于对照组,IL-6低于对照组,提示检测胸腔积液中特异性免疫因子具有潜在诊断价值。
近年来新发现的二聚体细胞因子IL-27是IL-6/IL-12家族成员,由活化的单核细胞、巨噬细胞以及树突状细胞共同作用产生,与分布在免疫细胞上的受体结合,进而通过信号转导和转录激活因子(signal transducer and activator of transcription,STAT)1/STAT2通路调节T淋巴细胞向Th1方向分化和增殖。IL-27可有效识别并清除M.tb,可与结核性胸腔积液中存在的多种细胞因子发生作用并参与plTB的发生与发展[9-10]。刘佳庆等[11]也发现利用液相芯片技术对患者胸腔积液IL-27检测在plTB诊断中存在一定的价值。在TB高流行地区,胸腔积液中IL-27对plTB有较好的诊断效果,且阴性结果排除plTB可能性较大[12]。本研究中,胸腔积液IL-27的诊断临界值为4 589.00 ng/L,敏感度为75.61%,特异度为88.10%,显示了较好的诊断价值。这可能是由于患者胸腔积液微环境改变,M.tb入侵,渗出液诱发局部超敏反应,使得IL-27水平增高所致[10]。
IP-10属于趋化因子CXC亚家族,CXC趋化因子受体3(CXCR3)是其唯一的配体,可趋化高度表达CXCR3的多种炎性细胞,属于Th1型细胞因子。其主要通过内皮细胞、成纤维细胞、淋巴细胞、单核巨噬细胞活化产生,可选择性诱导白细胞表达整合素,诱导更多趋化因子产生,放大信号,产生强烈细胞反应,增加病灶内细胞浓度,损伤局部组织器官[13]。IL-2是一种淋巴激活因子,可促进T细胞的增殖、诱导细胞毒性T细胞的产生和增殖,在介导免疫反应中起关键作用[14]。研究显示,胸腔积液IP-10和IL-2对plTB具有较高的诊断价值[13-14]。本研究中IP-10和IL-2诊断plTB的敏感度分别为80.49%和70.73%,特异度分别为88.10%和83.33%,提示检测IP-10较IL-2诊断plTB的价值高。此外,IP-10和IL-2在人免疫缺陷病毒感染患者和儿童TB诊断中较γ-干扰素敏感度高[15-16]。MCP-1属于趋化因子CC亚家族。在结核宿主免疫中,MCP-1能够诱导结核的非特异性免疫反应和肉芽组织的形成过程,还具有促进单核/巨噬细胞合成和分泌TNF-α的特性,同时TNF-α可反过来刺激MCP-1在肺内的表达。这提示MCP-1与TNF-α不仅本身参与结核结节的形成,而且MCP-1与TNF-α在细胞因子网络中有相互促进作用,这可能是结核结节形成的机制之一[17-19]。本研究结果提示单独应用MCP-1较TNF-α鉴别诊断的可靠性高。
IL-6是一种多功能细胞因子,由T细胞、B细胞和单核细胞等多种细胞产生,并促进T细胞和B细胞的分化与增殖,在急性炎症反应中起关键作用,如诱导产生一些急性期蛋白及合成免疫球蛋白,以助于感染早期γ-干扰素快速表达等[14,20]。有研究表明结核性胸腔积液中IL-6含量高于恶性胸腔积液,且高于自身外周血清[21],可能由于胸膜腔受到M.tb感染时产生过敏反应,T细胞被激活,产生并分泌IL-6。本研究中IL-6诊断plTB的敏感度为68.29%,特异度为85.71%,检测胸腔积液IL-6有助于鉴别诊断。
本研究应用液态芯片技术首先在确诊plTB组与对照组间筛选出6个胸腔积液差异细胞因子,进而在plTB组中联合检测IL-6、IP-10和MCP-1,使得敏感度提高至87.8%,特异度为81.0%,且三因子联合检测在临床plTB组中的敏感度仍高达86.7%,提示联合检测对plTB有辅助诊断价值,尤其对临床plTB者具有潜在应用价值。
γ-干扰素释放试验是近20年来基于免疫和分子生物学发展起来的一种快速的体外检测结核菌感染的新方法,被广泛用于TB的辅助诊断。基于外周血单个核细胞的T-SPOT.TB将细胞调至2.5×106/mL,保障了实验的准确性和敏感度。但是,在TB高负担国家中结核潜伏感染率高,诊断特异度较低,常用于TB患者的排除,而非纳入,且操作复杂、价格昂贵,限制了其常规临床应用[5]。本研究中T.SPOT-TB诊断plTB的敏感度略低于IP-10、IL-27和MCP-1三因子联合检测。ADA检测是临床常规应用的、诊断plTB较为准确的辅助指标。ADA是嘌呤核苷酸分解代谢过程中的关键酶,主要存在于机体淋巴细胞中,当患者感染M.tb时,T细胞介导的免疫应答会使淋巴细胞明显增高,ADA浓度也大幅提高[22]。本研究中ADA检测、三因子联合检测和T.SPOT-TB的特异度差异均无统计学意义,但联合检测的敏感度高于ADA检测。
综上所述,应用液态芯片技术对IP-10、IL-27和MCP-1联合检测plTB具有较高的敏感度和特异度,且操作简单、方便。因此,三因子联合诊断具有潜在的临床应用价值,但本研究纳入的患者例数较少,尚需扩大样本量进一步研究。
参考文献
[1] World Health Organization. Global tuberculosis report 2022[R]. Geneva:WHO,2022.
[2] LO CASCIO CM,KAUL V,DHOORIA S,et al. Diagnosis of tuberculous pleural effusions:A review[J]. Respir Med,2021,188:106607. doi:10.1016/j.rmed.2021.106607.
[3] BRAUN C M,RYU J H. Chylothoraxand pseudochylothorax[J].Clin Chest Med,2021,42(4):667-675. doi:10.1016/j.ccm.2021.08.003.
[4] 高珊,黄海荣,初乃惠. 结核性胸膜炎常用诊断方式的应用[J]. 中国临床医生杂志,2021,49(7):767-770. GAO S,HUANG H R,CHU N H. Application of common diagnostic methods for tuberculous pleurisy[J]. Chinese Journal for Clinicians,2021,49(7):767-770. doi:10.3969/j.issn.2095-8552.2021.07.005.
[5] 贾红彦,董静,张宗德,等. 结核分枝杆菌感染的免疫学检测技术研究进展及临床应用现状[J]. 中国防痨杂志,2022,44(7):720-726. JIA H Y,DONG J,ZHANG Z D,et al. Progress and clinical application of immunological detection technology for Mycobacterium tuberculosis infection[J]. Chinese Journal of Antituberculosis,2022,44(7):720-726. doi:10.19982/j.issn.1000-6621.20220103.
[6] 王宇平,陈永义,张建明. 液相芯片技术在人类传染病检测中的应用[J].现代预防医学,2015,42(4):708-709,716. WANG Y P,CHEN Y Y,ZHANG J M. Application of liquid array technology in the detection of human infectious diseases[J]. Modern Preventive Medicine,2015,42(4):708-709,716.
[7] 中華人民共和国国家卫生和计划生育委员会. 肺结核诊断标准WS 288-2017[J]. 新发传染病电子杂志,2018,3(1):59-61. National Health and Family Planning Commission,People's Republic of China. Diagnostic criteria for tuberculosis WS 288-2017[J]. Electronic Journal of Emerging Infectious Diseases,2018,3(1):59-61. doi:10.3877/j.issn.2096-2738.2018.01.017.
[8] LIAM C K,LIM K H,WONG C M. Causes of pleural exudates in a region with a high incidence of tuberculosis[J]. Respirology,2000,5(1):33-38. doi:10.1046/j.1440-1843.2000.00223.x.
[9] 白峰,张小雷,杨剑飞,等. 结核、肺癌性胸膜炎患者胸腔积液内IL-27、TNF-α、CA15-3及VEGF水平比较[J]. 临床和实验医学杂志,2022,21(14):1516-1519. BAI F,ZHANG X L,YANG J F,et al. Comparison of IL-27,TNF-α,CA15-3 and VEGF levels in pleural effusion of patients with tuberculosis and lung cancer pleurisy[J]. Journal of Clinical and Experimental Medicine,2022,21(14):1516-1519. doi:10.3969/j.issn.1671-4695.2022.14.016.
[10] GOLLNICK H,BARBER J,WILKINSON R J,et al. IL-27 inhibits anti- Mycobacterium tuberculosis innate immune activity of primary human macrophages[J]. Tuberculosis(Edinb),2023,139:102326. doi:10.1016/j.tube.2023.102326.
[11] 刘佳庆,张立,冯爽,等. 液相芯片技术检测多种细胞因子对结核性胸腔积液诊断价值的评估[J]. 中华检验医学杂志,2015,38(8):562-566. LIU J Q,ZHANG L,FENG S,et al. Evaluating the value of detecting cytokines for diagnosis of tuberculous pleural effusion by liquid array technology[J]. Chinese Journal of Laboratory Medicine,2015,38(8):562-566. doi:10.3760/cma.j.issn.1009-9158.2015.08.014.
[12] ZHANG Q,MA Y,ZHANG M,et al. Diagnostic accuracy of interleukin-27 in tuberculous pleurisy:a systematic review and meta-analysis[J]. QJM,2021,114(8):568-576. doi:10.1093/qjmed/hcaa215.
[13] 陈秋悦,陈效友. γ-干扰素诱导蛋白10在结核病诊断中的研究进展[J]. 中国防痨杂志,2017,39(11):1233-1236. CHEN Q Y,CHEN X Y. Progress of IP-10 in diagnosis of tuberculosis[J]. Chinese Journal of Antituberculosis,2017,39(11):1233-1236. doi:10.3969/j.issn.1000-6621.2017.11.016.
[14] 王敬萍,刘东洋,马玙. 细胞因子和结核性胸腔积液[J]. 中国防痨杂志,2001,23(3):198-202. WANG J P,LIU D Y,MA Y. Cytokine and pleural effusion [J]. Chinese Journal of Antituberculosis,2001,23(3):198-202. doi:10.3969/j.issn.1000-6621.2001.03.032.
[15] SUDBURY E L,OTERO L,TEBRUEGGE M,et al. Mycobacterium tuberculosis-specific cytokine biomarkers for the diagnosis of childhood TB in a TB-endemic setting[J]. J Clin Tuberc Other Mycobact Dis,2019,16:100102. doi:10.1016/j.jctube.2019.100102.
[16] XU F,NI M,QU S,et al. Molecular markers of tuberculosis and their clinical relevance:a systematic review and meta-analysis[J]. Ann Palliat Med,2022,11(2):532-543. doi:10.21037/apm-21-3739.
[17] 曹志紅,曹彦,程小星. MCP-1在结核病诊断中的价值[J]. 临床肺科杂志,2015,20(2):195-198. CAO Z H,CAO Y,CHENG X X. Diagnostic value of MCP-1 for tuberculosis[J].Journal of Clinical Pulmonary Medicine,2015,20(2):195-198. doi:10.3969/j.issn.1009-6663.2015.02.03.
[18] 牛艺兵,韩书芝. 单核细胞趋化蛋白1与肺部疾病相关性的研究进展[J]. 国际呼吸杂志,2018,38(18):1406-1409. NIU Y B,HAN S Z. Advances in the relationship between monocyte chemoattractant protein-1 and pulmonary diseases[J]. International Journal of Respiration,2018,38(18):1406-1409. doi:10.3760/cma.j.issn.1673-436X.2018.18.010.
[19] 李敏超,杜先智,周向东. Toll样受体介导H37Rv诱导的单核细胞趋化蛋白-1表达[J]. 第三军医大学学报,2010,32(20):2181-2184. LI M C,DU X Z,ZHOU X D. Toll-like receptor mediates MCP-1 expression induced by mycobacterium tubercu-losis H37Rv[J]. Journal of Third Military Medical University,2010,32(20):2181-2184.
[20] YU X L,JIANG S S,LI Y,et al. Development of a new cellular immunological detection method for tuberculosis based on HupB protein induced IL-6 release test[J]. Front Microbiol,2023,14:1148503. doi:10.3389/fmicb.2023.1148503.
[21] DA CUNHA LISBOA V,RIBEIRO-ALVES M,DA SILVA CORR?A R,et al. Predominance of Th1 immune response in pleural effusion of patients with tuberculosis among other exudative etiologies[J]. J Clin Microbiol,2019,58(1):e00927-00919. doi:10.1128/JCM.00927-19.
[22] GAO L,WANG W,ZHANG Y,t al. Adenosine deaminase-based measurement in the differential diagnosis of pleural effusion:a multicenter retrospective study[J]. Ther Adv Respir Dis,2023,17:17534666231155747. doi:10.1177/17534666231155747.
(2023-05-25收稿 2023-09-04修回)
(本文编辑 李志芸)
