阳和汤对Lewis 肺癌荷瘤小鼠的抑瘤效应及肿瘤免疫微环境影响的实验研究
2021-10-29张渭波行艳丽赵美峰
吴 琳 张渭波 行艳丽 李 艳 赵美峰 姚 欢
1.陕西省咸阳市中心医院药学部,陕西咸阳 712000;2.陕西省咸阳市中心医院病理科,陕西咸阳 712000
阳和汤出自清代王维德的《外科证治全生集》[1],由麻黄、肉桂、鹿角胶、熟地、炮姜炭、白芥子、生甘草组成,具有温阳散寒、活血通络、化痰散结的功效,是治疗阴疽的经典效方。阴疽病变部位往往坚硬如石且漫肿不红,多为阴痰郁滞气血、阻隔经络所致,相当于现代医学的肿瘤[2-3]。近年来,阳和汤广泛应用于肿瘤的临床治疗[4-5],相关研究[6-7]显示,其在肿瘤治疗领域具有较好的应用前景。有研究显示,阳和汤治疗肿瘤的具体病种中,肺癌的使用频率位居第二,仅次于乳腺癌,占比为28.6%[8]。随着研究的深入,肿瘤免疫微环境已被视为肿瘤的“第七大标记性特征”,在肿瘤形成及进展中发挥着非常重要的作用[9-10]。近年来,中医药在调节肿瘤免疫微环境方面具有重要的作用[11-12],因此本研究拟观察阳和汤对Lewis 肺癌荷瘤小鼠的抑瘤效应,对肿瘤免疫微环境中白细胞介素-2(interleukin-2,IL-2)、转化生长因子-β(transformed growth factor-β,TGF-β)的表达及对细胞毒性T 淋巴细胞(cytotoxic lymphocyte,CTL)、调节性T 细胞(regulatory cell,Treg)的影响,以期为阳和汤治疗肺癌提供实验依据。
1 材料与方法
1.1 实验动物
一月龄SPF 级C57BL/6 小鼠50 只,雄性,体重18~22 g,购于西安交通大学医学院实验动物中心,许可证号SCXK(陕)2018-001,合格证号410021003105 279。饲养在陕西中医药大学实验中心动物房(温度22~27℃,相对湿度45%~66%),小鼠可自由饮水并摄取食物。动物实验经陕西中医药大学科研伦理委员会批准。小鼠Lewis 肺癌细胞株购于武汉普诺赛生命科技有限公司。
1.2 实验药物
阳和汤由熟地30 g、鹿角胶9 g、白芥子6 g、肉桂3 g、生甘草3 g、麻黄2 g、炮姜炭2 g 组成,药材均购于西安中药饮片有限责任公司,经陕西中医药大学药学院中药鉴定学教研室鉴定,按上述剂量称取,根据常规方法煎煮(鹿角胶打粉烊化),浓缩至2.75、1.84、0.92 g/ml 的药液,置于4℃冰箱备用。环磷酰胺片(50 mg/片)购于通化茂祥制药有限公司(201902)。
1.3 主要试剂
Rabbit anti-mouse IL-2(江苏亲科生物研究中心有限公司,AF5105);Rabbit anti-mouse TGF-β(博士德生物工程有限公司,BA0290);Rabbit anti-mouse CD3(江苏亲科生物研究中心有限公司,DF6594);Rabbit anti-mouse CD25(江苏亲科生物研究中心有限公司,DF7132);Rabbit anti-mouse CD4(北京博奥森生物技术有限公司,BF0174);Rabbit anti-mouse CD8(北京博奥森生物技术有限公司,EC6872);Rabbit anti-mouse FoxP3(北京博奥森生物技术有限公司,AF6544);Rabbit IgG-SABC-FITC kit(江苏亲科生物研究中心有限公司,S0011);DAPI 染色液(博士德生物工程有限公司,AR1176)。
1.4 仪器设备
CO2培养箱(美国Thermoe scientifican 公司,CCB-150 型);离心机(德国Eppendorph 公司,Centrifuge 5427R);电子精密天平(德国Sartorius 公司,bsa423s,精度0.01 g);石蜡切片机(德国Leica 公司,RM2235);生物组织自动脱水机(湖北泰维科技实业有限公司,TC-120S);自动恒温烘片仪(湖北泰维科技实业有限公司,TK-213)。
1.5 实验方法
将培养浓度为2×107/ml Lewis 肺癌细胞悬液0.2 ml分别接种在适应性喂养5 d 后的50 只雄性C57BL/6小鼠右侧前腋皮下以形成Lewis 肺癌荷瘤模型。按照随机数字表法将其分为荷瘤模型组、环磷酰胺组、阳和汤高剂量组、阳和汤中剂量组和阳和汤低剂量组,每组10 只。造模5 d 后用手触摸到接种部位有结节提示造模成功,分别用生理盐水、环磷酰胺(25 mg/kg)、阳和汤高剂量(27.5 g/kg)、阳和汤中剂量(18.3 g/kg)、阳和汤低剂量(9.2 g/kg)进行灌胃给药,0.2 ml/次,1 次/d,连续10 d。
1.6 观察指标
1.6.1 小鼠的体重、瘤重及抑瘤率 首次给药前及末次给药后的第2 天分别称量各组小鼠的体重;末次给药后的第2 天脱颈处死小鼠剥离右侧前腋下的瘤块并称取重量,并计算抑瘤率。抑瘤率=(荷瘤模型组平均肿瘤重量-实验组平均肿瘤重量)/荷瘤模型组平均肿瘤重量×100%。
1.6.2 Lewis 肺癌组织中IL-2、TGF-β 的表达 对剥离并称重后的肿瘤组织采用免疫组化法检测IL-2和TGF-β 的表达,具体操作严格参照试剂盒说明书步骤进行。通过Image-Pro Plus 6.0 软件测量IOD/Area,并进一步对肿瘤组织中表达的IL-2、TGF-β 进行定位、定性及相对定量分析。
1.6.3 Lewis 肺癌组织中CTL 和Treg 的标志物CD3+CD8+与CD4+Foxp3+表达情况 对剥离并称重后的肿瘤组织采用免疫荧光技术检测CTL 和Treg 的标志物CD3+CD8+与CD4+Foxp3+表达,具体操作严格参照试剂盒说明书步骤进行。结果判读方法:在紫外光的激发下DAPI 染出的细胞核为蓝色,相对荧光素标记的红色光为其阳性表达,通过Image J 软件做最后处理。
1.7 统计学方法
采用SPSS 13.0 统计学软件进行数据分析,计量资料数据用均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠体重、瘤重及抑瘤率比较
用药前,各组小鼠体重比较,差异无统计学意义(P >0.05)。用药后,与荷瘤模型组比较,环磷酰胺组小鼠体重降低(P <0.01),阳和汤高、中剂量组小鼠体重增加(P <0.05 或P <0.01);与环磷酰胺组比较,阳和汤高、中、低剂量组小鼠体重增加(P <0.01);与阳和汤高剂量组比较,阳和汤低剂量组小鼠体重降低(P <0.05)。与荷瘤模型组比较,环磷酰胺组、阳和汤高剂量组小鼠瘤重降低(P <0.05 或P <0.01);与环磷酰胺组比较,阳和汤中、低剂量组小鼠瘤重增加(P <0.05);阳和汤高剂量组小鼠瘤重与环磷酰胺组比较,差异无统计学意义(P >0.05)。抑瘤率由高到底分别为环磷酰胺组、阳和汤高剂量组、阳和汤中剂量组、阳和汤低剂量组。见表1。

表1 各组小鼠体重、瘤重及抑瘤率比较
2.2 各组小鼠Lewis 肺癌组织中IL-2、TGF-β 表达比较
IL-2 和TGF-β 的表达位于细胞间质,呈黄色或棕黄色,见图1~2。与荷瘤模型组比较,环磷酰胺组小鼠Lewis 肺癌组织IL-2 表达降低(P <0.01),阳和汤高、中、低剂量组小鼠Lewis 肺癌组织IL-2 表达增加(P <0.05 或P <0.01);与环磷酰胺组比较,阳和汤高、中、低剂量组小鼠Lewis 肺癌组织IL-2 表达增加(P <0.01);与阳和汤高剂量组比较,阳和汤中、低剂量组小鼠Lewis 肺癌组织IL-2 表达降低(P <0.01)。与荷瘤模型组比较,环磷酰胺组,阳和汤高、中剂量组小鼠Lewis 肺癌组织TGF-β 表达降低(P <0.01);与环磷酰胺组比较,阳和汤中、低剂量组小鼠Lewis肺癌组织TGF-β 表达增加(P <0.05)。见表2。
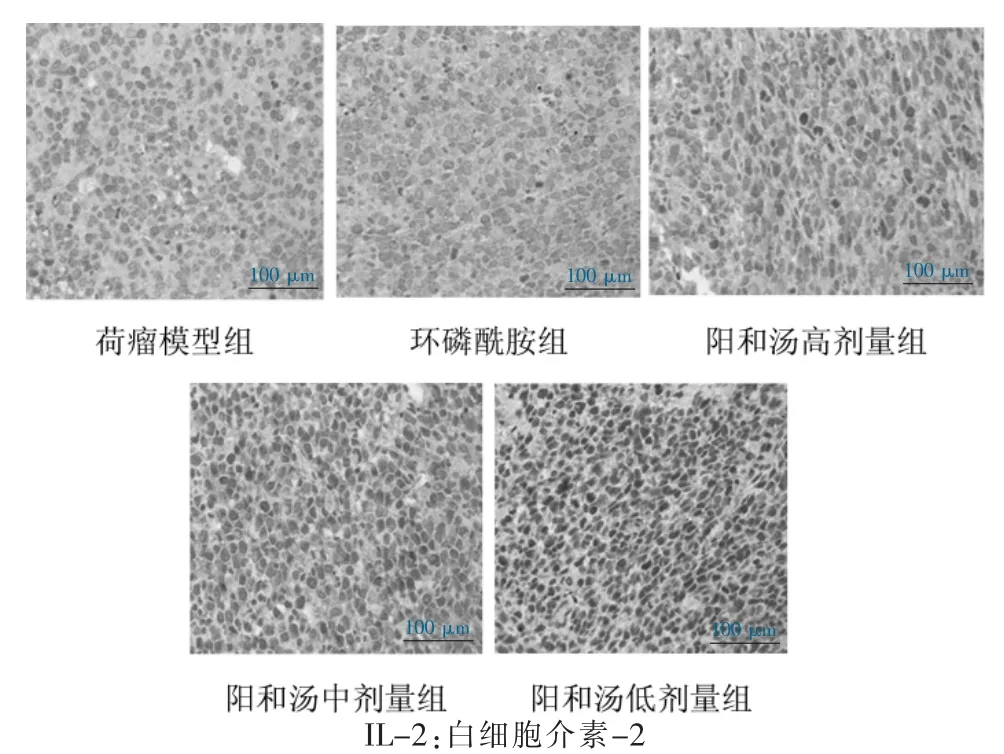
图1 小鼠Lewis 肺癌组织中IL-2 免疫组织化学法染色结果

图2 小鼠Lewis 肺癌组织中TGF-β 免疫组织化学法染色结果
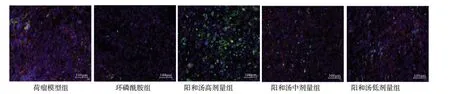
图3 小鼠Lewis肺癌组织中CD3+CD8+免疫荧光结果
表2 各组小鼠Lewis 肺癌组织中IL-2、TGF-β 表达比较()

表2 各组小鼠Lewis 肺癌组织中IL-2、TGF-β 表达比较()
注:与荷瘤模型组比较,aP <0.05、bP <0.01;与环磷酰胺组比较,cP <0.05、dP <0.01;与阳和汤高剂量组比较,eP <0.01。IL-2:白细胞介素-2;TGF-β:转化生长因子-β
2.3 各组小鼠Lewis 肺癌组织中CD3+CD8+与CD4+Foxp3+表达比较
免疫荧光检测中,阳和汤高剂量组CD3+CD8+的荧光强度强、密度最大;环磷酰胺组CD4+Foxp3+密度最小,其次是阳和汤高剂量组。见图3~4(封四)。与荷瘤模型组比较,环磷酰胺组小鼠Lewis 肺癌组织CD3+CD8+表达降低(P <0.01),阳和汤高、中、低剂量组小鼠Lewis 肺癌组织CD3+CD8+表达增加(P<0.05 或P <0.01);与环磷酰胺组比较,阳和汤高、中、低剂量组小 鼠Lewis 肺癌组织CD3+CD8+表达增加(P <0.01)。与阳和汤高剂量组比较,阳和汤中、低剂量组小鼠Lewis 肺癌组织CD3+CD8+表达降低(P <0.01)。与荷瘤模型组比较,环磷酰胺组,阳和汤高、中剂量组小鼠Lewis肺癌组织CD4+Foxp3+表达降低(P <0.05 或P<0.01)。见表3。
表3 各组小鼠Lewis 肺癌组织中CD3+CD8+与CD4+Foxp3+表达比较()

表3 各组小鼠Lewis 肺癌组织中CD3+CD8+与CD4+Foxp3+表达比较()
注:与荷瘤模型组比较,aP <0.05、bP <0.01;与环磷酰胺组比较,cP <0.01;与阳和汤高剂量组比较,dP <0.01
3 讨论
Stephen Paget 在1889 年提出的“种子与土壤”假说,为肿瘤微环境概念的提出奠定了基础[13]。肿瘤微环境是肿瘤细胞形成和增殖过程中所依赖的生长环境,是肿瘤发生和转移的关键因素[14-15],是机体的免疫系统发挥抗肿瘤免疫应答的主要场所,是抗肿瘤免疫的重要部分[16-17]。其中由免疫相关细胞和因子及其他活性成分构成的“肿瘤免疫微环境”影响着肿瘤的发生与发展[18-19]。在肿瘤免疫微环境中,CTL 在抗肿瘤免疫应答中对肿瘤细胞具有高度特异性和杀伤效应,与自然杀伤(natural killer,NK)细胞共同发挥抗肿瘤作用[20],该细胞主要标志物为CD3+CD8+。IL-2 又称T 细胞生长因子,能促进CTL 和NK 细胞活化和增殖[21-22],介导抗肿瘤的细胞毒效应。Treg 是一类具有免疫抑制功能的CD4+T 细胞功能亚群,其中表达CD4+Foxp3+的Treg 通过产生TGF-β 等细胞因子对肿瘤免疫微环境发挥免疫抑制作用[23-24]。同时TGF-β 又可诱导Treg 细胞的扩增[25]。
环磷酰胺的细胞毒性免疫抑制虽然有显著的抑瘤效应,但能降低荷瘤小鼠体重和肿瘤免疫微环境中IL-2、TGF-β 表达及CTL、Treg 的含量。高剂量阳和汤在抑瘤效应方面与环磷酰胺比较,差异无统计学意义(P <0.05),且不影响荷瘤小鼠的体重,并能促进肿瘤免疫微环境中发挥抗肿瘤效应的IL-2 表达和CTL 增加,降低肿瘤免疫微环境中具有抑制作用的TGF-β表达及Treg 的含量。阳和汤中、低剂量的抑瘤效应不是很明显,但在调节肿瘤免疫微环境中IL-2、TGF-β的表达和CTL、Treg 的含量方面发挥着一定的作用,且不影响荷瘤小鼠的体重。本研究结果显示,阳和汤对荷瘤小鼠的Lewis 肺癌组织具有一定的抑制作用。其抑制肿瘤的机制可能与影响肿瘤免疫微环境中IL-2、TGF-β 表达及CTL、Treg 的含量有关。应进一步开展阳和汤对肿瘤免疫微环境中的免疫相关细胞和因子及其它活性成分的影响研究,以深入探讨其抑瘤作用机制。
