Ca2+诱导HK-2细胞焦亡及黏附性变化对含钙肾结石形成的分子机制研究
2024-04-01向近杰吕懋鑫王梦悦张坤李颢
向近杰 吕懋鑫 王梦悦 张坤 李颢

摘要:目的 探究人腎皮质近曲小管上皮细胞(HK-2)经Ca2+作用后的焦亡经典通路激活及黏附性变化对含钙肾结石形成的作用及机制。方法 不同质量浓度的CaCl2(0、0.1、0.5、1.0、2.0、4.0、8.0 g/L)培养HK-2细胞24 h,使用细胞计数试剂盒(CCK-8)及流式细胞凋亡术检测筛选最佳处理浓度。使用透射电镜观察高钙环境下肾小管上皮细胞微结构的变化。在高钙处理后用2,7-二氯荧光素二乙酸酯(DCFH-DA)检测细胞内活性氧(ROS)的产生,并采用实时荧光定量聚合酶链式反应和Western blot法分别检测高钙刺激后HK-2细胞焦亡相关NOD样受体热蛋白结构域相关蛋白3(NLRP3)、胱天蛋白酶1(Caspase-1)、gasderminD(GSDMD)和黏附分子骨桥蛋白(OPN)、CD44的mRNA和蛋白表达水平变化,酶联免疫吸附试验检测白细胞介素(IL)-1β、IL-18和黏附分子单核细胞趋化蛋白1(MCP-1)在高钙刺激后的表达变化。结果 Ca2+对HK-2细胞生长具有细胞毒性并且可以促进其凋亡,Ca2+浓度越高,对HK-2细胞生长的毒性越大且凋亡率越高。高钙可以促进HK-2细胞发生细胞膜完整性缺失、内容物释放及胞内大量空泡产生等焦亡样形态学改变。与对照组相比,1.0 g/L及2.0 g/L CaCl2组的ROS表达水平依次升高,焦亡相关基因NLRP3、Caspase-1、GSDMD、IL-1β、IL-18以及黏附相关基因OPN、CD44、MCP-1的mRNA和蛋白表达水平均依次升高(P<0.05)。结论 高钙能使HK-2细胞发生氧化应激损伤并产生ROS,从而激活NLRP3炎症小体,进而导致细胞焦亡经典通路的激活和细胞黏附性的增加,最终间接促进肾结石的形成。
关键词:细胞焦亡;高钙尿症;活性氧;细胞黏附分子;肾结石
中图分类号:R349.5,R692.4文献标志码:ADOI:10.11958/20231036
Molecular mechanisms of Ca2+-induced pyroptosis and adhesion changes of HK-2 cells in the formation of calcium-containing kidney stones
XIANG Jinjie, LYU Maoxin, WANG Mengyue, ZHANG Kun, LI Hao△
Department of Urology, the First Affiliated Hospital of Kunming Medical University, Kunming 650032, China
△Corresponding Author E-mail: lihao834@sina.com
Abstract: Objective To investigate the possible role and mechanism of activation of pyroptosis classical pathway and alterations in cell adhesion in calcium-containing kidney stones after the action of high concentration of Ca2+ on HK-2 cells. Methods HK-2 cells were cultured in the presence of different concentrations of CaCl2 (0, 0.1, 0.5, 1.0, 2.0, 4.0 and 8.0 g/L) for 24 hours, and cell counting Kit-8 (CCK-8) and flow cytometry were used to determine the optimal treatment concentration. Subsequently, the ultrastructure of renal tubular epithelial cells under high Ca2+ condition was observed by transmission electron microscopy after Ca2+ treatment. DCFH-DA staining was used to detect intracellular reactive oxygen species production, and quantitative real-time polymerase chain reaction (qRT-PCR) and Western blot analysis were performed to examine the expression of pyroptosis-related proteins NLRP3, Caspase-1, gasdermin D (GSDMD), adhesive molecules osteopontin (OPN) and CD44 at mRNA and protein levels after high concentration Ca2+ treatment. The expression levels of pyroptosis-related inflammatory factors interleukin (IL)-1β, IL-18 and adhesive molecule monocyte chemotactic protein-1 (MCP-1) were detected by enzyme-linked immunosorbent assay (ELISA) after high Ca2+ stimulation. Results Ca2+ showed cytotoxicity for HK-2 cell growth and can promote apoptosis. The higher the Ca2+ concentration, the more toxicity and apoptosis rate for HK-2 cell growth. High concentration of Ca2+ can promote pyroptosis-like morphological changes in HK-2 cells, including loss of cell membrane integrity, release of contents and numerous intracellular vacuoles. Compared with the control group, the expression levels of ROS were sequentially increased in the 1.0 g/L CaCl2 group and the 2.0 g/L CaCl2 group, and the expression levels of pyroptosis-related genes NLRP3, Caspase-1, GSDMD, and the pyroptosis-associated inflammatory factors IL-1β and IL-18, as well as the adhesion molecules OPN, CD44 and MCP-1 were significantly increased (P<0.05). Conclusion High Ca2+ treatment can cause oxidative stress damage in HK-2 cells to produce ROS, which activates NLRP3 inflammasome, leads to the activation of the classical pathway of pyroptosis and increase the adhesion of cells, and ultimately leads to the formation of kidney stones.
Key words: pyroptosis; hypercalciuria; reactive oxygen species; cell adhesion molecules; kidney stones
细胞焦亡是一种新的程序性细胞死亡,也是机体的一种天然免疫反应。其经典通路为炎症小体介导并激活胱天蛋白酶(Caspase)-1,随后活化的Caspase-1切割孔道形成蛋白gasderminD(GSDMD)转化为GSDMD-N并在细胞膜上寡聚化形成焦亡孔隙,同时伴随白细胞介素(interleukin,IL)-1β、IL-18等炎性因子的释放,促进免疫炎症反应的发生[1-2]。细胞焦亡广泛参与诸多疾病的发生与调控,如代谢性疾病[3-4]、肾脏纤维化[5]以及多种肿瘤的发生与转移[6]等。肾结石也属于一种代谢性疾病,其发病率在北美、欧洲和亚洲分别为7%~14%、5%~9%和1%~5%[7],且复发率高达50%以上[8]。因此,探讨肾结石的发病机制对其预防和治疗具有重要意义。研究发现,大多数肾结石患者均有代谢异常,以高钙尿症最常见,占40%~60%[9]。另有研究认为,高钙尿是肾结石复发的主要诊断指标,结石复发患者24 h尿钙浓度比未复发患者高近50%[10]。有研究发现草酸钙(calcium oxalate,CaOx)结石的形成与肾小管上皮细胞发生的氧化应激损伤以及晶体黏附性增加有关,同时在结石形成中,细胞晶体诱导的炎症反应也起着至关重要的作用[11-12]。本研究通过体外实验模拟肾结石和特发性高钙尿症患者体内的高钙环境,旨在探讨高钙与细胞焦亡在肾结石形成中的作用机制,以期为肾结石的预防和治疗提供参考。
1 材料与方法
1.1 材料 HK-2细胞购自武汉普诺赛生命科技有限公司。DMEM/F12细胞培养基购自上海逍鹏生物科技有限公司;胎牛血清购自上海依科赛生物;兔抗人NOD样受体热蛋白结构域相关蛋白3(NLRP3)、Caspase-1、GSDMD、骨桥蛋白(OPN)、吞噬细胞糖蛋白-1(Pgp-1即CD44),β-肌动蛋白(β-actin),羊抗兔、鼠IgG抗体,IL-18酶联免疫吸附试验(ELISA)试剂盒以及细胞计数试剂盒(CCK-8)购自武汉三鹰公司;IL-1β、单核细胞趋化蛋白-1(MCP-1)ELISA试剂盒购自欣博盛生物科技有限公司;细胞凋亡检测试剂盒购自北京索莱宝科技有限公司;活性氧(ROS)检测试剂盒购自北京博奥森生物技术有限公司;RNA Easy Fast总RNA提取试剂盒购自天根生化科技有限公司;逆转录试剂盒和实时荧光定量聚合酶链式反应(qRT-PCR)试剂购自南京诺唯赞生物科技股份有限公司。
1.2 研究方法
1.2.1 细胞培养 HK-2细胞使用含10%胎牛血清、1%青/链霉素的DMEM/F12培养基在37 ℃、5%CO2的恒温培养箱中培养。取对数生长期细胞进行后续实验。
1.2.2 CCK-8法检测细胞活性 96孔板每孔接种约1×104个HK-2细胞,分为7组,每组6个复孔,每孔使用100 μL含不同质量浓度(0、0.1、0.5、1.0、2.0、4.0、8.0 g/L)CaCl2的培养液处理24 h,随后每孔中加入10 μL的CCK-8试剂,并置于37 ℃的恒温培养箱中孵育2 h,在450 nm波长处用多功能酶标仪测定各孔光密度(OD)值,细胞存活率=[(OD实验孔-OD空白孔)/(OD对照孔-OD空白孔)]×100%。选择与对照(0 g/L CaCl2处理)组比较细胞存活率出现显著下降、但不低于50%的质量浓度进行后续实验。
1.2.3 流式细胞术检测细胞凋亡 细胞接种于6孔板,每孔使用不同质量浓度(0、0.1、0.5、1.0、2.0、4.0、8.0 g/L)CaCl2的培养液处理24 h后收集细胞。每管加入400 μL Binding Buffer重悬细胞,分出3管分别用于空白、FITC和PI单阳对照。取100 μL悬液于5 mL流式管中,加入5 μL FITC和PI染料避光孵育5 min,再加入400 μL磷酸盐缓冲溶液(PBS)混匀后流式细胞仪上机检测。选择与对照(0 g/L CaCl2处理)组比较细胞凋亡率出现显著上升的浓度进行后续实验。
1.2.4 透射电镜法观察细胞微结构变化 用含1.0、2.0 g/L CaCl2的培养液处理HK-2细胞24 h,消化后1 000 r/min离心5 min收集细胞,加入2.5%戊二醛固定细胞团2 h后使用1%琼脂糖包裹,并使用1%锇酸再固定2 h,随后按照50%-70%-80%-90%-95%-100%-100%乙醇-100%丙酮-100%丙酮进行逐步脱水,每次15 min,丙酮包埋剂渗透,包埋切片,铀铅双染并干燥过夜后使用FEI Tecnai G2 Spirit透射电子显微镜采集图像分析。
1.2.5 2,7-二氯荧光素二乙酸酯(DCFH-DA)法檢测细胞内ROS水平 HK-2细胞接种于6孔板与激光共聚焦培养皿,对照组使用不含CaCl2的培养液,实验组使用含不同浓度(1.0、2.0 g/L)CaCl2的培养液培养24 h。采用DCFH-DA探针法检测细胞内ROS水平[13],激光共聚焦显微镜观察细胞内ROS荧光强度,流式细胞仪检测高钙环境下肾小管上皮细胞内氧化应激水平。
1.2.6 qRT-PCR 采用试剂盒提取各组细胞总RNA,Thermo Nanodrop 2000紫外分光光度计测定总RNA浓度。将1 μg的总RNA逆转录为cDNA,随后进行qRT-PCR实验。反应体系(20 μL):2 × ChamQ Universal SYBR qPCR Master Mix 10 μL,上、下游引物各0.5 μL,cDNA 1 μL,ddH2O 8 μL。反应条件:预变性95 ℃ 30 s;变性95 ℃ 10 s,退火、延伸60 ℃ 30 s,循环40次。引物序列见表1。以GAPDH为内参,2-ΔΔCt法检测HK-2细胞焦亡相关基因NLRP3、Caspase-1、GSDMD,焦亡炎症因子IL-1β、IL-18和黏附相关基因OPN、CD44、MCP-1的mRNA表达水平变化。
1.2.7 Western blot法检测细胞内焦亡和黏附相关蛋白相对表达水平 将细胞接种于6孔板中,使用含1.0、2.0 g/L CaCl2的培养基培养细胞24 h后提取各组细胞总蛋白。二喹啉甲酸(BCA)蛋白定量法测定各组蛋白质浓度,蛋白质样品使用10%的十二烷基硫酸钠-聚丙烯酰胺凝胶分离并转移到PVDF膜,于含5%脱脂奶粉的TBST中室温封闭2 h,洗膜后加入对应一抗NLRP3(1∶1 000)、Caspase-1(1∶2 000)、GSDMD(1∶2 000)、OPN(1∶1 000)、CD44(1∶2 000)、β-actin(1∶5 000)4 ℃孵育过夜,二抗(1∶5 000)室温下孵育1 h。ECL试剂显色,多功能成像系统拍照,以β-actin为内参蛋白,Image J软件分析目的蛋白条带相对灰度。
1.2.8 ELISA检测IL-18、IL-1β、MCP-1表达水平 用含1.0、2.0 g/L CaCl2的培养液处理HK-2细胞24 h后收集培养液,4 ℃、1 000 r/min离心10 min、取上清液,参照试剂盒说明书检测细胞培养上清液中IL-18、IL-1β及MCP-1表达水平。
1.3 统计学方法 采用Graphpad Prism 9.4.0软件进行数据分析。符合正态分布的计量数据以[x] ±s表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法。以P<0.05为差异有统计学意义。
2 结果
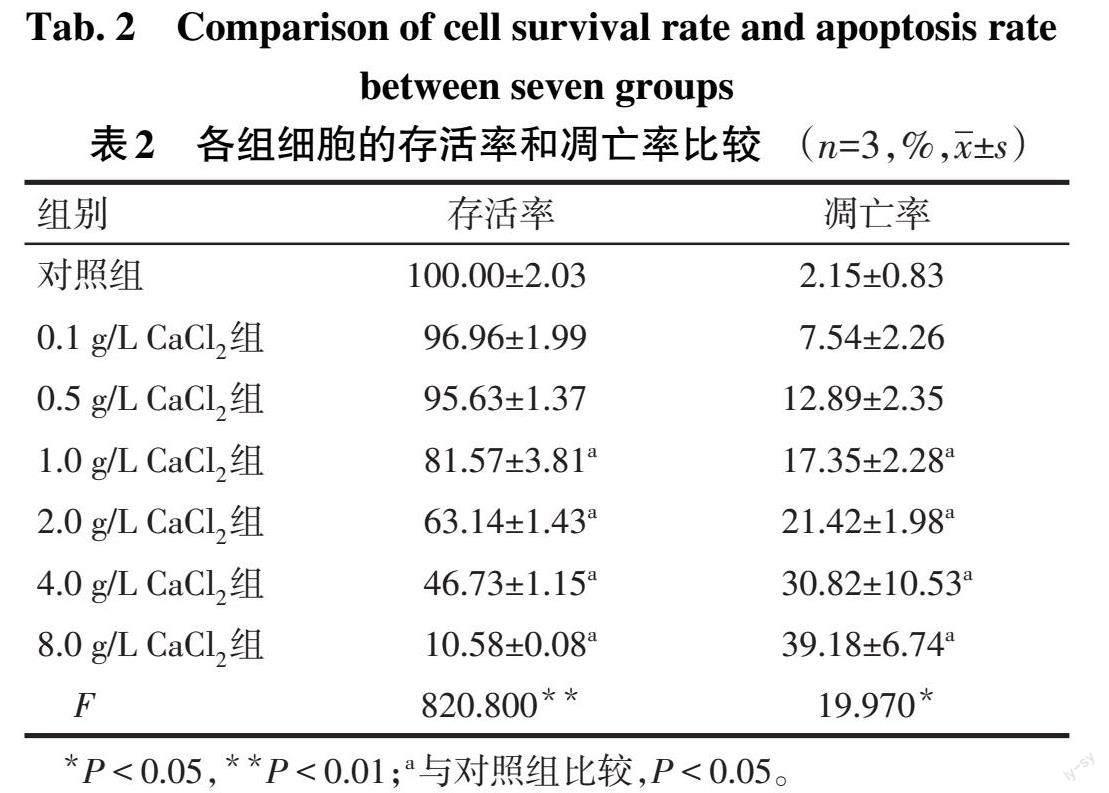
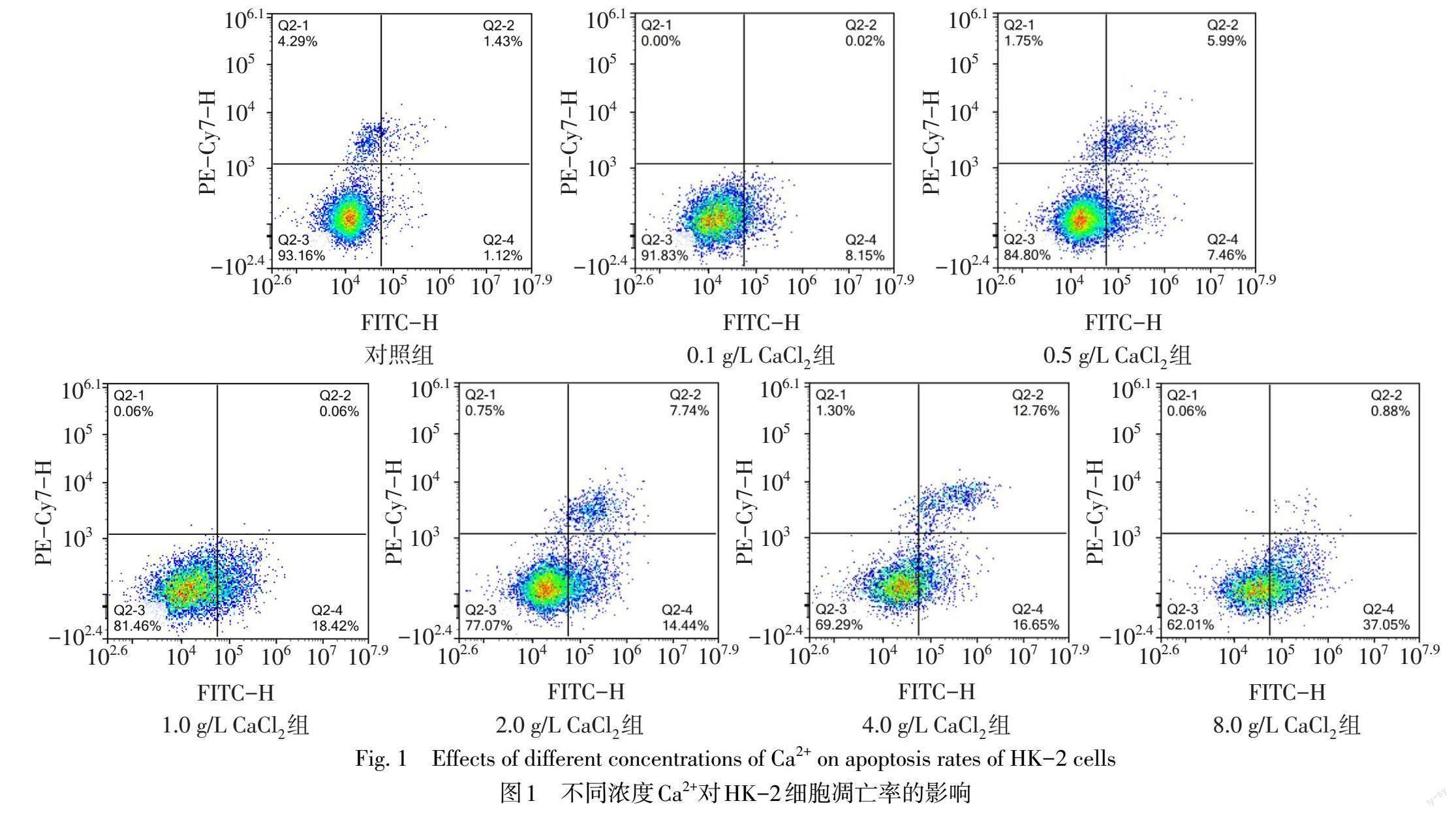
2.1 不同质量浓度Ca2+对HK-2细胞存活率及凋亡率的影响 细胞存活率随Ca2+质量浓度升高而降低;与对照组比较,Ca2+质量浓度≥1.0 g/L时细胞存活率明显降低(P<0.05),Ca2+质量浓度≥4.0 g/L时细胞存活率低于50%。细胞凋亡率随Ca2+质量浓度升高而增加;与对照组比较,Ca2+质量浓度≥1.0 g/L时,细胞凋亡率明显上升(P<0.05),见表2、图1。根据以上实验结果,使用1.0、2.0 g/L的CaCl2进行后续实验。
2.2 高钙对HK-2细胞微结构的影响 透射电镜下可见对照组细胞形态正常、胞膜完整、线粒体形态正常,而高钙组细胞出现细胞膜完整性缺失、内容物释放、线粒体明显肿胀以及胞内大量空泡产生等细胞焦亡相关的微结构变化,见图2。
2.3 高钙对HK-2细胞氧化应激水平的影响 激光共聚焦显微镜观察结果以及流式细胞仪检测结果显示,对照组、1.0 g/L CaCl2组及2.0 g/L CaCl2组ROS水平均依次升高(P<0.05),见图3。
2.4 各组焦亡和黏附相关基因mRNA表达水平比较 对照组、1.0 g/L CaCl2组及2.0 g/L CaCl2组细胞内焦亡相关基因NLRP3、Caspase-1、GSDMD、IL-1β、IL-18和黏附相关基因OPN、CD44、MCP-1的mRNA表达水平依次升高(P<0.05),见表3。
2.5 各组焦亡相关蛋白和黏附相关蛋白表达水平比较 见表4、图4。对照组、1.0 g/L CaCl2组及2.0 g/L CaCl2组细胞内焦亡相关蛋白NLRP3、Caspase-1、GSDMD和黏附相关蛋白OPN、CD44的表达水平依次升高(P<0.05)。
2.6 各组IL-18、IL-1β、MCP-1表达水平比较 对照组、1.0 g/L CaCl2组及2.0 g/L CaCl2组细胞培养上清液中焦亡相关炎性因子IL-1β、IL-18和黏附因子MCP-1的表达水平依次升高(P<0.05),见表5。
3 讨论
高钙尿症是含钙肾结石发生、发展的重要危险因素之一[9]。Ca2+不仅是晶体的阳离子成分,暴露在高水平的Ca2+中还会导致肾小管上皮细胞损伤,其损伤程度取决于持续时间和浓度,并且因损伤产生的炎性细胞因子可能在含钙肾结石的形成中起重要作用[14]。研究表明,CaOx晶体能够通过肾素血管紧张素系统激活还原型辅酶Ⅱ(NADPH)氧化酶复合体,从而产生ROS,导致硫氧还蛋白-1(thioredoxin-1,Trx1)与硫氧还蛋白结合蛋白(thioredoxin interacting protein,TXNIP)分離,进而使细胞中与NLRP3结合的TXNIP水平上升,这增加了NLRP3-TXNIP的关联,最终导致NLRP3炎症小体的激活[15],对肾小管上皮细胞造成炎症性损伤,进而促进CaOx结石的形成[16-17]。此外,暴露于高浓度草酸的肾小管上皮细胞也会启动氧化应激反应产生ROS,ROS会通过激活P38丝裂原活化蛋白酶通路增加细胞对晶体的黏附性,并且促进晶体的连接和聚集[18],而晶体的过度饱和与持续累积最终导致肾脏中结石的形成[19]。然而,暴露于高水平的Ca2+、草酸和CaOx晶体都会对肾小管上皮细胞造成损害,其中Ca2+和CaOx晶体均是通过ROS影响,但两者之间没有协同作用[14]。本研究结果显示,不同浓度Ca2+对肾小管上皮细胞均有细胞毒性作用,并且会促进细胞凋亡;Ca2+浓度越高,对细胞的毒性越大,细胞凋亡程度也越高。相关研究表明,0.5 g/L的Ca2+水平高于肾小管上皮细胞可能接触到的正常生理水平,然而在高钙尿(男女性的尿钙平均排泄量分别达到300mg/24 h和250 mg/24 h)条件下,肾结石和高钙尿症患者体内肾小管上皮细胞所暴露的Ca2+水平能达到1.0 g/L[14]。本研究结果亦显示,高钙(1.0、2.0 g/L CaCl2)会使肾小管上皮细胞发生氧化应激损伤产生ROS,而ROS能激活NLRP3炎症小体;透射电镜可见高钙刺激肾小管上皮细胞后会出现细胞膜破裂、空泡产生及内容物释放等焦亡形态样改变;qRT-PCR和Western blot结果同样证实,高钙会激活HK-2细胞NLRP/Caspase-1/GSDMD焦亡经典通路,并上调焦亡相关炎性因子IL-1β、IL-18的表达来促进肾小管上皮细胞发生焦亡及炎症反应,表明高钙能通过细胞焦亡诱发的炎症反应促进肾结石的形成。相关研究显示,肾小管上皮细胞焦亡和炎症程度与Ca2+浓度呈正相关,而炎症反应在肾结石的形成过程中起至关重要的作用[11-12]。此外,肾小管上皮细胞黏附性的增加能促进CaOx晶体黏附于细胞表面,在CaOx肾结石的形成中发挥着重要作用[20];而OPN、CD44、MCP-1的表达与肾小管上皮细胞的黏附性变化密切相关,是CaOx晶体附着所依赖的最广泛的蛋白[21-22]。本研究结果显示,高钙作用于肾小管上皮细胞后黏附相关因子OPN、CD44及MCP-1的mRNA与蛋白表达水平均明显上调,表明高钙亦能通过促进肾小管上皮细胞的黏附性发生变化,从而间接促进肾结石的发生发展。
綜上所述,高钙能通过促进HK-2细胞内ROS的产生来诱导NLRP3炎症小体的激活,进而激活NLRP3/Caspase-1/GSDMD经典细胞焦亡途径,诱发炎症反应,同时高钙能使肾小管上皮细胞的黏附性发生变化,最终在含钙肾结石的形成过程中发挥重要作用。
参考文献
[1] FRANK D,VINCE J E. Pyroptosis versus necroptosis: similarities,differences,and crosstalk [J]. Cell Death Differ,2019,26(1):99-114. doi:10.1038/s41418-018-0212-6.
[2] JACKSON D N,THEISS A L. Gut bacteria signaling to mitochondria in intestinal inflammation and cancer [J]. Gut Microbes,2020,11(3):285-304. doi:10.1080/19490976.2019.1592421.
[3] HUTTON H L,OOI J D,HOLDSWORTH S R,et al. The NLRP3 inflammasome in kidney disease and autoimmunity[J]. Nephrology (Carlton),2016,21(9):736-744. doi:10.1111/nep.12785.
[4] LI X,ZENG L,CAO C,et al. Long noncoding RNA MALAT1 regulates renal tubular epithelial pyroptosis by modulated miR-23c targeting of ELAVL1 in diabetic nephropathy[J]. Exp Cell Res,2017,350(2):327-335. doi:10.1016/j.yexcr.2016.12.006.
[5] XU G,YUE F,HUANG H,et al. Defects in MAP1S-mediated autophagy turnover of fibronectin cause renal fibrosis[J]. Aging(Albany NY),2016,8(5):977-985. doi:10.18632/aging.100957.
[6] HOU J,ZHAO R,XIA W,et al. PD-L1-mediated gasdermin C expression switches apoptosis to pyroptosis in cancer cells and facilitates tumour necrosis[J]. Nat Cell Biol,2020,22(10):1264-1275. doi:10.1038/s41556-020-0575-z.
[7] THONGPRAYOON C,KRAMBECK A E,RULE A D. Determining the true burden of kidney stone disease[J]. Nat Rev Nephrol,2020,16(12):736-746. doi:10.1038/s41581-020-0320-7.
[8] THONGBOONKERD V. Proteomics of crystal-cell interactions:a model for kidney stone research[J]. Cells,2019,8(9):1076. doi:10.3390/cells8091076.
[9] COE F L,WORCESTER E M,EVAN A P. Idiopathic hypercalciuria and formation of calcium renal stones[J]. Nat Rev Nephrol,2016,12(9):519-533. doi:10.1038/nrneph.2016.101.
[10] DAUDON M,HENNEQUIN C,BOUJELBEN G,et al. Serial crystalluria determination and the risk of recurrence in calcium stone formers[J]. Kidney Int,2005,67(5):1934-1943. doi:10.1111/j.1523-1755.2005.00292.x.
[11] ANDERS H J,SUAREZ-ALVAREZ B,GRIGORESCU M,et al. The macrophage phenotype and inflammasome component NLRP3 contributes to nephrocalcinosis-related chronic kidney disease independent from IL-1-mediated tissue injury[J]. Kidney Int,2018,93(3):656-669. doi:10.1016/j.kint.2017.09.022.
[12] KHAN S R,CANALES B K,DOMINGUEZ-GUTIERREZ P R. Randall's plaque and calcium oxalate stone formation:role for immunity and inflammation[J]. Nat Rev Nephrol,2021,17(6):417-433. doi:10.1038/s41581-020-00392-1.
[13] RIZVI S H M,PARVEEN A,AHMAD I,et al. Aluminum activates PERK-EIF2α signaling and inflammatory proteins in human neuroblastoma SH-SY5Y cells[J]. Biol Trace Elem Res,2016,172(1):108-119. doi:10.1007/s12011-015-0553-7.
[14] KHASKHALI M H,BYER K J,KHAN S R. The effect of calcium on calcium oxalate monohydrate crystal-induced renal epithelial injury[J]. Urol Res,2009,37(1):1-6. doi:10.1007/s00240-008-0160-6.
[15] JOSHI S,WANG W,PECK A B,et al. Activation of the NLRP3 inflammasome in association with calcium oxalate crystal induced reactive oxygen species in kidneys[J]. J Urol,2015,193(5):1684-1691. doi:10.1016/j.juro.2014.11.093.
[16] LIN Q,LI S,JIANG N,et al. PINK1-parkin pathway of mitophagy protects against contrast-induced acute kidney injury via decreasing mitochondrial ROS and NLRP3 inflammasome activation[J]. Redox Biol,2019,26:101254. doi:10.1016/j.redox.2019.101254.
[17] LIU Q,LIU Y,GUAN X,et al. Effect of M2 macrophages on injury and apoptosis of renal tubular epithelial cells induced by calcium oxalate crystals[J]. Kidney Blood Press Res,2019,44(4):777-791. doi:10.1159/000501558.
[18] QI S,WANG Q,XIE B,et al. P38 MAPK signaling pathway mediates COM crystal-induced crystal adhesion change in rat renal tubular epithelial cells[J]. Urolithiasis,2020,48(1):9-18. doi:10.1007/s00240-019-01143-z.
[19] KHAN S R. Reactive oxygen species,inflammation and calcium oxalate nephrolithiasis[J]. Transl Androl Urol,2014,3(3):256-276. doi:10.3978/j.issn.2223-4683.2014.06.04.
[20] QIN B,WANG Q,LU Y,et al. Losartan ameliorates calcium oxalate-induced elevation of stone-related proteins in renal tubular cells by inhibiting NADPH oxidase and oxidative stress[J]. Oxid Med Cell Longev,2018,2018:1271864. doi:10.1155/2018/1271864.
[21] ASSELMAN M,VERHULST A,DE BROE M E,et al. Calcium oxalate crystal adherence to hyaluronan-,osteopontin-,and CD44-expressing injured/regenerating tubular epithelial cells in rat kidneys[J]. J Am Soc Nephrol,2003,14(12):3155-3166. doi:10.1097/01.asn.0000099380.18995.f7.
[22] WANG Z,LI M X,XU C Z,et al. Comprehensive study of altered proteomic landscape in proximal renal tubular epithelial cells in response to calcium oxalate monohydrate crystals[J]. BMC Urol,2020,20(1):136. doi:10.1186/s12894-020-00709-z.
(2023-07-12收稿 2023-09-26修回)
(本文編辑 陆荣展)
