慢性鼻窦炎患者MMP-9的表达及与上皮间质转化的相关性研究
2024-04-01宋喜葛益林李殷宋辉成嘉明
宋喜 葛益林 李殷 宋辉 成嘉明

摘要:目的 探討基质金属蛋白酶(MMP)-9参与慢性鼻窦炎(CRS)上皮间质转化(EMT)的过程及机制。方法 收集42例需手术治疗的CRS患者息肉样变的中鼻甲组织以及8例行鼻中隔成形术患者的中鼻甲组织,免疫组织化学染色、qPCR和Western blot检测MMP-9的表达。体外培养原代人鼻上皮细胞HNEpc,分为Control组、TGF-β1组(5 μg/L TGF-β1干预)和TGF-β1+si-MMP-9组(转染si-MMP-9和5 μg/L TGF-β1干预)。细胞免疫荧光染色检测MMP-9表达,Western blot检测TGF-β1、MMP-9和EMT相关蛋白E-钙黏蛋白(E-Cadherin)、波形蛋白(vimentin)、α-平滑肌肌动蛋白(α-SMA)表达。结果 (1)CRS伴鼻息肉(CRSwNP)组患者鼻黏膜组织中MMP-9表达阳性率(54.5%,12/22)明显高于CRS不伴息肉(CRSsNP)组(25.0%,5/20)和对照组(12.8%,1/8)。CRSwNP组患者鼻黏膜中MMP-9 mRNA和蛋白相对表达水平均高于CRSsNP组和对照组(P<0.05)。(2)与Control组相比,TGF-β1组TGF-β1、MMP-9、vimentin、α-SMA表达升高,E-cadherin表达下降(P<0.05)。与TGF-β1组相比,TGF-β1+si-MMP-9组TGF-β1、MMP-9、vimentin、α-SMA表达下降,E-cadherin表达升高(P<0.05)。结论 CRS患者MMP-9表达升高,其可能通过调控EMT来参与CRS发生发展。
关键词:慢性鼻窦炎;MMP-9;TGF-β1;上皮间质转化;组织重塑
中图分类号:R765.4文献标志码:ADOI:10.11958/20231439
Expression of MMP-9 in patients with chronic rhinosinusitis and its correlation with
epithelial-mesenchymal transition
SONG Xi, GE Yilin△, LI Yin, SONG Hui, CHENG Jiaming
Department of Otolaryngology, Head and Neck Surgery, Changsha First Hospital, Changsha 410005, China
△Corresponding Author E-mail: paigug@163.com
Abstract: Objective To investigate the mechanism of matrix metalloproteinase (MMP)-9 involved in epithelial mesenchymal transformation (EMT) in chronic sinusitis (CRS). Methods The expression of MMP-9 from polypoid middle turbinate tissue was detected by immunohistochemical staining qPCR and Western blot assay in 42 patients with CRS and 8 patients underwent septoplasty. Primary human nasal epithelial cells HNEpc were cultured in vitro and divided into the control group, the TGF-β1 group (5 μg/L TGF-β1 intervention) and the TGF-β1+si-MMP-9 group (transfected with si-MMP-9 and 5 μg/L TGF-β1 intervention). The expression of MMP-9 was detected by cell immunofluorescence staining. Expression levels of TGF-β1, MMP-9 and EMT-related proteins E-cadherin, vimentin and α-SMA were detected by Western blot assay. Results (1) The positive expression rate of MMP-9 was significantly higher in the nasal mucosa of CRS with nasal polyps (CRSwNP) group (54.5%, 12/22) than that of the CRS without polyps (25.0%, 5/20) group and the control group (12.8%, 1/8). The relative expression levels of MMP-9 mRNA and protein in nasal mucosa were higher in the CRSwNP group than those in the CRSsNP group and the control group (P<0.05). (2) Compared with the control group, the expressions levels of TGF-β1, MMP-9, vimentin and α-SMA were increased in the TGF-β1 group, while the expression of E-cadherin was decreased (P<0.05). Compared with the TGF-β1 group, expression levels of TGF-β1, MMP-9, vimentin and α-SMA were decreased in the TGF-β1+si-MMP-9 group, and the expression of E-cadherin was increased (P<0.05). Conclusion The expression of MMP-9 is increased in CRS patients, which may be involved in the development of CRS through the regulation of EMT.
Key words: chronic sinusitis; MMP-9; TGF-β1; epithelial mesenchymal transformation; tissue remodeling
慢性鼻窦炎(CRS)是一种由多种因素导致的鼻窦黏膜疾病,其特征是炎性细胞浸润、上皮细胞分化改变和组织重塑[1]。该病治疗效果不理想,发作频繁,需反复手术治疗,是耳鼻喉科棘手的问题之一[2]。根据鼻内镜检查结果将CRS分为2种表型:CRS伴鼻息肉(CRSwNP)和CRS不伴息肉(CRSsNP),两者临床表现有较大的异质性。近年来研究发现,细胞外基质(ECM)的沉积是鼻窦炎从慢性炎症进展为息肉的主要因素[3]。基质金属蛋白酶9(MMP-9)是基质金属蛋白酶家族成员之一,其在调节ECM平衡中起着关键的作用,不仅直接影响ECM成分的降解、合成和转运,还可以募集炎性细胞分泌炎性因子,调节ECM性状[4-5]。虽然具体的发病机制尚不明确,但目前认为上皮间质转化(EMT)在其中发挥了重要的作用。在此过程中,上皮细胞的极性消失,同时出现具有间质细胞特征的蛋白表达升高、ECM成分改变、细胞迁移和运动能力增加的现象。MMP-9能否通过EMT影响CRS的病理生理过程,具体机制暂未阐明。本研究拟通过体内和体外研究探讨CRS患者鼻黏膜组织中MMP-9的表达及MMP-9参与调节EMT来影响CRS的作用机制,为CRS的诊治提供新的治疗靶点及理论依据。
1 资料与方法
1.1 临床资料 选取2021年5月—2022年5月長沙市第一医院耳鼻咽喉头颈外科就诊的CRS患者42例。包括22例CRSwNP患者[CRSwNP组,男12例,女10例,平均年龄(40.5±4.1)岁]和20例CRSsNP患者[CRSsNP组,男12例,女8例,平均年龄(40.2±4.1)岁]。另收集同期8例行鼻中隔成形术患者作为对照组,男4例,女4例,平均年龄(41.3±3.5)岁。病例组纳入标准:(1)病程大于3个月,经药物治疗后无改善,包括全身抗生素和局部类固醇至少14 d。在筛窦和(或)上颌窦手术期间收集所有CRS患者的鼻黏膜或息肉组织;对照组取中鼻甲黏膜组织,取材后于-80 ℃冰箱保存。本研究经过长沙市第一医院伦理委员会批准(批准号:KX-20200079),所有患者知情同意。
1.2 主要试剂 原代人鼻上皮细胞HNEpc购自中国北京BeNa细胞培养库,接种于含10%胎牛血清(FBS)的RPMI-1640培养基,在37 ℃、5%CO2培养箱中常规培养。Lipofectamine 2000细胞转染试剂购自美国Invitrogen公司,人MMP-9免疫组化染色试剂盒购自上海圻明生物科技有限公司。人MMP-9酶联免疫吸附试验(ELISA)检测试剂盒购自北京普利莱基因技术有限公司。兔抗人MMP-9、转化生长因子-β1(TGF-β1)、E-钙黏蛋白(E-cadherin)、波形蛋白(vimentin)、α-平滑肌肌动蛋白(α-SMA)和β-actin一抗购自南京建成生物工程研究所,辣根过氧化物酶标记的羊抗兔IgG二抗购自上海研卉生物科技有限公司。
1.3 免疫组化染色检测MMP-9表达 将3组鼻息肉或黏膜组织经4%多聚甲醛固定,石蜡包埋,切片(厚度5 μm)。脱蜡处理后滴加MMP-9(1∶500)一抗。PBS洗3次后,滴加辣根过氧化物酶偶联的IgG二抗(1∶1 000),37 ℃孵育45 min,然后再次在PBS中洗涤,并与亲和素-孵育生物素过氧化物酶孵育30 min。水洗后用苏木精染色,水洗后甘油封片,显微镜下观察。由2名病理学医师评价MMP-9表达水平,参照文献[6]计算阳性表达率。
1.4 qPCR 分别取3组鼻息肉或黏膜组织,Trizol法提取总RNA后逆转录为cDNA,采用qPCR检测组织中MMP-9表达。MMP-9引物:上游5'-CAGTACCGAGAGAAAGCCTATT-3,下游5'-CAGGATGTCATAGGTCACGTAG-3'。内参GAPDH引物:上游5'-GAAGGTGAAGGTCGGAGTC-3',下游5'-GAAGATGGTGATGGGATTTC-3'。25 μL反应体系包含cDNA 3 μL,上、下游引物各1 μL,PCR mix 10 μL,DNAse-free H2O 10 μL。反应参数:95 ℃变性5 min;95 ℃ 15 s,55 ℃ 1 min,72 ℃ 1 min,40个循环;72 ℃ 10 min。采用2-ΔΔCt法计算相对表达量,实验重复3次。
1.5 细胞培养及分组干预 取约1×104个HNEpc细胞接种于含1%双抗、10%FBS的RPMI 1640培养基中,37 ℃、5%CO2培养24 h后接种于六孔板中。细胞分为对照组、TGF-β1组和TGF-β1+si-MMP-9组,TGF-β1组加入终浓度为5 μg/L的TGF-β1[7],对照组添加等体积的培养基。TGF-β1+si-MMP-9组在TGF-β1干预前24 h参照Lipofectamine 2000说明书转染si-MMP-9。分组处理结束后继续培养48 h,收集细胞,用于后续实验。
1.6 免疫荧光染色检测MMP-9表达 3组细胞用4%多聚甲醛固定,用0.5% Triton X-100通透30 min,5% BSA在室温下孵育1 h。滴加MMP-9一抗与Alexa Fluor 594-驴抗兔lgG抗体,最后用4',6-二脒基-2-苯基吲哚(DAPI)核染。使用共聚焦显微镜观察染色图像,统计MMP-9阳性细胞数,实验重复3次。
1.7 Western blot检测蛋白表达 3组组织和细胞在4 ℃下用裂解液裂解30 min,12 000 r/min离心15 min分离上清液,使用BCA蛋白测定试剂盒测定蛋白质浓度。每个样本取20 μg蛋白上样,进行SDS-PAGE,湿转法恒流20 mA转膜50 min将目的蛋白转移到PVDF膜上。5%脱脂奶粉在室温下封闭1.5 h,根据研究目的,添加TGF-β1、MMP-9、E-cadherin、vimentin、α-SMA和β-actin一抗(均为1∶1 000稀释),于4 ℃孵育过夜。次日PBS洗膜3次,每次5 min,在室温添加辣根过氧化物酶偶联IgG二抗(1∶2 000),孵育90 min,使用增强型化学发光系统检测蛋白表达,并计算相对表达量,实验重复3次。
1.8 统计学方法 采用SPSS 25.0软件进行数据分析,计量数据符合正态分布用[x] ±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,计数资料以例(%)表示,组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
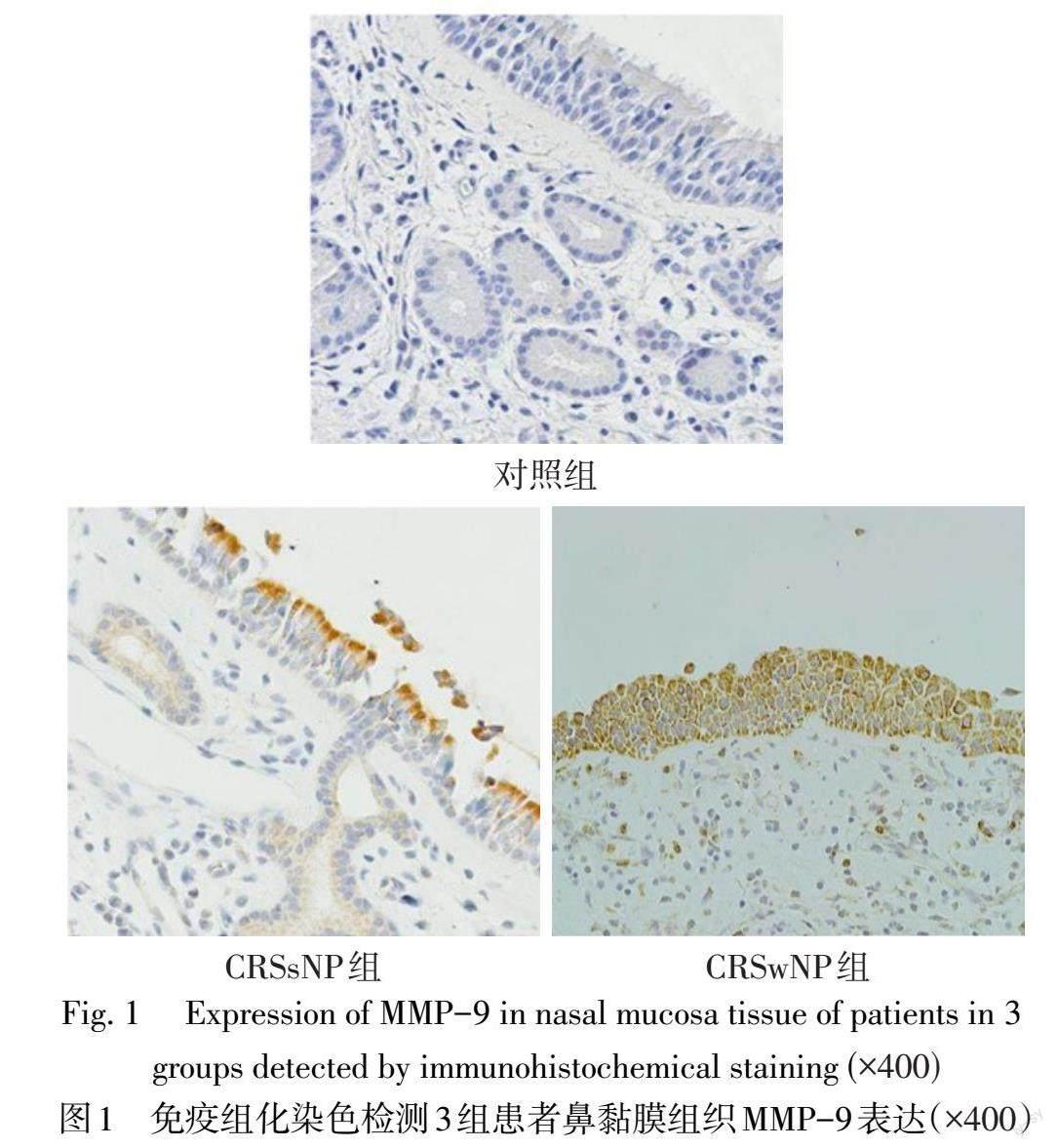
2.1 3组患者MMP-9表达情况及阳性率 免疫组化染色结果显示,MMP-9主要表达于黏膜上皮细胞中,呈棕黄色染色,见图1。与对照组(12.5%,1/8)和CRSsNP組(25.0%,5/20)相比,CRSwNP组患者鼻黏膜组织中MMP-9表达阳性率(54.5%,12/22)明显升高,差异有统计学意义(χ2=6.252,P<0.05)。
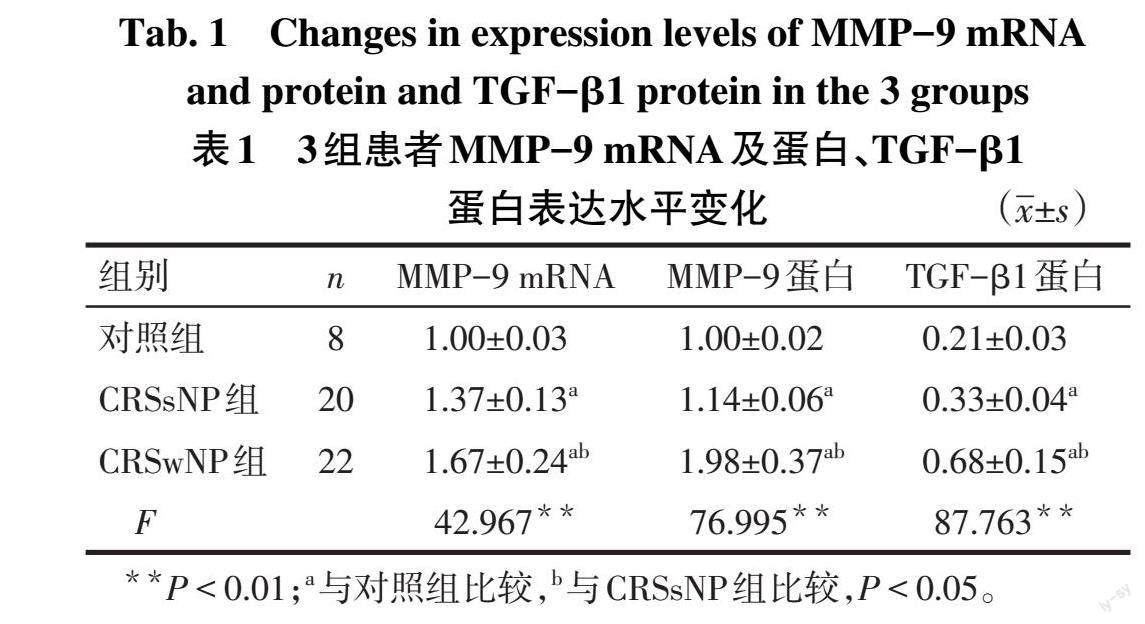
2.2 3组患者中MMP-9和TGF-β1表达水平比较 Western blot结果显示,与对照组相比,CRSwNP组和CRSsNP组MMP-9 mRNA和蛋白、TGF-β1蛋白表达升高(P<0.05),与CRSsNP组相比,CRSwNP组MMP-9 mRNA和蛋白、TGF-β1蛋白表达升高(P<0.05),见图2、表1。
2.3 3组细胞中MMP-9表达变化 细胞免疫荧光染色结果显示,Control组可见少量细胞表达MMP-9,TGF-β1组可见大量细胞表达MMP-9。与TGF-β1组相比,TGF-β1+si-MMP组MMP-9阳性细胞数减少,见图3。
2.4 3组细胞中TGF-β1、MMP-9及EMT相关蛋白表达水平变化 见图4、表2。与Control组相比,TGF-β1组TGF-β1、MMP-9、vimentin、α-SMA表达升高,E-cadherin表达下降。与TGF-β1组相比,TGF-β1+si-MMP-9组TGF-β1、MMP-9、vimentin、α-SMA表达下降,E-cadherin表达升高,敲低MMP-9表达后可逆转EMT进程。
3 讨论
CRSwNP和CRSsNP的病理形态和临床表现差异较大,CRSsNP主要表现为鼻黏膜水肿、炎症细胞浸润、纤维化,但在CRSwNP中,可在黏膜下区域观察到假性囊肿,这是由于结缔组织内因异常间质液体积聚而形成的水肿腔[8-9]。组织重构是过敏性鼻炎或CRS鼻黏膜组织的重要病理改变,它可引起鼻黏膜固有层、黏膜下区域炎症细胞浸润、基底膜增厚、细胞水肿和纤维化,表现为慢性单核细胞和嗜酸性粒细胞浸润、α-SMA和肌成纤维细胞增加、基底膜和黏膜下胶原沉积增加。然而,CRS尤其是CRSwNP患者的组织重塑和息肉形成的机制尚不清楚。MMP-9主要参与Ⅳ型胶原的降解,是鼻黏膜上皮细胞外基质和基底膜的重要组成部分。除了在细胞迁移和增殖中起作用外,MMP-9还被发现可调节微血管通透性和由此引起的下气道水肿[10]。本研究发现,与对照组和CRSsNP组相比,CRSwNP组鼻黏膜组织中MMP-9的表达明显升高,提示MMP-9可能参与了CRSsNP向CRSwNP的进展过程。Lygeros等[11]检测了37例CRSwNP患者的鼻黏膜标本和12例健康对照者的鼻黏膜标本,发现CRSwNP患者的MMP-9 mRNA和蛋白表达水平明显升高,其可能是CRSwNP有价值的生物标志物和治疗靶点,与本研究结果相一致。
EMT是上皮细胞失去上皮特性,获得间充质特性并最终形成成纤维细胞的特征,这也是完全分化的上皮细胞发生表型转化并发展成间充质细胞表型的过程[12]。近年来有研究发现,CRS存在EMT,它可诱导上皮细胞的丢失和肌成纤维细胞的分化[13-14]。TGF-β1是炎症修复和重塑中的代表性细胞因子,其通过激活EMT信号促进鼻黏膜的组织重塑,在鼻息肉的形成和生长中发挥重要作用[15]。TGF-β1通过与细胞表面的Ⅰ型和Ⅱ型受体丝氨酸/苏氨酸激酶结合启动EMT信号通路,通过受体介导Smad转录因子的激活,调节基因表达。但目前有关CRSwNP中TGF-β1表达的报道尚不一致。有研究发现,与健康对照和CRSsNP患者相比,CRSwNP患者中TGF-β1表达明显升高[16];而另有研究认为,与CRSsNP组和正常对照组相比,CRSwNP组TGF-β1表达水平较低[17]。本研究结果显示,CRSwNP患者鼻黏膜组织中TGF-β1表达水平高于其他两组。为进一步为探讨其具体作用机制,本研究通过TGF-β1诱导HNEpc细胞后,发现与对照组相比,TGF-β1组TGF-β1、vimentin、MMP-9、α-SMA蛋白表达明显升高,E-cadherin表达明显下降,提示HNEpc发生了EMT,而经过转染si-MMP-9后,TGF-β1、vimentin、MMP-9、α-SMA蛋白表达明显下降,E-cadherin表达明显升高,提示敲低MMP-9可延缓TGF-β1诱导HNEpc细胞后的EMT进程。综上所述,CRS患者MMP-9表达升高,其可能通过促进EMT来诱导鼻黏膜组织重塑。
参考文献
[1] HELLINGS P W,VERHOEVEN E,FOKKENS W J. State-of-the-art overview on biological treatment for CRSwNP[J]. Rhinology,2021,59(2):151-163. doi:10.4193/Rhin20.570.
[2] BACHERT C,MARPLE B,SCHLOSSER R J,et al. Adult chronic rhinosinusitis[J]. Nat Rev Dis Primers,2020,6(1):86. doi:10.1038/s41572-020-00218-1.
[3] 乔新杰. 慢性鼻窦炎中上皮间质转化信号转导通路及其他相关因子的研究进展[J]. 山东大学耳鼻喉眼学报,2022,36(3):71-77. QIAO X J. Research progress on the signal transduction pathway and other factors related to epithelial-mesenchymal transformation in chronic rhinosinusitis[J]. Journal of Otolaryngology and Ophthalmology of Shandong University,2022,36(3):71-77.doi:10.6040/j.issn.1673-3770.0.2021.581.
[4] AGRAVAL H,YADAV U. MMP-2 and MMP-9 mediate cigarette smoke extract-induced epithelial-mesenchymal transition in airway epithelial cells via EGFR/Akt/GSK3β/β-catenin pathway: Amelioration by fisetin[J]. Chem Biol Interact,2019,314:108846. doi:10.1016/j.cbi.2019.108846.
[5] LI Y,HE J,WANG F,et al. Role of MMP-9 in epithelial-mesenchymal transition of thyroid cancer[J]. World J Surg Oncol,2020,18(1):181. doi:10.1186/s12957-020-01958-w.
[6] SANTOS B,DUTRA R C,SANTOS A,et al. Immunohistochemistry of resorption and inflammation factors in the periodontal ligament of human deciduous teeth[J]. Braz Oral Res,2022,36:e056. doi:10.1590/1807-3107bor-2022.vol36.0056.
[7] LI X,LI C,ZHU G,et al. TGF-β1 induces epithelial-mesenchymal transition of chronic sinusitis with nasal polyps through MicroRNA-21[J]. Int Arch Allergy Immunol,2019,179(4):304-319. doi:10.1159/000497829.
[8] 王曉燕,孟一帆,王成硕,等. 慢性鼻窦炎钩突内外侧面黏膜组织病理学差异[J]. 临床耳鼻咽喉头颈外科杂志,2022,36(2):95-100. WANG X Y,MENG Y F,WANG C S,et al. The investigation of the histological differences between the mucosa on the nasal and sinus sides of uncinate process of chronic rhinosinusitis[J]. Journal of Clinical Otorhinolaryngology Head and Neck Surgery,2022,36(2):95-100. doi:10.13201/j.issn.2096-7993.2022.02.004.
[9] 刘肖,刘红兵,李春花,等. 不同临床表型的慢性鼻窦炎的微生物学研究[J]. 临床耳鼻咽喉头颈外科杂志,2020,34(9):805-810. LIU X,LIU H B,LI C H,et al. Microbiology of chronic rhinosinusitis with different clinical phenotypes[J]. Journal of Clinical Otorhinolaryngology Head and Neck Surgery,2020,34(9):805-810. doi:10.13201/j.issn.2096-7993.2020.09.009.
[10] ZOU F,ZHANG J,XIANG G,et al. Association of matrix metalloproteinase 9(MMP-9)polymorphisms with asthma risk:a Meta-analysis[J]. Can Respir J,2019,2019:9260495. doi:10.1155/2019/9260495.
[11] LYGEROS S,DANIELIDES G,KYRIAKOPOULOS G C,et al. Expression profiles of MMP-9 and EMMPRIN in chronic rhinosinusitis with nasal polyps[J]. Acta Otorhinolaryngol Ital,2023,43(6):400-408. doi:10.14639/0392-100X-N2197.
[12] XIA Y,WANG H,YIN J. The role of epithelial-mesenchymal transition in chronic rhinosinusitis[J]. Int Arch Allergy Immunol,2022,183(10):1029-1039. doi:10.1159/000524950.
[13] LI H,LIU Q,WANG H,et al. Epithelial?mesenchymal transition in chronic rhinosinusitis (CRS) and the prognostic value of α?SMA in postoperative outcomes of patients with CRS[J]. Mol Med Rep,2019,20(3):2441-2449. doi:10.3892/mmr.2019.10461.
[14] HE Y,FU Y,WU Y,et al. Pathogenesis and treatment of chronic rhinosinusitis from the perspective of sinonasal epithelial dysfunction[J]. Front Med(Lausanne),2023,10:1139240. doi:10.3389/fmed.2023.1139240.
[15] QIN D,LIU P,ZHOU H,et al. TIM-4 in macrophages contributes to nasal polyp formation through the TGF-β1-mediated epithelial to mesenchymal transition in nasal epithelial cells[J]. Front Immunol,2022,13:941608. doi:10.3389/fimmu.2022.941608.
[16] LI J,LIU X,SHA M,et al. The balance between HGF and TGF-β1 acts as a switch in the tissue remodeling of chronic rhinosinusitis[J]. Int J Clin Exp Pathol,2019,12(3):933-940.
[17] LI X,MENG J,QIAO X,et al. Expression of TGF,matrix metalloproteinases, and tissue inhibitors in Chinese chronic rhinosinusitis[J]. J Allergy Clin Immunol,2010,125(5):1061-1068. doi:10.1016/j.jaci.2010.02.023.
(2023-09-20收稿 2023-11-06修回)
(本文编辑 胡小宁)
