预防对比剂相关性急性肾损伤的研究进展
2024-04-01樊汇马宇李曦铭
樊汇 马宇 李曦铭

摘要:对比剂相关性急性肾损伤(CA-AKI)是在診断或介入手术中使用对比剂所引起的一种严重并发症,目前已成为住院患者新发急性肾功能不全的主要原因之一。选择相对低毒的对比剂,减少对比剂暴露的时间和剂量对CA-AKI有一定的预防作用,他汀等药物以及术前术后的水化能够降低CA-AKI的风险,目前纳米药物已被证明在动物模型中获益。该文就当前CA-AKI的防治进行综述,为进一步深入研究新的干预措施奠定基础,并为临床治疗提供理论依据。
关键词:造影剂;急性肾损伤;羟甲基戊二酰基CoA还原酶抑制剂;纳米粒子;补液疗法
中图分类号:R692文献标志码:ADOI:10.11958/20230617
Research progress in the prevention of contrast-related acute kidney injury
FAN Hui1, MA Yu2, LI Ximing2,3△
1 Tianjin Medical University, Tianjin 300070, China; 2 Department of Cardiology, Chest Hospital of Tianjin University; 3 Tianjin Key Laboratory of Cardiovascular Emergency and Critical Care
△Corresponding Author E-mail: ljsunlight@126.com
Abstract: Contrast-associated acute kidney injury (CA-AKI) is an important complication caused by the use of contrast medium (CM) in diagnostic or interventional surgery. At present, it has become one of the major causes of acute renal insufficiency in hospitalized patients. Choosing a relatively low toxic CM and reducing the exposure time and dose of CM can prevent CA-AKI occurrence to some extent. Drugs such as statins and postoperative hydration can reduce the risk of CA-AKI. In addition, nanomedicine has shown a benefit in animal models. This paper reviews the current prevention and treatment of CA-AKI to lay the foundation for further study of new interventions and provide a theoretical basis for clinical treatment.
Key words: contrast media; acute kidney injury; hydroxymethylglutaryl-CoA reductase inhibitors; nanoparticles; fluid therapy
对比剂相关性急性肾损伤(contrast-associated acute kidney injury,CA-AKI)是经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)术后的常见并发症,尤其是高风险人群的发病率居高不下,严重影响患者预后,增加远期死亡率[1]。目前,CA-AKI在治疗上仍有很大争议,风险预测和有效的预防策略已成为降低CA-AKI发病率的关键措施。多项研究发现,合理的对比剂选择、水化治疗以及相关药物应用可以减少CA-AKI的发生[2-4]。本文主要就对比剂的选择、药物干预以及水化治疗对CA-AKI的预防作用进行综述。
1 CA-AKI概述
对比剂肾病(contrast-induced nephropathy,CIN)是在排除其他可能的肾损害原因的情况下,对比剂暴露后48~72 h血肌酐绝对值较基础值升高≥44.2 μmol/L或相对升高≥25%[5]。但是在大多数情况下,“排除其他肾毒性因素”是不可行或不可靠的。例如一些病例在对比剂给药后发生急性肾损伤(acute kidney injury,AKI),虽与其无直接因果关系,但会被错误地归因于对比剂诱导,从而夸大了对比剂肾损伤的风险[5]。2012年,肾脏疾病改善全球结局(Kidney Disease Improving Global Outcomes,KDIGO)提出了“对比剂诱导的急性肾损伤(contrast-induced acute kidney injury,CI-AKI)”一词,并将其定义为对比剂暴露后7 d内血清肌酐值较基线值升高1.5倍以上,或在48 h内肌酐增加≥26.5 μmol/L,或使用对比剂后尿量降至0.5 mL/(kg·h),持续6 h[6]。近年来,AKI已被证明是应用血管内对比剂(contrast medium,CM)后由CM以外的因素(低血压、心输出量低、败血症、贫血等)引起的,因此CA-AKI这一术语获得了广泛认可。CA-AKI又称造影后急性肾损伤(postcontrast acute kidney injury,PC-AKI),是指使用对比剂后48 h内发生的任何AKI[5]。
2 CA-AKI的病理生理机制
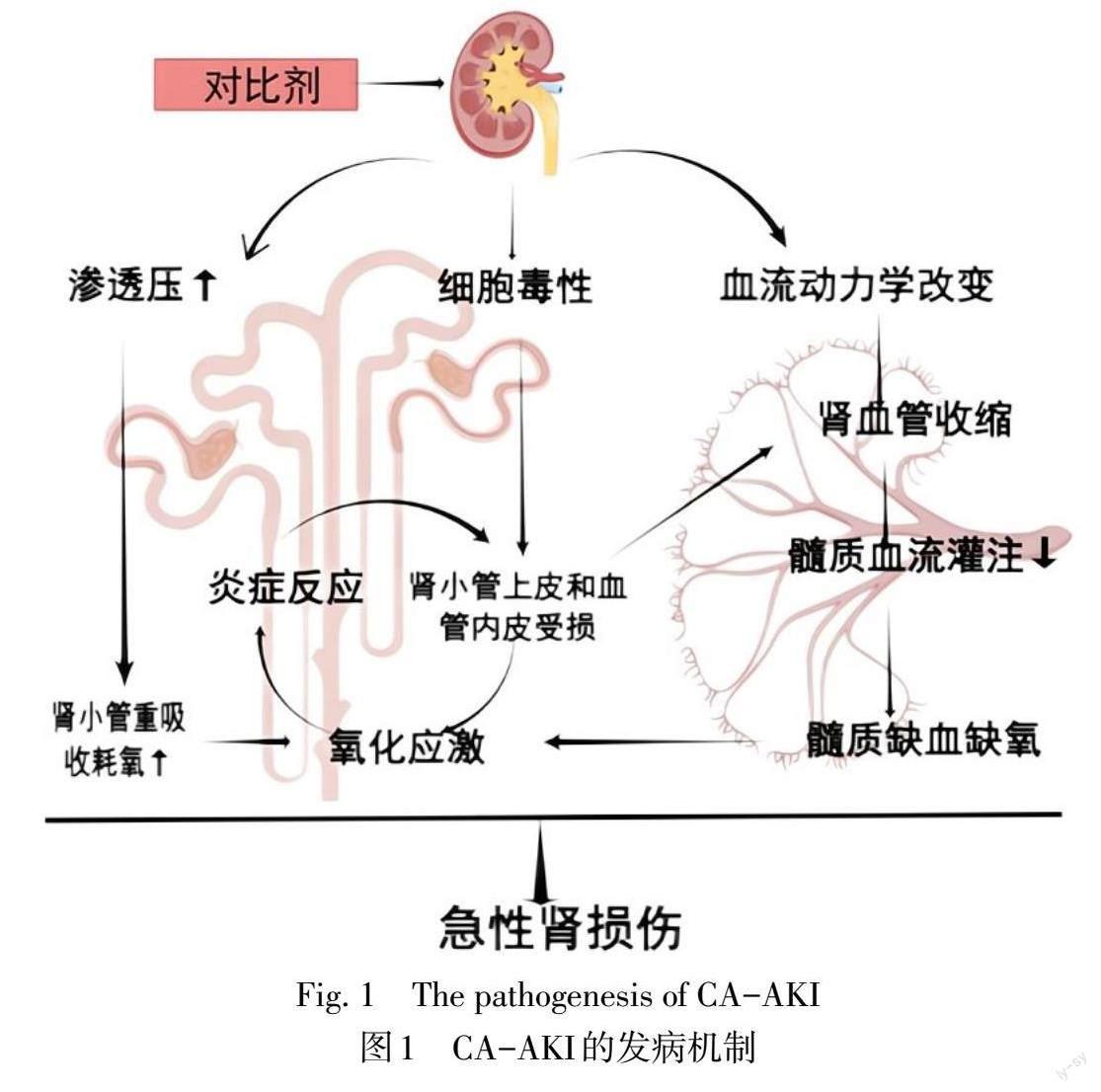
多種机制的协同作用共同诱导了CA-AKI的发生,目前认为其潜在的病理生理机制可能与肾髓质缺氧、对比剂的直接毒性、氧化应激、细胞凋亡、免疫及炎症等有关[4](图1)。对比剂会引起肾脏血流动力学的改变,在短暂血管扩张后出现的持续血管收缩会导致肾血管阻力增加和肾血流量减少;同时对比剂对血管内皮细胞的直接细胞毒性导致内皮素和腺苷升高,一氧化氮和前列腺素降低,引发髓质缺血缺氧,从而诱发CA-AKI[7]。髓质缺氧会抑制氧化磷酸化进程,促进线粒体中氧自由基的产生,进而损伤肾小管上皮细胞,细胞组织的坏死造成大量内源性致炎因子的释放,过度的无菌性炎症反应又反作用于肾小管上皮细胞,形成恶性循环,进一步加重髓质的缺血缺氧和氧化应激反应;对比剂积累所产生的高渗透环境在细胞凋亡中起着重要作用[6]。
3 CA-AKI的预防
3.1 对比剂选择对CA-AKI的预防 由于高渗透压对比剂的假性过敏反应和直接肾毒性的发生率更高,所以目前临床常用的新型非离子型对比剂包括低渗的碘海醇、碘普罗胺、碘帕醇和等渗的碘克沙醇。对于CA-AKI的高危患者,应考虑选择非肾毒性的碘化对比剂替代品。有研究表明,CO2-数字减影血管造影(CO2-digital subtraction angiography,CO2-DSA)可以显著减少碘对比剂的剂量而不影响成像效果[8]。但是CO2对膈肌以上的神经毒性极大地限制了其在心脑血管造影方面的应用[9]。此外,减少对比剂用量、缩短手术时间也有助于预防CA-AKI的发生。
3.2 药物预防
3.2.1 他汀类药物 他汀类药物具有缓解内皮功能障碍、稳定斑块、降脂等作用。目前越来越多的研究发现,他汀类药物的非降脂作用,即不依赖降脂的多效性作用(抗氧化应激、抗炎、改善血流动力学等)可以对CA-AKI发挥保护作用。2019年欧洲血脂异常管理指南[2]推荐,对于计划进行有创治疗的急性冠状动脉综合征患者,应考虑使用高强度他汀类药物进行预治疗,以减少PCI术后CA-AKI的发病率。近期一项PRATO-ACS-2研究[3]也表明,入院早期给予他汀类药物可显著降低CA-AKI的发生率,且接受瑞舒伐他汀和阿托伐他汀的患者术后AKI发生率、30 d肾功能改变率和12个月病死率或心肌梗死率基本相似。但也有研究表明,大剂量的他汀类药物会增加CA-AKI的发病率[10]。
3.2.2 别嘌呤醇 别嘌呤醇作为黄嘌呤氧化酶的竞争性抑制剂,临床上常被用于治疗高尿酸血症。一项荟萃分析证明,在经皮冠状动脉造影前接受充分补液联合别嘌呤醇(100~600 mg)预处理的患者相较于仅补液的患者CA-AKI发病率显著降低,使用300 mg别嘌呤醇补液与单独补液相比也能明显降低CA-AKI的发病率[11]。
3.2.3 纳米药物 纳米药物的出现有助于解决目前CA-AKI防治的局限性,具有肾脏组织特异性的细胞内递送方法可以充分利用包括小干扰RNA(siRNA)在内的治疗分子的潜力,同时最大限度地减少不良反应,降低CI-AKI的发生率。通过RNA干扰途径暂时抑制抑癌基因p53的表达已被认为是CA-AKI的潜在疗法[12]。但是siRNA的胞质摄取效率相对较低。Thai等[13]开发的一种四面体框架核酸l-脱氧核糖骨架(L-sTd)可以靶向运载p53 siRNA至肾脏进而防治CA-AKI。此外,具有ROS清除特性的无机纳米材料也为治疗CA-AKI提供了新思路。间苯二胺(m-Phenylenediamine,PDA)作为一种抗氧化剂可以保护肾脏免受氧化应激诱导所造成的损伤。Gao等[14]设计了一种含PDA的小碳纳米点(PDA-based carbon nanodots,PDA-CNDs),用于CA-AKI肾脏特异性靶向运载和抗氧化治疗。多种具有高活性氧(reactive oxygen species,ROS)清除率、高生物稳定性和低毒性的纳米药物,例如超小型黄金[15]、白金[16]、铱[17]等已被不断地探索开发,有望用于CA-AKI的防治,这些纳米颗粒具有多种抗氧化特性,靶向作用于肾组织以消除各种ROS,见表1[18]。通过纳米技术对CA-AKI进行早期诊断和有效治疗已经在动物模型上初见成效,为肾保护药物的靶向递送提供了新方法和新思路,以期实现安全、高效的治疗效果。但是,目前关于抗氧化纳米药物的研究都是基于啮齿类动物模型,如何消除啮齿类动物和人类CA-AKI疾病模型存在的差异,将纳米医学应用于临床,继而打开CA-AKI防治的新方向仍然是一个巨大的挑战。
3.2.4 其他药物 Ma等[19]关于PCSK9抑制剂依洛尤单抗的研究发现,PCI术后依洛尤单抗治疗组的CA-AKI发病率(6.7%)明显低于对照组(20.0%)。预防性给予曲美他嗪可以预防老年肾功能不全患者PCI术后CA-AKI的发生,对患者的肾功能有一定的保护作用[20]。随着对CA-AKI研究的逐渐深入,越来越多的药物已经被证明对肾功能有确切的保护作用,但是其具体的给药时间、用药剂量以及用药时长还需要进一步研究,以期在安全剂量下达到最大的治疗效果。
3.3 水化方案的优化 水化治疗通过增加尿量,降低肾小管中对比剂的浓度,加快对比剂的排泄等途径减少肾小管细胞暴露于对比剂毒性作用的时间,在预防CA-AKI方面的有效性已形成广泛共识。但最佳的水化方式、水化疗程、途径及剂量以及水化的个体化治疗仍然存在疑问。
3.3.1 水化治疗途径 水化治疗的途径包括口服水化、静脉水化及两者相结合的方式。目前临床常用的是静脉水化,实验证明静脉水化可以明显降低术后72 h内CA-AKI的发病率,但是与患者术后3个月内发生的肾功能不全或透析事件并无明确关联[21]。口服途径可以减少住院时间和花费且在出院后易执行,因而被临床广泛接受,被视为预防CA-AKI可取的门诊治疗选择[22]。美国国家卫生与临床优化研究所(NICE)最近更新的AKI指南[23]显示,对于高风险住院患者,静脉注射生理盐水或碳酸氢钠扩容可以明显降低CA-AKI的发病率,但是对于CI-AKI风险较低的门诊患者不需要静脉输液扩容。此外,NICE指南[23]强调口服补液的目的应该是实现血容量正常,根据患者的容量状态和体液平衡,以及一些预先存在的疾病进行补液,因此不推荐使用特定类型的口服补液。
3.3.2 水化劑量指导 标准化的水化治疗是否能够降低CA-AKI的发生率一直备受质疑,预防性补液可能会增加高危患者发生心力衰竭、心律失常和短期死亡的风险[24]。为了使水化治疗逐渐走向个体化,Brar等[25]提出将左心室舒张末压(left ventricular end diastolic pressure,LVEDP)作为一个评估指标;他们进行的POSEIDON随机对照试验结果显示,LVEDP引导治疗组和对照组出现CA-AKI的比例分别为8%和18%,而且6个月主要不良临床事件(全因死亡率、心肌梗死或肾脏替代治疗)的综合发生率在LVEDP引导治疗组中也较低。
除了LVEDP可以指导个体化的水化方案之外,RenalGuard系统[26]也可以通过在维持高尿量的同时平衡尿量和静脉补液量,以防止低血容量,进而达到个体化治疗的目的。研究证明,RenalGuard系统可以显著降低CA-AKI的发生率和需要肾透析的比例,且RenalGuard系统引导的水化优于LVEDP引导的水化[24]。
4 展望
目前对于CI-AKI和CA-AKI的诊断仍有争议,明确两者的定义并准确识别患者类型至关重要。早期识别高危人群,选择合适的对比剂和剂量,合理的药物和水化预防,加强高危人群随访,对于CA-AKI的防治具有重要意义。在今后的研究中,有望通过不断的优化水化疗法方案,寻找低肾毒性的碘对比剂替代品等方法降低CA-AKI的发生率,减少患者术后并发症,减轻医疗负担。
参考文献
[1] LUN Z,LIU J,LIU L,et al. Association of early and late contrast-associated acute kidney injury and long-term mortality in patients undergoing coronary angiography[J]. J Interv Cardiol,2021,2021:6641887. doi:10.1155/2021/6641887.
[2] MACH F,BAIGENT C,CATAPANO A L,et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk[J]. Eur Heart J,2020,41(1):111-188. doi:10.1093/eurheartj/ehz455.
[3] TOSO A,LEONCINI M,MAIOLI M,et al. A prospective,randomized,open-label trial of atorvastatin versus rosuvastatin in the prevention of contrast-induced acute kidney injury,worsened renal function at 30 days,and clinical events after acute coronary angiography: the PRATO-ACS-2 Study[J]. Cardiorenal Med,2020,10(5):288-301. doi:10.1159/000506857.
[4] ZHANG F,LU Z,WANG F. Advances in the pathogenesis and prevention of contrast-induced nephropathy[J]. Life Sci,2020,259:118379. doi:10.1016/j.lfs.2020.118379.
[5] DAVENPORT M S,PERAZELLA M A,YEE J,et al. Use of intravenous iodinated contrast media in patients with kidney disease:consensus statements from the american college of radiology and the national kidney foundation[J]. Radiology,2020,294(3):660-668. doi:10.1148/radiol.2019192094.
[6] KUSIRISIN P,CHATTIPAKORN S C,CHATTIPAKORN N. Contrast-induced nephropathy and oxidative stress: mechanistic insights for better interventional approaches[J]. J Transl Med,2020,18(1):400. doi:10.1186/s12967-020-02574-8.
[7] S?VA M,KALA P,POLOCZEK M,et al. Contrast-induced acute kidney injury and its contemporary prevention[J]. Front Cardiovasc Med,2022,9:1073072. doi:10.3389/fcvm.2022.1073072.
[8] GUPTA A,DOSEKUN A K,KUMAR V. Carbon dioxide-angiography for patients with peripheral arterial disease at risk of contrast-induced nephropathy[J]. World J Cardiol,2020,12(2):76-90. doi:10.4330/wjc.v12.i2.76.
[9] HEPBURN M,MULLAGURI N,BATTINENI A,et al. Fatal brain injury following carbon dioxide angiography[J]. J Stroke Cerebrovasc Dis,2020,29(12):105350. doi:10.1016/j.jstrokecerebrovasdis.2020.105350.
[10] WATANABE M,AONUMA K,MUROHARA T,et al. Prevention of contrast-induced nephropathy after cardiovascular catheterization and intervention with high-dose strong statin therapy in Japan - The PREVENT CINC-J Study[J]. Circ J,2022,86(9):1455-1463. doi:10.1253/circj.CJ-21-0869.
[11] MANSOOR K,SULIMAN M,AMRO M,et al. Protective effect of allopurinol in preventing contrast-induced nephropathy among patients undergoing percutaneous coronary intervention:a systematic review and meta-analysis[J]. Arch Med Sci Atheroscler Dis,2021,6:e196-e202. doi:10.5114/amsad.2021.112226.
[12] CORRIDON P R. Still finding ways to augment the existing management of acute and chronic kidney diseases with targeted gene and cell therapies:opportunities and hurdles[J]. Front Med (Lausanne),2023,10:1143028. doi:10.3389/fmed.2023.1143028.
[13] THAI H,KIM K R,HONG K T,et al. Kidney-targeted cytosolic delivery of siRNA using a small-sized mirror DNA tetrahedron for enhanced potency[J]. ACS Cent Sci,2020,6(12):2250-2258. doi:10.1021/acscentsci.0c00763.
[14] GAO J,LIU Y,JIANG B,et al. Phenylenediamine-based carbon nanodots alleviate acute kidney injury via preferential renal accumulation and antioxidant capacity[J]. ACS Appl Mater Interfaces,2020,12(28):31745-31756. doi:10.1021/acsami.0c05041.
[15] ZHANG D Y,TU T,YOUNIS M R,et al. Clinically translatable gold nanozymes with broad spectrum antioxidant and anti-inflammatory activity for alleviating acute kidney injury[J]. Theranostics,2021,11(20):9904-9917. doi:10.7150/thno.66518.
[16] ZHANG D Y,LIU H,RIZWAN Y M,et al. Ultrasmall platinum nanozymes as broad-spectrum antioxidants for theranostic application in acute kidney injury[J]. Chem Eng J,2021,421:129963. doi:10.1016/j.cej.2021.129963.
[17] ZHANG D Y,YOUNIS M R,LIU H,et al. Multi-enzyme mimetic ultrasmall iridium nanozymes as reactive oxygen/nitrogen species scavengers for acute kidney injury management[J]. Biomaterials,2021,271:120706. doi:10.1016/j.biomaterials.2021.120706.
[18] ZHAO Y,PU M,WANG Y,et al. Application of nanotechnology in acute kidney injury: From diagnosis to therapeutic implications[J]. J Control Release,2021,336:233-251. doi:10.1016/j.jconrel.2021.06.026.
[19] MA Y,ZHA L,ZHANG Q,et al. Effect of PCSK9 inhibitor on contrast-induced acute kidney injury in patients with acute myocardial infarction undergoing intervention therapy[J]. Cardiol Res Pract,2022,2022:1638209. doi:10.1155/2022/1638209.
[20] FU H,ZHANG J,ZHANG H,et al. Trimetazidine can prevent the occurrence of contrast-induced nephropathy after percutaneous coronary intervention in elderly patients with renal insufficiency[J]. Perfusion,2021,36(6):603-609. doi:10.1177/0267659120957856.
[21] BOTTINOR W,CHAWLA R,DANYI P,et al. Intravenous fluid therapy is associated with a reduced incidence of contrast-induced nephropathy but not with a reduced long-term incidence of renal dysfunction after cardiac catheterization[J]. Cardiovasc Revasc Med,2020,21(1):20-23. doi:10.1016/j.carrev.2019.07.020.
[22] PIOLI M R,COUTO R M,FRANCISCO J A,et al. Effectiveness of oral hydration in preventing contrast-induced nephropathy in individuals undergoing elective coronary interventions[J]. Arq Bras Cardiol,2023,120(2):e20220529. doi:10.36660/abc.20220529.
[23] BARRETT T,KHWAJA A,CARMONA C,et al. Acute kidney injury:prevention,detection,and management. Summary of updated NICE guidance for adults receiving iodine-based contrast media[J]. Clin Radiol,2021,76(3):193-199. doi:10.1016/j.crad.2020.08.039.
[24] BRIGUORI C,D'AMORE C,De MICCO F,et al. Left ventricular end-diastolic pressure versus urine flow rate-guided hydration in preventing contrast-associated acute kidney injury[J]. JACC Cardiovasc Interv,2020,13(17):2065-2074. doi:10.1016/j.jcin.2020.04.051.
[25] BRAR S S,AHARONIAN V,MANSUKHANI P,et al. Haemodynamic-guided fluid administration for the prevention of contrast-induced acute kidney injury: the POSEIDON randomised controlled trial[J]. Lancet,2014,383(9931):1814-1823. doi:10.1016/S0140-6736(14)60689-9.
[26] MAULER-WITTWER S,SIEVERT H,IOPPOLO A M,et al. Study evaluating the use of RenalGuard to protect patients at high risk of AKI[J]. JACC Cardiovasc Interv,2022,15(16):1639-1648. doi:10.1016/j.jcin.2022.05.036.
(2023-04-22收稿 2023-08-08修回)
(本文編辑 魏杰)
