非结核分枝杆菌肺病合并肉芽肿性血管炎1例
2024-04-01李洪利凌明珠陈晔
李洪利 凌明珠 陈晔

[摘要] 非结核分枝杆菌合并肉芽肿性血管炎(granulomatosis with polyangiitis,GPA)在临床上较为少见,分枝杆菌肺部感染(non-tuberculous mycobacterial–pulmonary disease,NTM-PD)是与血管炎有多种临床和实验室特征相似,且血管炎可继发于感染性疾病,甚至重叠出现。但两者治疗方向矛盾,使得两者合病的治疗出现困境。本文报道非结核分枝杆菌合并肉芽肿性血管炎病例一例,结合相关文献讨论非结核分枝杆菌肺病和血管炎的特征以及诊治的难点。
[关键词] 非结核分枝杆菌肺病;肉芽肿性血管炎;诊治
[中图分类号] R52 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.08.032
非结核分枝杆菌(nontuberculous mycobacteria,NTM)是指除结核分枝杆菌复合体和麻风分枝杆菌以外的分枝杆菌属,其广泛存在于水、土壤、空气等环境中,也称为环境分枝杆菌。部分分枝杆菌会引起任何身体部位的感染,而肺部疾病最常见表现[1-2]。肉芽肿性血管炎是抗中性粒细胞胞质自身抗体(antineutrophil cytoplasmic autoantibody, ANCA)相关血管炎(ANCA-associated vasculitides, AAV)中一种类型,主要累及小动脉,出现肉芽肿性炎症,其器官表现和疾病严重程度不一,最常见且受累最严重的器官包括上/下呼吸道和肾脏[3]。两者合病少见,血管炎可为原发病或继发于感染性疾病,诊断较为困难,且治疗方向矛盾,本文报道1例分枝杆菌肺部感染(non-tuberculous mycobacterial–pulmonary disease,NTM-PD)合并肉芽肿性血管炎(granulomatosis with polyangiitis,GPA)病例,探讨其诊治难点,以期提高对两者的认识,减少漏诊和误诊。
1 临床资料
患者,女,69岁,因“反复咳嗽咳痰10月余”入院。患者10月余前无明显诱因下出现咳嗽咳痰,咳白痰为主,无明显胸闷气急、胸痛咯血及体质量下降等,未予重视,未就诊治疗。既往慢性鼻炎病史45年余,否认慢性疾病史,否认工业粉尘及化学性物质、土壤接触史,营养状况可,无吸烟史。查体:体温36.3℃,脉搏82次/分,呼吸16次/分,血压120/70mmHg(1mmHg=0.133kPa),血氧饱和度96%;两肺呼吸音粗,右肺中叶可及湿啰音,其他体格检查未见异常。
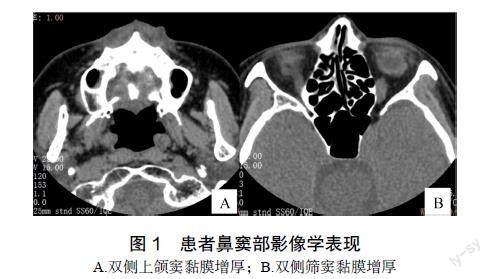
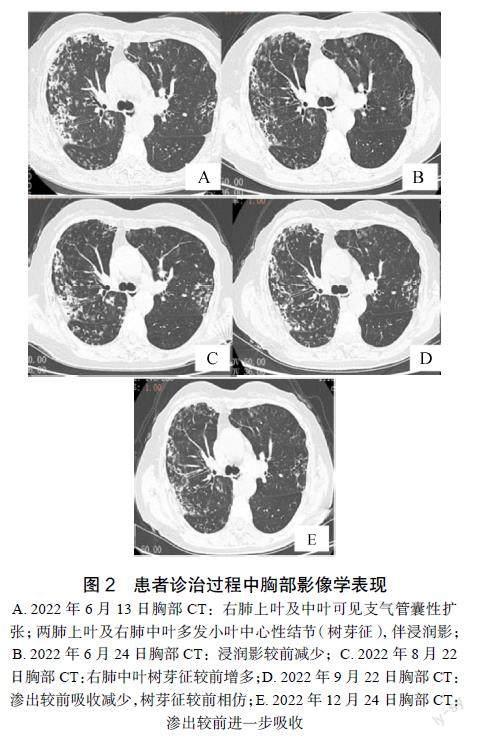
入院后实验室检查见表1。影像学检查:鼻窦部CT提示双侧上颌窦及筛窦炎(图1);胸部CT检查结果提示支气管扩张,多发斑片状高密度影,局部小囊状改变(图2)。
A. 2022年6月13日胸部CT:右肺上叶及中叶可见支气管囊性扩张;两肺上叶及右肺中叶多发小叶中心性结节(树芽征),伴浸润影;B. 2022年6月24日胸部CT:浸润影较前减少;C. 2022年8月22日胸部CT:右肺中叶树芽征较前增多;D. 2022年9月22日胸部CT:渗出较前吸收减少,树芽征较前相仿;E. 2022年12月24日胸部CT:渗出较前进一步吸收
患者入院1周内,除BACTEC MGIT 960分枝杆菌培养结果未回,其余检验检查结果均已回。因患者拒绝活检穿刺,根据现有依据暂且排除肿瘤、肾炎肾病等,类风湿性关节炎诊断依据不足,诊断更偏于血管炎。再根据我国沿用的1990年美国风湿病学会 (American College of Rheumatology,ACR) 对韦格纳肉芽肿病(Wegeners granulomatosis, WG)的诊断标准拟诊为肉芽肿性血管炎[4]。因此该患者开始针对GPA的激素联合免疫抑制治疗,治疗方案为甲泼尼龙针40mg静注,1次/天抗炎8d后序贯潑尼松片35mg口服(逐渐减量)1次/天+他克莫司1mg口服,2次/天 +环磷酰胺针0.4g静滴每4周1次免疫抑制。治疗10d后咳嗽咳痰等症状较前缓解,复查胸部CT检查结果提示两肺炎症较前吸收、好
转(图2B),血红细胞沉降率也逐渐下降至36mm/h,尿常规未见红细胞,再次佐证患者血管炎的诊断。
患者接受激素治疗3周后,BALF结核菌培养结果:非结核分支杆菌,经PCR反向斑点杂交法鉴定为胞内分枝杆菌,药敏实验提示对利福平、克拉霉素、乙胺丁醇敏感。根据《非结核分枝杆菌病诊断与治疗指南(2020年版)》[2]诊断标准确诊为NTM-PD(胞内分枝杆菌感染),考虑NTM-PD合并GPA,而结合患者治疗后各项指标好转,暂时不改变治疗方向,继续观察随访。激素联合免疫抑制治疗2个月后,患者呼吸道症状出现反复,影像学较前进展表明目前治疗效果欠佳,需重新评估病情,改变治疗策略。免疫抑制剂可能使NTM-PD加重,抗NTM治疗而停用或降低免疫抑制可能也会面临血管炎控制不佳的局面。因此笔者团队讨论后更改了治疗策略,根据药敏结果选用口服克拉霉素0.5g,2次/天+利福平胶囊0.45g,1次/d+乙胺丁醇0.75g,1次/天联合治疗NTM-PD,同时维持泼尼松10mg口服1d/次。联合治疗1个月后,血红细胞沉降率下降至23mm/h,胸部CT提示炎性渗出较前略吸收。治疗4个月后再次复查胸部CT检查结果提示炎症较前吸收,疾病趋于稳定。目前患者仍在接受抗NTM及免疫抑制治疗,门诊观察随访,最近的随访情况见表1。
2 讨论
在中国,最常见的人类致病性NTM是缓慢生长型鸟分枝杆菌复合群、堪萨斯分枝杆菌和快速生长型脓肿分枝杆菌复合群[2]。鸟分枝杆菌复合群广泛分布在整个环境中,还能长期存在于45~55℃的热水环境中形成气溶胶,是人类感染的宿主。而随着热水器的广泛使用以及淋浴器气溶胶接触,使得大气湿度增加,造成环境暴露的增加,NTM-PD发病率升高[5]。NTM-PD的症状和体征多变、无特异性,典型的主诉症状是持续咳嗽伴不同程度的咳痰,有时出现体质量减轻,但通常無发热[6-7]。病理学和影像学更具提示性,病理改变以干酪样坏死和纤维化常见;影像学表现为小叶中心结节影与支气管扩张影混合存在[8]。而肉芽肿性血管炎,是一种罕见的多系统疾病,主要累及小血管,以肉芽肿性炎症、寡免疫坏死性肾小球肾炎和血管炎为病理特征。约80%以上的患者在整个病程中出现肺部表现[9]。胸部影像学特点为三多一洞:多形态、多变化、多部位、有空洞。常见的胸部CT表现为多发性肺部结节多伴有空洞,以及斑片状或弥漫性的毛玻璃影或实变影[10]。因此GPA与NTM肺病影像学都可表现为多发结节或单发结节,伴空洞形成,或局限性、浸润性影等。发热、体质量减轻、咳嗽咳痰、咯血等肺部临床症状也相似,在临床上难以鉴别。
通过对整个病程的追溯发现,患者职业需经常接触热水,NTM-PD职业暴露增加。而患者初发症状是呼吸道相关症状,其支气管扩张、树芽征大多分布在肺部的中叶,影像学更符合NTM-PD。病原学检查选用了NGS的同时并未放弃传统的病原体培养,使得NTM-PD诊断较为顺利。基于典型的影像学表现,肺泡灌洗液中性粒细胞为主,BACTEC MGIT 960培养结果阳性,抗NTM治疗后炎症吸收,NTM-PD诊断明确。那么血管炎诊断是否成立?该患者cANCA/PR3-ANCA阳性,而cANCA、PR3是GPA标志性抗体,对GPA的特异性达到95%~ 98%[11]。结合患者的呼吸道及肾脏多系统累及且接受激素联合免疫抑制治疗后影像学等改善,因此治疗组认为该患者同时存在NTM-PD、GPA,但是由于该患者拒绝行肺或肾脏活检,血管炎缺少病理确诊。
血管炎是原发还是继发?相关研究表明,血管炎常继发于感染或药物等因素,结核病是血管炎的重要继发性病因[12]。此外中性粒细胞通过与分枝杆菌细胞壁的苯酚糖脂相互作用而被激活,可能导致中性粒细胞在分枝杆菌感染的初始阶段产生针对这些细胞颗粒成分的自身抗体,因此会出现假阳性可能,影响对疾病诊治。在一项对结核病患者血清中ANCA阳性率的调查中发现,约40%的患者ANCA阳性。因此在我国结核病高负担国家,当cANCA/PR3- ANCA阳性时,特别是没有此类疾病的肺外表现时,不要直接将ANCA阳性结果解释为原发性系统性血管炎,特别是GPA[13-16]。
GPA合并NTM-PD时该如何治疗?国外相关文献报道,1例痰培养脓肿分枝杆菌阳性的患者在未接受治疗3个月后出现血管炎相关表现,被诊断为继发于脓肿分枝杆菌的显微镜下血管炎,开启了甲泼尼龙联合环磷酰胺治疗及雾化吸入阿米卡星和口服莫西沙星、米诺环素、克拉霉素抗NTM治疗,治疗5年后病情控制稳定[17]。另1例患者被诊断为继发于龟分枝杆菌的小血管炎,使用妥布霉素、利奈唑胺和克拉霉素的联合治疗龟分枝杆菌感染的同时也使用强的松、利妥昔单抗治疗继发的小血管炎[18]。可见GPA合并NTM-PD的治疗存在矛盾性,大多会选择免疫抑制和抗感染同时兼顾,但目前并无相关指南或专家共识,对于临床医生仍是一种挑战。
综上所述, NTM感染可引起各种非特异性的临床表现和组织病理学表现,给及时诊断带来极大的挑战,且NTM-PD与血管炎的表现形式类似,血管炎还可继发于NTM-PD。因此尽管cANCA/PR3-ANCA阳性高度提示肉芽肿性血管炎,仍需要考虑其假阳性的可能,尽量依靠病理结果确诊。在NTM-PD和GPA共病时应评估血管炎的严重程度,根据病情进行相应免疫抑制和抗感染治疗。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] BELIZNA C C, HAMIDOU M A, LEVESQUE H, et al. Infection and vasculitis[J]. Rheumatology (Oxford), 2009, 48(5): 475–482.
[2] 中华医学会结核病学分会. 非结核分枝杆菌病诊断与治疗指南(2020年版)[J]. 中华结核和呼吸杂志, 2020, 43(11): 918–946.
[3] FALK R J, GROSS W L, GUILLEVIN L, et al. Granulomatosis with polyangiitis (Wegeners): an alternative name for Wegener's granulomatosis[J]. Ann Rheum Dis, 2011, 70(4): 704.
[4] 田新平, 赵丽珂, 姜振宇, 等. 抗中性粒细胞胞质抗体相关血管炎诊疗规范[J]. 中华内科杂志, 2022, 61(10): 1128–1135.
[5] FALKINHAM J R. Ecology of nontuberculous mycobacteria- where do human infections come from?[J]. Semin Respir Crit Care Med, 2013, 34(1): 95–102.
[6] 歐阳国泉, 陈盛松, 肖祖克. 非结核分枝杆菌肺病和肺结核患者的临床特征分析[J]. 中国呼吸与危重监护杂志, 2021, 20(11): 774–779.
[7] KOH W J. Nontuberculous mycobacteria-overview[J]. Microbiol Spectr, 2017, 5(1): e1–e7.
[8] DETTMER S, RINGSHAUSEN F C, FUGE J, et al. Computed tomography in adults with bronchiectasis and nontuberculous mycobacterial pulmonary disease: Typical imaging findings[J]. J Clin Med, 2021, 10(12): 2736.
[9] GUZMAN-SOTO M I, KIMURA Y, ROMERO- SANCHEZ G, et al. From head to toe: Granulomatosis with polyangiitis[J]. Radiographics, 2021, 41(7): 1973–1991.
[10] PALMUCCI S, INI C, COSENTINO S, et al. Pulmonary vasculitides: A radiological review emphasizing parenchymal HRCT features[J]. Diagnostics (Basel), 2021, 11(12): 2318.
[11] KITCHING A R, ANDERS H J, BASU N, et al. ANCA-associated vasculitis[J]. Nat Rev Dis Primers, 2020, 6(1): 71.
