老年抑郁与轻度认知障碍相关性的Meta分析
2024-04-01王敏刘元月盛蕾
王敏 刘元月 盛蕾

[摘要] 目的 系統评价老年抑郁与轻度认知障碍的相关性。方法 计算机检索CNKI、VIP、WanFang Data,Cochrane Library,EMbase,Pubmed和Web of Science数据库,搜集有关老年抑郁与轻度认知障碍相关性的队列研究,检索时限均从建库至2023年7月6日。由2名研究者独立完成筛选文献、数据提取及质量评价后,采用Review Manager5.4软件进行Meta分析。结果 最终共纳入10篇文献,总样本量为26 813人。Meta分析结果显示:老年抑郁与轻度认知障碍具有相关性(OR=1.47,95% CI:1.25~1.72,P<0.001)。结论 老年抑郁是轻度认知障碍的发病危险因素之一。上述结论受研究类型、质量及数量的限制,仍待更多高质量研究进行验证。
[关键词] 老年人;抑郁;轻度认知障碍;Meta分析
[中图分类号] R749.1 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.08.001
Meta-analysis of the association between late-life depression and mild cognitive impairment
WANG Min1, LIU Yuanyue2, SHENG Lei2
1.Department of Neurology, the Second Hospital Affiliated to Nanjing University of Traditional Chinese Medicine, Nanjing 210017, Jiangsu, China; 2.Department of Neurology, Jiangsu Second Chinese Medicine Hospital, Nanjing 210017, Jiangsu, China
[Abstract] Objective To systematically evaluate the correlation between elderly depression and mild cognitive impairment. Methods We searched the CNKI, VIP, WanFang Data, Cochrane Library, EMbase, Pubmed, and Web of Science databases using computer, and collected cohort studies on the correlation between elderly depression and mild cognitive impairment. The search time limit was from the establishment of the database to July 6, 2023. Two researchers independently completed the literature screening, data extraction, and quality evaluation, and conducted a Meta-analysis using Review Manager 5.4 software. Results A total of 10 articles were included, with a total sample size of 26 813 people. The Meta-analysis showed that there was a correlation between elderly depression and mild cognitive impairment (OR=1.47, 95% CI: 1.25–1.72, P<0.001). Conclusion Current evidence indicates that elderly depression is one of the risk factors for the development of mild cognitive impairment. This conclusion is limited by the type, quality, and quantity of research, and needs to be validated by more high-quality research.
[Key words] Elderly; Depression; Mild cognitive impairment; Meta-analysis
轻度认知障碍(mild cognitive impairment,MCI)是介于正常衰老与早期阿尔茨海默病(Alzheimers disease,AD)的一种临床状态,几乎不影响患者正常的社会功能,但是MCI通常被认为是AD的前驱期,是AD发病的预警信号[1-2]。在老年人群中,MCI患病率随着年龄增长而不断增高,且MCI患者进展为AD的风险是非MCI老年人的3倍多[3]。AD极大地影响老年人的生活质量,目前尚无根治的方法,而MCI初发期是防治AD的最佳时期[4-5]。因此在发展为AD前早期识别MCI发病的危险因素并采取干预措施,对于减少MCI发病并避免其向AD转化具有重要的意义。
抑郁是老年人常见的心理障碍,近年来研究表明,老年抑郁是导致MCI的危险因素之一,但也有研究认为,老年抑郁与MCI的发病无关[6-8]。目前对于老年抑郁与MCI发病是否相关尚无统一定论。因此,本研究通过Meta分析的方法系统分析老年抑郁与MCI的相关性,为减少MCI发病提供循证依据和参考。
1 资料与方法
1.1 信息来源与检索策略
在中国知网(CNKI),维普网(VIP),万方数据知识服务平台(WanFang Data),Cochrane Library,EMbase,Pubmed,Web of Science等中英文数据库进行检索,检索时间为自建库至2023年7月6日。
中文检索词为:(主题=抑郁) AND (主题=认知损伤+认知障碍) AND (全文=队列),英文检索词为:(depression[Title/Abstract]) OR (depressive[Title/Abstr act]) AND (Mild Cognitive Dysfunction[Title/Abstract]) OR (Mild Cognitive Impairment[Title/Abstract]) OR (Mild Cognitive Disorder[Title/Abstract]) OR (Mild Cognitive Decline[Title/Abstract]) AND (cohort)。納入标准:①研究类型:队列研究。②研究对象:年龄在55岁以上。③暴露因素:经量表评估或临床诊断的抑郁。④结局指标:具体描述MCI的诊断标准。⑤文献中给出校正的OR值及95% CI,或可根据给出数据计算出OR值及95% CI。排除标准:①重复文献;②无法获取全文的文献;③数据明显缺失或错误且无法联系作者的文献;④文献质量过差。
1.2 资料提取与资料条目
初步去除重复文献后,由两名经过培训的研究人员分别独立阅读标题及摘要,严格按照纳入标准及排除标准进行初步筛选,符合标准的文献进一步阅读全文完成二次筛选。如出现意见不一时,由第3名研究人员加入讨论决定。两名经过培训的研究人员分别独立对最终纳入的文献进行数据提取,如出现意见不一时,由第3名研究人员加入讨论决定。具体提取数据包括:第一作者姓名,发表时间,地区,样本量,样本年龄,随访时间,抑郁评估方法,认知评估方法,老年抑郁与MCI的OR值及95% CI等。
1.3 偏倚风险评价
采用NOS量表对纳入文献进行评价。该量表从研究对象选择性、可比性及结局3个维度进行评价,满分为9分,其中7~9分为高质量研究,4~6分为中等质量研究,<4分为低质量研究。
1.4 效应指标
采用合并后的OR值及其95% CI评价老年抑郁是否是MCI的危险因素。采用Review Manager5.4软件对纳入文献统计分析。通过Q检验及I2检验对
研究间的异质性进行评价,若I2<50%,P>0.1则认为各个研究间异质性不高,采用固定效应模型分析;若I2≥50%,P≤0.1则认为各研究之间具有较大的异质性,采用随机效应模型分析,并进行亚组分析与敏感性分析,寻找差异原因。
1.5 报告偏倚评价与可信度评价
使用漏斗图及Eggers检验进行报告偏倚分析。 采用Z检验评价效应指标的可信度。若P≥0.05则认为可信度不高,若P<0.05则认为效应指标具有可信度。
2 结果
2.1 文献检索结果
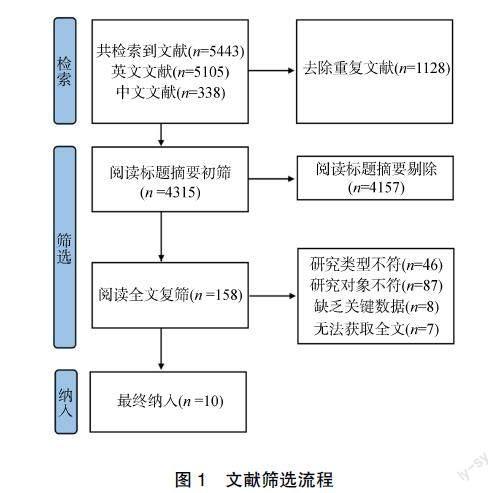
初步检索出5443篇文献,剔除重复文献后剩余4315篇。阅读标题和摘要后剔除4157篇,阅读全文后剔除148篇,最终纳入10篇研究[6-15]。具体筛选流程见图1。
2.2 纳入文献的基本特征与质量评价
本研究纳入的10篇队列研究中,包含中国、美国、欧洲、澳大利亚等多个国家及地区,总样本量为26 813名,文献的基本特征详见表1。对纳入的10篇文献进行质量评价,高质量研究共有7篇,中等质量研究共有3篇。
2.3 老年抑郁与轻度认知障碍的Meta分析
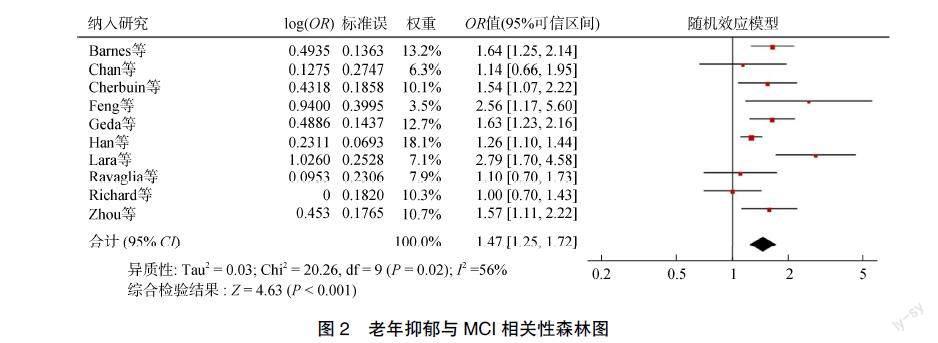
对纳入研究进行异质性检验,发现各研究间存在异质性(I2=56%,P<0.1),采用随机效应模型合并效应值,与非抑郁老年人相比,抑郁老年人患MCI的风险增高(OR=1.47,95% CI:1.25~1.72),差异有统计学意义(Z=4.63,P<0.001),见图2。根据不同地区、样本量大小、抑郁评估方法、认知评估方法进行亚组分析,结果显示研究地区为亚洲、认知评估方法为MMSE的研究异质性较低;研究地区为欧洲、样本量≥1000、抑郁评估方法为CES-D、认知评估方法为临床诊断的研究异质性较高,见表2。
2.4 敏感性分析与报告偏倚
采用逐个剔除法进行敏感性分析,结果显示OR值未发生显著改变,表明单个研究未对合并结果产生明显影响。使用漏斗图及Eggers检验进行报告偏倚分析,结果显示漏斗图左右分布较为对称,存在报告偏倚的可能性较小(t=1.28,P=0.238),见图3。
3 讨论
本研究Meta分析结果显示,在老年人群中,与非抑郁者相比,抑郁使MCI的发病风险上升了47%。因此,在老年人中,抑郁是MCI发病的危险因素之一。国内外大量研究表明,在老年人群中,抑郁和不同类型的认知障碍之间存在相关性,且抑郁会增加MCI进展为AD的风险。Diniz等[16]对23项研究进行Meta分析,发现老年抑郁增加了全因AD(OR=1.85,95% CI:1.67~2.04)、阿尔茨海默病(OR=1.65,95% CI:1.42~1.92)和血管性AD(OR=2.52,95% CI:1.77~3.59)的发病风险。Mourao等[17]的研究纳入10861名老年MCI患者,结果发现与非抑郁MCI患者相比,患有抑郁的MCI患者进展为AD的风险更高(RR=1.28,95% CI:1.09~1.52)。
Mehta等[18]纳入70篇文献分析,发现既往抑郁暴露与认知评分降低(OR=1.33,95% CI:1.17~1.51)、MCI(OR=1.52,95% CI:1.28~1.79)和AD(OR=1.79,95% CI:1.46~2.2)发病相关,这与本研究的结论相一致,但该研究部分文献仅纳入单一性别作为研究对象,可能对研究结论造成影响。此外,也有研究提出与本研究相反的结论,如Desai等[19]针对老年人的研究表明,较高的抑郁状态并不会导致MCI(RR=0.98,95% CI:0.75~1.26)和AD(RR=0.69,95% CI:0.27~1.79)发病的增加,可能与纳入研究数量过少有关。
本研究亚组分析结果显示,地区来源为欧洲的亚组异质性较高,可能与部分研究的研究对象代表性不高、随访不完整有关,如Ravaglia等[12]仅纳入了来源于城市的老年人,而Lara等[10]随访完成率不高。此外,抑郁评估方法为CES-D的亚组中,老年抑郁与MCI的相关性并不显著,可能与纳入研究数量少、性别占比差异大有关,Sundermann等[20]的研究也证实了抑郁症状与MCI的发病风险存在性别差异,但该研究仅针对遗忘型MCI进行分析,此结论是否可进行推广仍有待进一步证实。
神经影像学研究表明,抑郁患者存在一系列大脑结构和功能的改变。目前针对抑郁患者的DTI研究发现,与健康人相比,抑郁患者前额叶、扣带回和颞叶白质等区域的FA值降低,提示可能存在白质微结构的改变,如髓鞘完整性破坏、神经胶质细胞的异常激活等[21-22]。内侧颞叶、前额叶等脑区及其相关结构与记忆、执行等多个认知功能有关,针对MCI患者的影像研究也表现出上述区域的异常改变,如Berron等[23]基于rs-fMRI技术发现MCI患者内侧颞叶和前颞叶及后内侧系统之间的功能连接减弱,且这种改变与海马旁扣带和穹窿的内嗅厚度和白质完整性降低有关,表明抑郁与MCI存在共同的解剖基础。Li等[24]通过PET扫描也发现老年抑郁和遗忘型MCI共病患者存在广泛的白质微结构破坏,尤其是在内侧颞叶束中。
神经炎性反应可能是介导老年抑郁认知障碍的重要病理基础。研究表明,抑郁患者血清炎性反应因子水平较正常人显著上升[25-27]。Kim等[28]的PET研究发现老年抑郁患者与正常对照组相比多个脑区存在Aβ沉积,Wu等[29]也证实了与认知正常的重度抑郁患者相比,合并MCI的重度抑郁患者具有更高的Aβ负担,而Aβ沉积是认知障碍的重要病理因素。外周炎性反應和Aβ沉积可通过刺激中枢神经系统的固有免疫细胞——小胶质细胞,促使其向M1型极化,进而分泌大量促炎性反应因子,诱导神经炎性反应的产生[30-31]。小胶质细胞的早期激活可促进大脑中Aβ的清除,但长期过度活化的小胶质细胞反而使Aβ沉积增加,且会加重神经炎性反应,影响突触修复,损害神经元的正常结构与功能,最终引起认知功能减退[32]。
本研究的优势:①仅纳入纵向的队列研究,利于进行因果关系分析;②对多个数据库进行检索,文献来源广泛;③纳入了最新的研究。本研究的局限性:①本研究纳入研究均为观察性研究,可能存在多种偏倚;②研究地区多为较发达地区,缺少欠发达地区的文献资料;③不同文献之间暴露和结局的评估方法差异过大;④亚组分析时部分亚组包含文献过少。
综上所述,当前证据表明,抑郁会增加老年人患MCI的风险。因此,未来可针对老年抑郁采取干预措施,由此可能降低MCI的发病率。此结论受到纳入研究的类型、质量及数量的限制,仍待开展更多高质量研究进行验证。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
[1] VEGA J N, NEWHOUSE P A. Mild cognitive impairment: diagnosis, longitudinal course, and emerging treatments[J]. Curr Psychiatry Rep, 2014, 16(10): 490.
[2] LYKETSOS C G, LOPEZ O, JONES B, et al. Prevalence of neuropsychiatric symptoms in dementia and mild cognitive impairment: results from the cardiovascular health study[J]. JAMA, 2002, 288(12): 1475–1483.
[3] PETERSEN R C, LOPEZ O, ARMSTRONG M J, et al. Practice guideline update summary: mild cognitive impairment: report of the guideline development, dissemination, and implementation subcommittee of the american academy of neurology[J]. Neurology, 2018, 90(3): 126–135.
[4] PRINCE M, BRYCE R, ALBANESE E, et al. The global prevalence of dementia: A systematic review and Meta analysis[J]. Alzheimers Dement, 2013, 9(1): 63–75.
[5] PETERSEN R C. How early can we diagnose alzheimer disease (and is it sufficient)? The 2017 wartenberg lecture[J]. Neurology, 2018, 91(9): 395–402.
[6] BARNES D E, ALEXOPOULOS G S, LOPEZ O L, et al. Depressive symptoms, vascular disease, and mild cognitive impairment: Findings from the cardiovascular health study[J]. Arch Gen Psychiatry, 2006, 63(3): 273–279.
[7] CHAN C K, SOLDAN A, PETTIGREW C, et al. Depressive symptoms in relation to clinical symptom onset of mild cognitive impairment[J]. Int Psychogeriatr, 2019, 31(4): 561–569.
[8] CHERBUIN N, REGLADE-MESLIN C, KUMAR R, et al. Risk factors of transition from normal cognition to mild cognitive disorder: The path through life study[J]. Dement Geriatr Cogn Disord, 2009, 28(1): 47–55.
[9] FENG L, LIM W S, CHONG M S, et al. Depressive symptoms increase the risk of mild neurocognitive disorders among elderly chinese[J]. J Nutr Health Aging, 2017, 21(2): 161–164.
[10] GEDA Y E, ROBERTS R O, MIELKE M M, et al. Baseline neuropsychiatric symptoms and the risk of incident mild cognitive impairment: A population-based study[J]. Am J Psychiatry, 2014, 171(5): 572–581.
[11] HAN F F, WANG H X, WU J J, et al. Depressive symptoms and cognitive impairment: a 10-year follow- up study from the survey of health, ageing and retirement in europe[J]. Eur Psychiatry, 2021, 64(1): e55.
[12] LARA E, KOYANAGI A, DOMENECH-ABELLA J, et al. The impact of depression on the development of mild cognitive impairment over 3 years of follow-up: a population-based study[J]. Dement Geriatr Cogn Disord, 2017, 43(3): 155–169.
[13] RAVAGLIA G, FORTI P, LUCICESARE A, et al. Prevalent depressive symptoms as a risk factor for conversion to mild cognitive impairment in an elderly italian cohort[J]. Am J Geriatr Psychiatry, 2008, 16(10): 834–843.
[14] RICHARD E, REITZ C, HONIG L H, et al. Late-life depression, mild cognitive impairment, and dementia[J]. JAMA Neurol, 2013, 70(3): 374–382.
[15] ZHOU S, WANG Q, ZHANG J, et al. Depressive symptoms and cognitive decline among chinese rural elderly individuals: a longitudinal study with 2-year follow-up[J]. Front Public Health, 2022, 10: 939150.
[16] DINIZ B S, BUTTERS M A, ALBERT S M, et al. Late-life depression and risk of vascular dementia and alzheimers disease: Systematic review and Meta-analysis of community-based cohort studies[J]. Br J Psychiatry, 2013, 202(5): 329–335.
[17] MOURAO R J, MANSUR G, MALLOY-DINIZ L F, et al. Depressive symptoms increase the risk of progression to dementia in subjects with mild cognitive impairment: Systematic review and Meta-analysis[J]. Int J Geriatr Psychiatry, 2016, 31(8): 905–911.
[18] MEHTA K, THANDAVAN S P, MOHEBBI M, et al. Depression and bone loss as risk factors for cognitive decline: A systematic review and Meta-analysis[J]. Ageing Res Rev, 2022, 76: 101575.
[19] DESAI R, WHITFIELD T, SAID G, et al. Affective symptoms and risk of progression to mild cognitive impairment or dementia in subjective cognitive decline: A systematic review and Meta-analysis[J]. Ageing Res Rev, 2021, 71: 101419.
[20] SUNDERMANN E E, KATZ M J, LIPTON R B. Sex differences in the relationship between depressive symptoms and risk of amnestic mild cognitive impairment[J]. Am J Geriatr Psychiatry, 2017, 25(1): 13–22.
[21] MURPHY C F, GUNNING-DIXON F M, HOPTMAN M J, et al. White-matter integrity predicts stroop performance in patients with geriatric depression[J]. Biol Psychiatry, 2007, 61(8): 1007–1010.
[22] HE X, PUERARO E, KIM Y, et al. Association of white matter integrity with executive function and antidepressant treatment outcome in patients with late-life depression[J]. Am J Geriatr Psychiatry, 2021, 29(12): 1188–1198.
[23] BERRON D, VAN WESTEN D, OSSENKOPPELE R, et al. Medial temporal lobe connectivity and its associations with cognition in early Alzheimers disease[J]. Brain, 2020, 143(4): 1233–1248.
[24] LI W, MUFTULER L T, CHEN G, et al. Effects of the coexistence of late-life depression and mild cognitive impairment on white matter microstructure[J]. J Neurol Sci, 2014, 338(1-2): 46–56.
[25] 范長河, 谢光荣, 陈凤华, 等. 抑郁症患者血清炎性反应细胞因子和急性期反应蛋白水平及其意义[J]. 中国神经精神疾病杂志, 2000(5): 272–275.
[26] 胡楠楠, 孙继军. 老年抑郁症患者神经递质、炎性反应因子水平与认知功能的关系[J]. 中国老年学杂志, 2020, 40(12): 2604–2606.
