基于Web of Science对糖尿病认知障碍研究前沿热点的分析
2024-04-01冯宇萍张蓉张菊霞
冯宇萍 张蓉 张菊霞

[摘要] 目的 系統探索糖尿病相关认知功能障碍的研究热点和趋势,为后续研究提供参考及新思路。方法 检索建库至2022年10月Web of Science核心合集数据库中关于糖尿病认知障碍的文献,利用Citespace6.1.R3对其进行分析。 结果 共纳入6448篇文献,整体年发文量呈上升趋势;发文最多的国家为美国,排名前10的作者主要来自美国和中国。研究热点主要聚焦于糖尿病认知障碍的发病机制和危险因素。结论 了解糖尿病患者认知能力受损的危险因素,早期干预有助于降低糖尿病认知障碍的发病率,从而更有效地预防、延和减缓认知障碍的发生。
[关键词] 糖尿病;认知功能障碍;文献计量学;CiteSpace
[中图分类号] R587.1 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2024.08.009
Research frontier and hotspot analysis of diabetes cognitive impairment based on Web of Science
FENG Yuping1, ZHANG Rong1, ZHANG Juxia2
1.School of Nursing, Gansu University of Chinese Medicine, Lanzhou 730000, Gansu, China; 2.Department of Clinical Teaching, Gansu Provincial Hospital, Lanzhou 730000, Gansu, China
[Abstract] Objective The visualization analysis system was used to explore the development context, research hotspots, and trends of diabetes-related cognitive dysfunction, providing a reference for subsequent studies and new ideas. Methods The literature on cognitive impairment in diabetes mellitus was retrieved from the Web of Science Core collection database from October 2022, and visualized by Citespace 6.1.R3. Results A total of 6448 English literature were included, and the annual number of publications showed an overall increasing trend. America posted the most, and the top 10 are dominated by authors from these America and China. Research focuses on the pathogenesis and risk factors of cognitive impairment in diabetes mellitus. Conclusion Understanding the risk factors of cognitive impairment in diabetic patients, early intervention is helpful to reduce the incidence of diabetic cognitive impairment, so as to prevent, delay and slow down the occurrence of cognitive impairment more effectively.
[Key words] Diabetes mellitus; Cognitive dysfunction; Bibliometrics; CiteSpace
糖尿病(diabetes mellitus,DM)是一种慢性代谢性疾病。目前,全世界超过 4 亿人受到糖尿病的影响,预计这一数字到2045年将突破7亿[1]。据最新流行病学统计结果显示我国糖尿病患者由 2011的9000万例增至2021年的1.4亿例[2]。糖尿病及其并发症会对大脑的代谢、结构和功能产生影响,进而引发认知障碍的发生及认知损伤的加重[3]。
既往研究表明糖尿病患者发生认知障碍的概率比非糖尿病患者高,其发生认知障碍的风险也比非糖尿病患者高出约2倍,并促使轻度认知功能障碍向痴呆的进展速度增加1.5~3.0倍[4-6]。一项Meta分析研究也为之提供了证据[7]。由于糖尿病患者长期血糖控制不佳,继而会引起一系列并发症,如心脑血管病、肾病、视网膜病变、糖尿病足等大大增加认知障碍的发生风险,因而对其进行早期的识别和干预极其重要[8]。虽然目前关于糖尿病认知障碍的研究相對较多,但仍缺乏以国际更高层次从宏观的视角上把握和综述该领域发展的文献。因此,本研究以可视化的视角借用CiteSpace软件对Web of Science核心数据库中与糖尿病认知障碍相关的研究从整体发文量、作者、机构、国家、关键词进行分析,系统探讨国内外该领域研究中的热点和趋势,以期为更深层次地研究提供借鉴和参考。
1 资料与方法
1.1 资料来源
本研究以Web of Science核心合集数据库为检索源,检索时间为建库至2022年10月。检索策略:((TS=(cognitive disorder )) OR TS=(cognitive deficit)) OR TS=(cognitive impairment) AND TS=(diabetes)。纳入文献类型为Article和Review的文献,由2名研究人员分别对检索到的文献题目与摘要进行独立查阅,筛除非英文文献及与主题不相符的文献,若存在争议则与第3名研究人员进行商议再决定纳入与否,最终纳入6448篇有效文献。
1.2 数据转化与分析
文献以纯文本格式导出,命名为“download.txt”保存。导入CiteSpace6.1.R3软件进行可视化分析。参数设定如下Time Slicing设为From 11985 JAN to 2022 DEC,Years Per Slice设为 1,Selection Criteria选择g-index=20;Pruning选择“Pathfinder”和“Pruning sliced networks”,其余参数均设为默认值,对导入文献进行可视化分析得到图谱[9]。
2 结果
2.1 研究文献年度分布
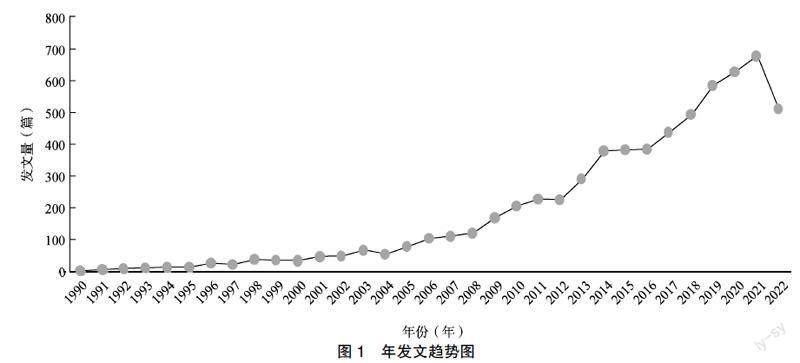
本研究对6448篇有效文献的发表时间分布情况进行统计分析,得到的建库至2002年发文趋势见图1其中2022年只统计至10月,整体发文量呈上升趋势,年最低发文量为2篇(1990年),年最高发文量达680篇(2021年)。1990至1997年为糖尿病认知障碍研究的起步阶段,共发102篇,占总发文量的15.8%,1998至2003年发文量增长缓慢,2006年以后年发文量保持在100篇以上,见图1。
2.2 研究分布概况
2.2.1 作者合作网络分布 发文量前10位作者及其影响力见表1。其中5名来自美国;来自荷兰乌得勒支大学的Biessels GJ发文最多;虽然Knopman DS发文23篇居第6位,但H指数(128)最高,表明其在该领域有一定的影响力。
2.2.2 国家与研究机构网络分布 共纳入111个国家,美国、中国、英格兰分别以2197、1150、408篇居前3位,其中美国发文量近总发文量的1/3,且中心性最高(0.14),表明美国在该领域有一定的影响力和号召。中国发文量居于第2位但其中心性(0.04)不高。共纳入了690个机构,加利福尼亚大学、美国匹兹堡大学、约翰霍普金斯大学发文量居于前3位,见表2。
2.3 共被引文献分析
其中被引次数前最多的是Biessels等[1]在2018年发表,共被引143次,主要阐述了糖尿病患者认知能力下降与痴呆之间的作用机制和临床意义。其次是在2012年发表,共被引99次,主要阐述糖尿病作为痴呆和轻度认知障碍发生的一项危险因素。Livingston等2017发表在Lancet杂志上,共被引97次,其主要阐述了痴呆的预防、干预和护理。
2.4 关键词分析
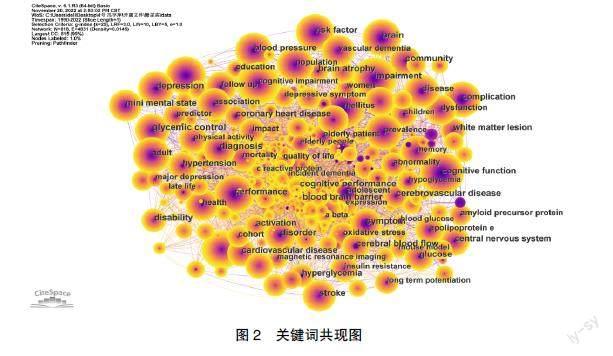
将词频≥10的关键词共现分析后见图2。将意义表达相同或相近的关键词进行合并处理,并去除主要检索词后[10]。排名前10的关键词为risk factors、brain、prevalence、insulin resistance、oxidative stress、type 2 diabetes mellitus、older adults、memory、healthy、performance。为更好了解该领域的热点,综合考量关键词词频,合并语义相近关键词后归纳出2个研究热点:发病机制、危险因素。
3 讨论
从年发文量统计结果可知年发文量呈上升趋势,从核心作者分析可知,共纳入966名作者,Biessels GJ中心性最高,表明该学者是该领域的领跑者[1]。其次,各作者之间虽然形成了自己的研究团队但跨机构与跨国家的交流合作仍缺乏,因此各研究团队和研究机构应多关注顶尖机构的前沿动态,加强彼此间的沟通交流,优势互补、拓宽研究的深度与广度。而美国和中国是对糖尿病认知障碍相关研究的主要国家,排名前10的期刊中大多数也来自以上2个国家。
研究发现由 α 分泌酶切割产生的具有神经营养作用的淀粉样前体蛋白会引起胰岛素抵抗和 β 淀粉样蛋白沉降[11]。当淀粉样前体蛋白被 β、γ 分泌酶切割后,会形成有毒的 A、β是痴呆症患者脑内斑块的主要成分,而沉积下来形成的老年斑则是认知障碍病理性依据之一[12]。此外,小鼠实验表明胰岛抵抗导致分泌酶活性增加会导致大脑中淀粉样蛋白增加[13]。
在正常状态下细胞内信号传导的微管稳定性和调节作用由 tau 蛋白负责。与tau 蛋白相关的假说认其过度磷酸化,使正常的 tau 蛋白转化为对的螺旋纤维和神经原纤维缠结,从而导致痴呆的病理特征的形成。通常情况下,胰岛素信号通路可通过抑制 GSK-3β 的磷酸化作用,抑制 Aβ 的生成和抑制 tau 蛋白的磷酸化。同时 GSK-3β 异常的活性也会增加 Aβ 的生成,促使 Aβ 斑块沉积。反过来,Aβ的积累会进一步破坏 GSK-3β 的活性,增加 tau蛋白磷酸化,进一步导致痴呆[14-17]。
此外,Aβ的产生和斑块形成会引起活化的星形胶质细胞和小胶质细胞介导的炎症反应[18]。小胶质细胞及星形胶质细胞的活化,可引起炎性细胞因子的分泌,包括白细胞介素(interleukin,IL)-β型、IL-6型及肿瘤坏死因子(tumor necrosis factor,TNF)-α型等,而炎性因子的大量分泌又会引起 Aβ 的生成及斑块的形成,形成恶性循环,加重认知功能的损伤[19-20]。
相关研究表明,高血糖生成的晚期糖基化最终产物是导致认知障碍的因素之一[21]。研究表明,高血糖可导致内皮细胞增殖异常、微血管淀粉样病变、血管灌注率降低以及通透性增加,从而影响血-脑脊液屏障的完整性和转运功能,导致神经血管单元功能障碍和脑血流调节障碍,引发脑部功能的损伤[22]。并且长期高血糖会导致血浆黏度增加以及血流动力学的改变,这与糖尿病轻度认知障碍相关[23]。此外,研究证明较高水平的糖化血红蛋白与较低水平的认知功能相关[24]。
研究表明胰岛素抵抗(insulin resistance,IR)以及高胰岛素血症会引起2型糖尿病患者的神经变性。并且具有高胰岛素血症和IR的患者,其在定向力、记忆力和计算力方面也表现出较于正常人较差的认知能力[25-26]。而IR 可降低脑内胰岛素水平和胰岛素活性,减少脑内葡萄糖代谢从而造成神经元功能障碍,引发认知功能损伤[27-28]。
糖尿病微血管并发症已被考虑作为与功能性脑异常和认知能力下降相关的可能因素[29-30]。一项针对糖尿病患者视网膜微血管变化与认知障碍关系的研究显示,视网膜疾病也可能是糖尿病患儿产生认知障碍的潜在风险原因。另外,损伤的大脑微血管也会引起神经元细胞凋亡,与损伤神经元连接,从而引起大脑功能障碍,进而患者表现为认知力减退甚至痴呆等[31-33]。
老年、教育水平低下、冠心病、性别、高血压病程延长等均是糖尿病认知功能障碍的重要风险因子。
利益冲突:所有作者均声明不存在利益冲突。
[参考文献]
- BIESSELS G J, DESPA F. Cognitive decline and dementia in diabetes mellitus: mechanisms and clinical implications [J]. Nat Rev Endocrinol, 2018, 14(10): 591–604.
- LI Y, TENG D, SHI X, et al. Prevalence of diabetes recorded in Mainland China using 2018 diagnostic criteria from the American Diabetes Association: National cross sectional study [J]. BMJ (Clinical research ed), 2020, 369: m997.
- 修雙玲, 孙丽娜, 穆志静, 等. 老年2型糖尿病患者认知功能障碍影响因素分析 [J]. 中华老年多器官疾病杂志, 2019, 18(6): 439-442.
- DEGEN C, TORO P, SCHONKNECHT P, et al. Diabetes mellitus type Ⅱ and cognitive capacity in healthy aging, mild cognitive impairment and Alzheimers disease [J]. Psychiatry Res, 2016, 240: 42–46.
- XUE M, XU W, OU Y N, et al. Diabetes mellitus and risks of cognitive impairment and dementia: A systematic review and meta-analysis of 144 prospective studies [J]. Ageing Res Rev, 2019, 55: 100944.
- ZHAO Q, ZHANG Y, LIAOiao X, et al. Executive function and diabetes: A clinical neuropsychol perspective [J]. Fronti Psychol, 2020, 11: 2112.
- GEERT J B, FLORIN D. Cognitive decline and dementia in diabetes mellitus: Mechanisms and clinical implications [J]. Nat Rev Endocrinol, 2018, 14(10): 591–604.
- CARRACHER A M, MARATHE P H, CLOSELOSE K L. International diabetes federation 2017 [J]. J Diabetes, 2018, 10(5): 353–356.
- 阮安然, 胡浩冉, 任亚豪, 等. 2010-2020年炎症性肠病心理领域研究热点的可视化分析 [J]. 护理学报, 2022, 29(6): 26–31.
- 刘国庆, 韩婧怡, 宋文静, 等. 虚拟现实在护理领域应用研究关键词的可视化分析 [J]. 护理学报, 2022, 29(3): 29–34.
- MUNSHI M N. Cognitive dysfunction in older adults with diabetes: What a clinician needs to know [J]. Diabetes Care, 2017, 40(4): 461–467.
- SELKOE D J, HARDY J. The amyloid hypothesis of Alzheimers disease at 25 years [J]. EMBO Mol Med, 2016, 8(6): 595–608.
- STARKS E J, PATRICK O'GRAGY J, HOSCHEIDTS M, et al. Insulin resistance is associated with higher cerebrospinal fluid tau levels in asymptomatic APOE?4 carriers [J]. J Alzheimers Dis, 2015, 46(2): 525–533.
- LACOVICH V, ESPINDOLA S L, ALLOATTI M, et al. Tau Isoforms imbalance impairs the axonal transport of the amyloid precursor protein in human neurons [J]. J Neurosci, 2017, 37(1): 58–69.
- BRION J P. The neurobiology of Alzheimers disease [J]. Acta Clin Belg, 1996, 51(2): 80–90.
- LIU Y, LIU F, GRUNDKE-IQBAL I, et al. Deficient brain insulin signalling pathway in Alzheimers disease and diabetes [J]. J Pathol, 2011, 225(1): 54–62.
- MATTSSON N, ZETTERBERG H, JANELIDZE S, et al. Plasma tau in Alzheimer disease [J]. Neurology, 2016, 87(17): 1827–1835.
- YU D, LIU B, JIANG G, et al. Correlation of changes in serum S100β, NSE and inflammatory factor levels with MMSE and MoCA in intracranial tumor patients with cognitive impairment [J]. Oncol Lett, 2020, 20(2): 1968–1972.
- RONG Z, HONG Z, SU S B. A critical role for interleukin-1β in the progression of autoimmune diseases [J]. Int Immunopharmacol, 2013, 17(3): 658–669.
- FISCHER R, MAIER O. Interrelation of oxidative stress and inflammation in neurodegenerative disease: Role of TNF [J]. Oxida Med Cell Longe, 2015, 2015: 610813.
- SPAUWEN P J, VAN EUPEN M G, KOHLER S, et al. Associations of advanced glycation end-products with cognitive functions in individuals with and without type 2 diabetes: The maastricht study [J]. J Clin Endocrinol Meta, 2015, 100(3): 951–960.
- DORSEMANS A C, COURET D, HOARAU A, et al. Diabetes, adult neurogenesis and brain remodeling: New insights from rodent and zebrafish models [J]. Neurogenesis (Austin, Tex), 2017, 4(1): e1281862.
- CHUNG C C, PIMENTEL D, JORDAN A J, et al. Inflammation-associated declines in cerebral vasoreactivity and cognition in type 2 diabetes [J]. Neurology, 2015, 85(5): 450–458.
- PAPPAS C, ANDEL R, INFURNA F J, et al. Glycated haemoglobin (HbA1c), diabetes and trajectories of change in episodic memory performance [J]. J Epidemiol Commun Health, 2017, 71(2): 115–120.
- DIEHLi T, MULLINS R, KAPOGIANNIS D. Insulin resistance in Alzheimers disease [J]. Translatil Rese: 2017, 183: 26–40.
- TUMMINIA A, VINCIGUERRA F, PARISI M, et al. Type 2 diabetes mellitus and Alzheimers disease: Role of insulin signalling and therapeutic implications [J]. Int J Mol Sci, 2018, 19(11): 3306.
- BANKS W A, OWEN J B, ERICKSON M A. Insulin in the brain: There and back again [J]. Pharmacol Thers, 2012, 136(1): 82–93.
- SUBRAMANIAN M, VASUDEVAN K, RAJAGOPAL A. Cognitive impairment among older adults with diabetes mellitus in puducherry: A community-based cross-sectional study [J]. Cureus, 2021, 13(1): e12488.
- AREOSA SASTRE A, VERNOOIJ R W, GONZALE- COLACOHARMAND M, et al. Effect of the treatment of type 2 diabetes mellitus on the development of cognitive impairment and dementia [J]. Cochrane Database Sys Rev, 2017, 6(6): Cd003804.
- RENSMA S P, VAN SLOTEN T T, LAUNER L J, et al. Cerebral small vessel disease and risk of incident stroke, dementia and depression, and all-cause mortality: A systematic review and Meta-analysis [J]. Neurosci Biobehavl Rev, 2018, 90: 164–173.
- STEHOUWER C D A, MICROVASCULA R. Dysfunction and hyperglycemia: A vicious cycle with widespread consequences [J]. Diabetes, 2018, 67(9): 1729–1741.
- TIAN S, HUANG R, HAN J, et al. Increased plasma Interleukin-1β level is associated with memory deficits in type 2 diabetic patients with mild cognitive impairment [J]. Psychoneuroendocrinology, 2018, 96: 148–154.
- FEINKOHL I, PRICE J F, STRACHAN M W, et al. The impact of diabetes on cognitive decline: Potential vascular, metabolic, and psychosocial risk factors [J]. Alzheimers Res Ther, 2015, 7(1): 46
(收稿日期:2023–04–14)
(修回日期:2023–11–27)
