LYVE1+巨噬细胞在RA患者关节滑膜组织中表达变化及对RA-FLS细胞迁移、侵袭、FMT的抑制作用
2024-03-29李骁瀚王洪星王玺龙赵娜刘治璞张义
李骁瀚,王洪星,王玺龙,赵娜,刘治璞,张义
山东大学齐鲁医院检验科,济南 250012
类风湿性关节炎(rheumatoid arthritis,RA)是一种常见的慢性炎症性自身免疫性疾病,主要临床特征为关节炎症,可伴随逐渐进展的关节损伤[1]。成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)是一种间充质衍生细胞,可分泌滑液和关节软骨的某些成分,参与滑膜的生理学功能。FLS是RA 滑膜炎症和关节损伤的关键驱动因素[2]。与正常滑膜中FLS 相比,RA 滑膜中类风湿性关节炎成纤维样滑膜细胞(RA-FLS)的迁移、侵袭功能异常活跃[3]。在既往对于RA-FLS 的研究[4]常用人类风湿性关节炎成纤维细胞MH7A 替代RA-FLS 进行后续实验。研究[5]发 现,RA 组 织 中RA-FLS/MH7A 的COL1A1、fibronectin、α-SMA 等FMT相关基因mRNA 相对表达量均升高,说明RA-FLS 成纤维细胞向肌成纤维细胞 转 化(fibroblast-to-myofibroblast transformation,FMT)可能在RA的发生发展中发挥重要作用。既往研究[6]发现,RA 患者滑膜组织中巨噬细胞的丰度与关节损伤程度以及局部关节高疾病活动性评分呈正相关。淋巴管内皮受体-1(lymphatic vessel endothelial receptor-1,LYVE1)是透明质酸结合蛋白超家族的一员,基因全长2 313 个碱基,可翻译成由322 个残基构成的Ⅰ型完整跨膜糖蛋白,包含有212 个残基构成的糖基化胞外区、21 个残基组成的跨膜锚定区和63 个残基构成的细胞质尾3 个部分[10]。LYVE1主要在淋巴内皮细胞[11]和巨噬细胞[12]中表达。最新[13]研究报道,相对于健康人及RA缓解期患者,RA患者滑膜组织中LYVE1+巨噬细胞,表达降低。既往研究仅发现LYVE1+巨噬细胞是一种倾向于M2表型的巨噬细胞,其在RA 发生发展中的具体作用机制目前尚未明确。为此,我们观察了LYVE1+巨噬细胞在RA 患者关节滑膜组织中的表达变化及RA-FLS迁移、侵袭、FMT的抑制作用,探讨LYVE1+巨噬细胞在RA 发生发展中的可能作用机制,旨在为RA 的治疗提供新思路。现将结果报告如下。
1 材料与方法
1.1 RA、OA 患者滑膜组织LYVE1+巨噬细胞检测
1.1.1 临床资料 RA 与OA 患者滑膜组织均来源于2022年10月—2023年10月期间于山东大学齐鲁医院关节外科手术中切除的病变组织。由于无法获取健康人的滑膜组织,本研究根据以往的RA 滑膜研究经验,将OA 滑膜组织作为对照组[14],并将受检滑膜组织包埋于石蜡中保存。年龄(岁):RA患者男14 例、女31 例,年龄(57.2 ± 4.31)岁,病程(6.00 ±2.74)年,C 反应蛋白77.50(58.43,88.39)mg/L,血沉150.51(84.51,211.78)mm/h,疼痛评分NRS 为4.5(2,7)分,RF191.56(92.40,264.78)IU/mL。OA患者中男23例、女22例,年龄55(59,72)岁,病程7(5,9)年,C 反 应 蛋 白4.87(2.73,8.01)mg/L,血 沉(6.43 ± 4.86)mm/h,疼痛评分NRS为3(2,4)分;RA与OA患者年龄性别比例等一般资料具有可比性。纳入RA、OA 患者均签署知情同意书,本研究获得山东大学齐鲁医院伦理委员会批准(KYLL-202210-069-1)。
1.1.2 RA 与OA 患者滑膜组织LYVE1 与CD68 定位与定量检测 采用免疫荧光(IF)染色法。观察CD68 与LYVE1 标记物的颜色分布分析标记物在滑膜组织中的定位,通过收集、计算CD68 与LYVE1 标记物的荧光表达量分析被标记物在滑膜组织中的表达量。选择兔源性抗人LYVE1 抗体与兔源性抗人CD68抗体对载玻片进行定位标记。使用Alexa Fluor 594结合的抗人抗体标记兔源性抗人LYVE1抗体和Alexa Fluor 488 结合的抗人抗体标记兔源性抗人CD68 抗体进行定量染色。使用蔡司Axio 立式荧光显微镜来拍摄图像,将滑膜组织中CD68 的表达视为滑膜组织中巨噬细胞的表达[8],LYVE1与CD68表达重叠位置视为LYVE1+巨噬细胞表达。ImageJ 软件分别收集、计算滑膜组织中LYVE1 与CD68 的荧光强度,将荧光强度视为LYVE1 与CD68 在滑膜组织中的表达量。重复测算3次,取平均值。
1.2 LYVE1+巨噬细胞对RA-FLS 迁移、侵袭、向肌成纤维细胞转化的抑制作用观察
1.2.1 细胞、试剂及仪器 人单核细胞白血病细胞(THP-1 细胞,是一种单核细胞,能够被佛波酯PMA诱导分化为巨噬细胞[9])、人类风湿性关节炎成纤维细胞(MH7A 细胞)(ATCC,中国);RPMI 1640 培养基、DMEM 高糖培养基、胎牛血清(FBS)、胰蛋白酶和PBS(Gibco 公司,美国);PMA(MCE,美国);兔源性抗人LYVE1抗体、兔源性抗人CD68抗体(Proteintech,美国);LYVE1过表达慢病毒(吉凯基因医学科技股份有限公司,上海);TRIzol 试剂、Fast SYBRGreen®Master Mix(ThermoFisher,美国);RT-qPCR引物(捷瑞生物工程有限公司,上海);培养瓶、6 孔板、24 孔板和Transwell 小室等(赛维尔生物科技有限公司,武汉)。
1.2.2 构建LYVE1+巨噬细胞 按照供应商提供的说明书操作,取对数生长期THP-1细胞,在培养液中加入LYVE1 过表达慢病毒,同时加入2 ng/mL 浓度的嘌呤霉素进行筛选,培养48 h,获得表达LYVE1的THP-1 细胞。在表达LYVE1 的THP-1 细胞中加入100 ng/mL 的PMA 诱导培养48 h,即获得LYVE1+巨噬细胞。由于THP-1 细胞本身不表达LYVE1,因此另取部分THP-1细胞,仅加入100 ng/mL的PMA 诱导培养48 h,获得LYVE1-巨噬细胞。
1.2.3 LYVE1+巨噬细胞对MH7A 细胞迁移能力的影响观察 采用划痕实验。取对数生长期MH7A细胞,用含10% FBS 的DMEM 高糖培养基培养至细胞生长融合至80%。用无菌塑料移液管尖端对细胞单层进行刮擦,PBS 洗涤2 次,将培养基更换为无血清的高糖DMEM 培养基。以3×104个LYVE1+/LYVE1-巨噬细胞(含有10% FBS的RPMI 1640完全培养基)分别加入不同的24 孔板Transwell 小室后分别插入划痕操作后的MH7A细胞孔板中。在小室中分别加入LYVE1+巨噬细胞(LYVE1+巨噬细胞组)与LYVE1-巨噬细胞(LYVE1-巨噬细胞组),将仅含培养基的小室标记为空白对照组。分别在培养0、24 和48 h 取出培养室,Olympus CKX53 倒置显微镜下对各组MH7A 细胞划痕进行观察和拍照,ImageJ 软件测算划痕面积,计算各组细胞划痕愈合比。划痕愈合比=(初始划痕面积-最终划痕面积)/初始划痕面积。重复测算3次,取平均值。
1.2.4 LYVE1+巨噬细胞对MH7A 细胞侵袭能力的影响观察 采用Transwell 侵袭实验。以3×104个LYVE1+/LYVE1-巨噬细胞(含有10% FBS 的RPMI 1640完全培养基)加入24孔板中。在小室中分别加入LYVE1+巨噬细胞(A 组)与LYVE1-巨噬细胞(B组),将仅含有的小室标记为C 组。将MH7A 细胞进行消化、收集,并使用不含血清的DMEM 高糖培养基进行重悬,24孔板Transwell小室中每小室加入3×104个MH7A 细胞,分别插入上述不同巨噬细胞分组的24 孔板中。24 h 后去除上室细胞,下室的细胞则为穿过小室滤膜的侵袭成功细胞。多聚甲醛固定与结晶紫染色小室滤膜,Olympus CKX53 倒置显微镜观察小室滤膜并随机拍照5 个视野,ImageJ 软件统计穿膜细胞数。重复测算3次,取平均值。
1.2.5 LYVE1+巨噬细胞对MH7A 细胞FMT 转化的影响观察 采用实时定量PCR(real time quantitative PCR,RT-qPCR)法。取对数生长期MH7A 细胞培养至细胞生长融合80%,分为一、二组,另选择仅含有培养基小室为空白组。分别消化收集LYVE1+及LYVE1-巨噬细胞,使用含有10% FBS 的RPMI 1640 完全培养基重悬。一二组分别加入3×104个的LYVE1+巨噬细胞、LYVE1-巨噬细胞,培养48 h 移除Transwell 小室,吸弃24 孔板中培养基并用PBS 清洗MH7A 细胞3次,使用TRIzol试剂提取MH7A 细胞总mRNA,按照试剂商的指示在QuantStudio6 上使用Fast SYBR®Green Master Mix进行RT-PCR,以检测各组MH7A 细胞FMT 相关基因(COL1A1、fibronectin、α-SMA)mRNA,以GAPDH 作为参考基因。COL1A1的上游引物为5'-GAGGGCCAAGACGAAGACATC-3',下游引物为5'-CAGATCACGTCATCGCACAAC-3';fibronectin 上游 引物 为5'-CGGTGGCTGTCAGTCAAAG-3',下游引物为5'-AAACCTCGGCTTCCTCCATAA-3',α-SMA上游引物为5'-TCCATCGGAGCCGAAGAAATC-3',下游引物为5'-CGGCTTCATCGTATTCCTGTT-3';GADPH 上 游 引 物 为 5'-AACGGATTTGGTCGTATTG-3',下游引物为5'-GGAAGATGGTGATGGGATT-3'。以2-ΔΔCT代表为COL1A1、fibronectin、α-SMA 的mRNA 相对表达量。FMT 相关基因mRNA 相对表达量越高,则该组MH7A 细胞FMT 过程越强,反之则该组MH7A 细胞FMT 过程越弱。重复测算3次,取平均值。
1.3 统计学方法 使用GraphPad Prism 9 统计软件。用 Shapiro-Wilk test 方法进行正态分析,不符合正态分布的计量资料用中位数和四分位数M(P25,P75)表示,两组间比较采用Mann-Whitney U 检验;符合正态分布的计量资料以±s表示,两组间比较采用Student'st检验,多组间比较采用方差分析,进一步两两比较使用Tukey多重比较检验法。P<0.05为差异具有统计学意义。
2 结果
2.1 RA 与OA 患者滑膜组织LYVE1、CD68 表达情况 RA 与OA 患者滑膜组织中LYVE1、CD68 表达位置基本重叠,说明LYVE1在RA与OA患者滑膜组织中主要表达在巨噬细胞上。RA 与OA 患者滑膜组织LYVE1 相对表达量分别为0.319 ± 0.033、1.000 ± 0.159(P<0.05),CD68 相对表达量分别为1.044 ± 0.081、1.000 ± 0.099(P>0.05)。
2.2 LYVE1+巨噬细胞对MH7A 细胞迁移侵袭与FMT过程的影响
2.2.1 各组细胞划痕愈合比比较 培养24 h 时LYVE1+巨噬细胞组、LYVE1-巨噬细胞组与空白对照组 划 痕 愈 合 比 分 别 为0.205 ± 0.006、0.362 ±0.015、0.462 ± 0.022,培养48 h 时LYVE1+巨噬细胞组、LYVE1-巨噬细胞组与空白对照组划痕愈合比分别为0.508 ± 0.014、0.680 ± 0.025、0.810 ±0.119。与LYVE1-巨噬细胞组、空白对照组比较,培养24、48 h 时LYVE1+巨噬细胞组细胞划痕愈合比低(P均<0.05)。
2.2.2 各组细胞穿膜数比较 培养24 h 时A、B、C组穿膜细胞数分别为(157.67 ± 6.59)、(224.67 ±5.35)、(254.67 ± 9.25)个,与B 组、C 组比较,培养24 h时A组细胞穿膜细胞数少(P均<0.05)。
2.2.3 各 组 细 胞 COL1A1 mRNA、fibronectin mRNA、α-SMA mRNA 相对表达量比较 培养48 h时各组细胞COL1A1 mRNA、fibronectin mRNA、α-SMA mRNA 相对表达量见表1。 与二组、空白组比较,培养48 h 时一组细胞COL1A1 mRNA、fibronectin mRNA、α-SMA mRNA 相对表达量少(P均<0.05)。
表1 培养48 h时各组细胞COL1A1 mRNA、fibronectin mRNA、α-SMA mRNA相对表达量(± s)
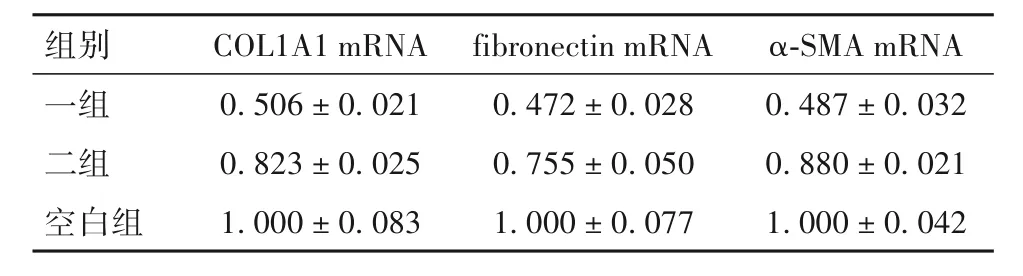
表1 培养48 h时各组细胞COL1A1 mRNA、fibronectin mRNA、α-SMA mRNA相对表达量(± s)
组别一组二组空白组COL1A1 mRNA 0.506 ± 0.021 0.823 ± 0.025 1.000 ± 0.083 fibronectin mRNA 0.472 ± 0.028 0.755 ± 0.050 1.000 ± 0.077 α-SMA mRNA 0.487 ± 0.032 0.880 ± 0.021 1.000 ± 0.042
3 讨论
RA滑膜关节中的巨噬细胞主要表现为M1型的促炎巨噬细胞与M2型的抗炎巨噬细胞。M1型巨噬细胞过度激活会破坏软骨,M2型巨噬细胞则具有修补型特性。CHAKAROV等[15]研究表明,LYVE1+巨噬细胞被认为是一种倾向于M2表型的巨噬细胞,并且在RA滑膜中,M2巨噬细胞具备修复特性[16]。因此,我们猜测LYVE1+巨噬细胞与M2 型巨噬细胞修复RA关节的作用相似。在本研究中,通过对RA与OA患者滑膜组织中CD68与LYVE1进行IF染色证实了LYVE1 在滑膜组织中主要表达在巨噬细胞中,且LYVE1+巨噬细胞在RA患者滑膜组织中表达减少,这与先前的研究[13]一致,而调控巨噬细胞中LYVE1 表达下调的机制尚未明确,仍需深入研究。本研究认为LYVE1与RA的发生发展密切相关,在后续的研究中,将对于RA患者血清中的胞外域脱落LYVE1[17]的表达量进行检测以及与RA 进展相关的指标如RF、抗CCP 抗体、das28 等进行相关性分析,评估LYVE1作为一种新型的血清学指标用于RA诊断的可行性。
FLS 在RA 关节损伤的发生发展中发挥重要作用。RA-FLS 表现出异常活跃的迁移和侵袭功能[3]。为了探究LYVE1+巨噬细胞对于RA-FLS细胞迁移和侵袭功能的影响,本研究通过通过划痕实验与Transwell 侵袭实验观察LYVE1+巨噬细胞对MH7A细胞迁移与侵袭功能的影响。在划痕实验中,LYVE1+巨噬细胞显著抑制MH7A 细胞的迁移功能,并且在Transwell侵袭实验中,LYVE1+巨噬细胞显著抑制MH7A 细胞的侵袭功能。这表明LYVE1+巨噬细胞可以抑制MH7A 细胞的迁移与侵袭功能,其机制可能与LYVE1+巨噬细胞的抗炎特性尤其是TNF-α的下降有关[18]。抗炎环境可以抑制RA-FLS 细胞的侵袭性改变,炎症环境中TNF-α 是影响RA-FLS 迁移与侵袭能力的关键因子,然而LYVE1+巨噬细胞是否通过影响TNF-α 影响RA-FLS 细胞的迁移与侵袭功能还需进一步研究。
RA 的进展与FLS 的FMT 过程有关,RA 患者关节整张损伤程度与RA-FLS的FMT过程呈正相关[5],其具体表现为RA-FLS 中的COL1A1、fibronectin、α-SMA等相关基因mRNA的表达增高。本研究通过RT-qPCR 探究LYVE1+巨噬细胞对MH7A 细胞FMT相关基因mRNA 表达的影响。结果显示,LYVE1+巨噬细胞明显抑制MH7A 细胞FMT 相关基因mRNA的表达,这表明LYVE1+巨噬细胞可以抑制MH7A 细胞的FMT 过程。TGF-β 有明确促进FMT 过程的功能,在我们前期研究中发现,相较于LYVE1 高表达的巨噬细胞,LYVE1低表达的巨噬细胞分泌更TGFβ 的能力明显增强。因此,LYVE1+巨噬细胞TGF-β能力下降的原因或许是影响RA-FLS 的FMT 过程的具体机制。
综上所述,相比于OA 患者,RA 患者滑膜组织LYVE1+巨噬细胞少。LYVE1+巨噬细胞可抑制RA-FLS 的迁移、侵袭及FMT。LYVE1+巨噬细胞可能在RA的发生发展中发挥重要作用。
