非小细胞肺癌组织中组蛋白去乙酰化酶7、泛素特异性肽酶10的表达变化及其意义
2024-03-29张帆杨鹏郝振叶巨宽心李颉
张帆,杨鹏,郝振叶,巨宽心,李颉
1太原钢铁(集团)有限公司总医院呼吸内科,太原 030008;2太原钢铁(集团)有限公司总医院风湿免疫科
肺癌是常见的恶性肿瘤之一,全球每年新增患者182.5 万例、死亡约159 万例[1]。非小细胞肺癌(Non-small cell lung cancer, NSCLC)是最常见的肺癌类型,可分为腺癌、鳞状细胞癌和大细胞癌。以手术治疗为主的综合治疗是目前临床常用的NSCLC治疗方法,但由于NSCLC 的肿瘤异质性较高,相同分期或不同治疗方法的患者疗效及预后差异较大[2]。因此,研究NSCLC发生发展的具体机制,寻找准确评估患者预后的肿瘤标志物,指导临床治疗方案的选择,具有重要临床意义。组蛋白去乙酰化酶7(histone deacetylase 7,HDAC7)属于组蛋白去甲基化蛋白酶家族成员,参与转录调控、细胞周期进展和细胞发育分化等过程。近年研究发现,黑色素瘤[3]、结直肠癌[4]等肿瘤中HDAC7能够通过上调c-Myc等癌基因的表达,促进肿瘤细胞的增殖和转移。泛素特异性肽酶10(Ubiquitin carboxyl-terminal hydrolase 10,USP10)是半胱氨酸蛋白酶家族成员,能特异性地切割结合蛋白质的泛素分子,参与细胞周期调控、自噬、增殖、迁移及耐药等[5-7]。目前NSCLC 组织中HDAC7、USP10 表达相关研究报道较少。为此,我们观察了NSCLC 组织中HDAC7、USP10 表达变化,探讨其临床意义,现将结果报告如下。
1 资料与方法
1.1 临床资料 2018 年4 月—2020 年4 月我院收治的NSCLC 患者98 例。纳入标准:①原发性肺癌,经CT 引导下肺穿刺活检术后病理明确诊断为NSCLC,后经全身评估为早到中期,由我院呼吸科转入胸外科进一步手术治疗,术中保留癌组织及癌旁组织(距离癌组织5 cm 以上的正常肺组织),术后按《中国临床肿瘤学会肺癌诊疗指南》推荐给予标准化化疗4~6 个周期;②术前患者未接受任何治疗;③患者均已签署知情同意书;④临床资料完整。排除标准:①有其它恶性肿瘤病史;②有结核病史、免疫系统疾病及其它严重感染;③合并心、肺、肝、肾等脏器异常;④有精神疾病病史。98 例患者中男58例、女40 例;年龄34~78(65.17 ± 6.19)岁;病理类型为腺癌62 例,鳞状细胞癌36 例;TNM 分期为Ⅰ~Ⅱ期63 例,Ⅲ期35 例;肿瘤高中分化56 例,低分化42 例;淋巴结转移33 例。本研究已通过医院伦理审查。
1.2 NSCLC 癌 组 织 癌 旁 组 织HDAC7、USP10 检测 采用免疫组织化学法。将NSCLC 癌组织和癌旁组织10%组织固定液固定16 h,石蜡包埋切片,厚度为3 μm,70 ℃温箱内溶蜡2 h,二甲苯脱蜡,梯度酒精脱苯处理,柠檬酸盐溶液中高压锅抗原热修复。自然冷却后用3%双氧水室温避光孵育15 min。3%羊血清封闭2 h。滴加HDAC7、USP10一抗后(购自美国abcam 公司,货号ab137366,ab109219),浓度为1∶200,4 ℃孵育过夜。滴加兔/鼠通用型二抗室温孵育30 min。所有切片在室温下用DAB 显色5 min,苏木素染色,盐酸酒精分化,梯度酒精脱水,晾干后中性树脂封片。显微镜拍照(日本奥林巴斯公司,型号SPM-20)。以已有的HDAC7 和USP10 结肠癌阳性膜片作为阳性对照,反应过程中用磷酸盐缓冲液替换一抗作为阴性对照。由两位病理医生在同一显微镜下观察染色结果,有争议时讨论做出判断。NSCLC 癌组织中HDAC7,USP10 棕黄色阳性表达主要位于细胞质和细胞膜,部分位于细胞核。在400×的高倍光学显微镜物镜下,随机选取5 个高倍视野,取每个视野的平均值作为阳性细胞的百分比,阳性细胞的百分比标准为:肿瘤细胞0%~5%染色计0 分、6%~30%染色计1 分、30%~60%染色计2 分、60%以上染色计3 分;染色强度标准为肿瘤细胞无染色计0 分、浅黄色计1 分、棕黄色计2 分、棕褐色计3 分。以阳性细胞的百分比与染色强度的乘积为最终评分,乘积≥2 分者判为阳性、<2 分者判为阴性。
1.3 NSCLC 患者的随访方法 98 例患者术后均进行电话和门诊随访。随访内容涵盖患者生存情况、术后治疗方案及近期复查结果等。随访3年,每3~6 个月随访1 次。随访截止至2023 年5 月。随访终点为患者死亡或随访结束。
1.4 统计学方法 采用SPSS26.0 统计软件。计数资料用%表示,组间采用χ2检验;采用Spearman相关性分析法分析NSCLC 癌组织中HDAC7 与USP10 表达的相关性;采用Kaplan-Meier 生存曲线分析HDAC7、USP10 表达与NSCLC 患者预后的关系,以NSCLC 患者是否死亡为因变量,自变量包括HDAC7表达、USP10 表达、肿瘤分化程度、淋巴结转移及TNM 分期;采用COX 多因素比例风险模型分析NSCLC 患者预后的影响因素。P<0.05 为差异具有统计学意义。
2 结果
2.1 NSCLC 癌组织和癌旁组织HDAC7、USP10 阳性表达率比较 NSCLC组织、癌旁组织中HDAC7阳性率分别为65.31%(64/98)、6.12%(6/98)(χ2=74.756,P<0.05);NSCLC 组织、癌旁组织中USP10阳性率分别为63.27%(62/98)、8.16%(8/98)(χ2=64.800,P<0.05)。
2.2 NSCLC 癌组织中HDAC7、USP10 表达的相关性 NSCLC 癌组织中HDAC7 与USP10 表达呈正相关(r=0.714,P<0.05)。
2.3 不同临床病理参数的NSCLC 患者HDAC7、USP10表达情况 不同临床病理参数的NSCLC患者HDAC7、USP10 表达情况见表1。不同肿瘤分化程度、淋巴结转移及TNM 分期的NSCLC 患者癌组织HDAC7 和USP10 表达阳性率比较,差异具有统计学意义(P均<0.05)。不同年龄、性别、病理类型及肿瘤直径之间比较,差异无明显统计学意义(P均>0.05)。
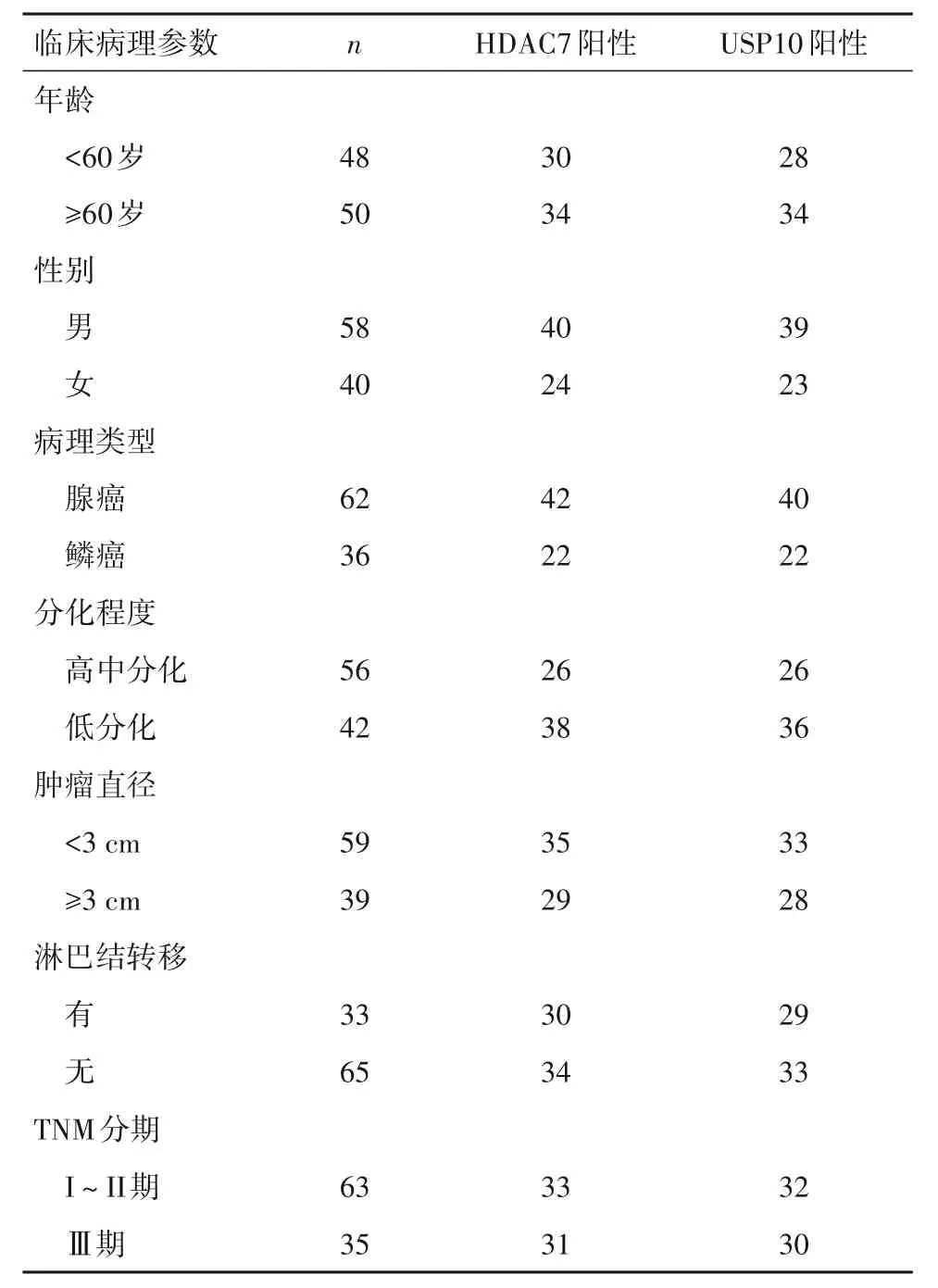
表1 不同临床病理参数的NSCLC 患者HDAC7、USP10表达情况(例)
2.4 不 同HDAC7、USP10 表 达 的NSCLC 患 者 预后情况比较 89 例患者随访过程中失访2 例、死亡39 例,3 年总生存率为60.20%(59/98)。HDAC7阳性、阴性患者3 年总生存率分别为45.31%(29/64),88.24%(30/34)。USP10 阳性、阴性患者3 年 总 生 存 率 分 别 为43.55%(27/62),88.89%(32/36)。Kaplan-Meier 生存曲线分析结果显示,与表达阴性者比较,HDAC7、USP10 阳性的NSCLC患者3 年累积生存率低(χ2=16.300、15.870,P均<0.05)。
2.5 NSCLC患者预后的影响因素COX回归 NSCLC患者预后的多因素COX 回归分析结果见表2。COX 回归分析结果显示,HDAC7 阳性、USP10 阳性、肿瘤低分化程度、有淋巴结转移、TNM 分期Ⅲ期是影响NSCLC 患者预后的独立危险因素(P均<0.05)。
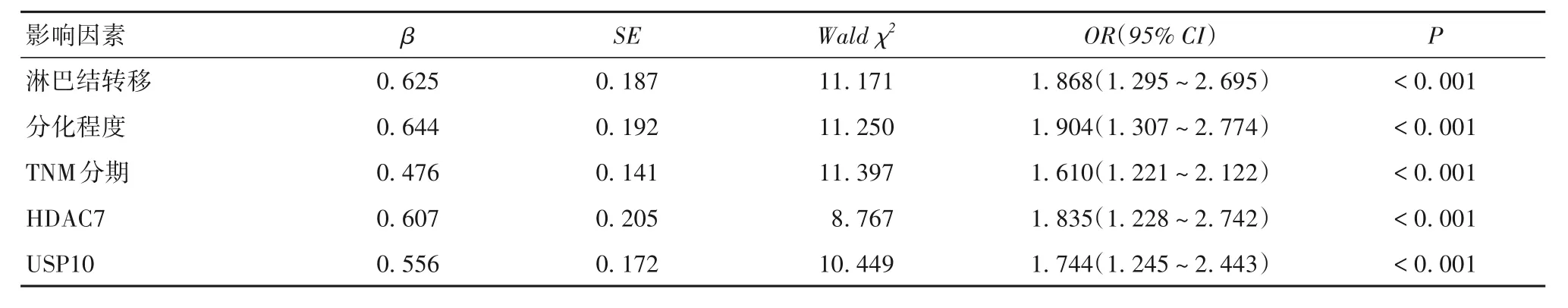
表2 NSCLC患者预后的多因素COX回归分析结果
3 讨论
NSCLC 早期症状不明显,2/3 的患者确诊时已处于晚期。尽管随着医疗水平的提高,肺癌靶向治疗和免疫治疗的发展,肺癌患者的远期生存预后仍然较差[8]。既往对NSCLC患者预后评估主要基于临床特征、病理类型及肿瘤TNM 分期等,但由于肿瘤异质性,在判断患者预后中的准确性不高[9]。深入研究NSCLC 疾病机制,探讨NSCLC 预后影响因素,评估个体患者的生存期,对于改善患者临床诊治及延长生存时间具有重要意义。
组蛋白的乙酰化/去乙酰化修饰是表观遗传学调控的重要机制,能够多步骤、多层次调节染色质结构和基因转录[10]。HDAC7 是组蛋白去乙酰化酶Ⅱa类家族成员,能够通过与转录因子相互作用,募集到特定的基因区域发挥表达调控作用[11]。研究发现,HDAC7通过转录起始位点和超级增强子的组蛋白3赖氨酸27 乙酰化修饰,促进肿瘤细胞干性特征维持,进而参与肿瘤细胞增殖及肿瘤的发生[12]。本研究中,HDAC7 在NSCLC 患者癌组织中表达升高,与肿瘤分化程度、淋巴结转移及TNM 分期有关,表明HDAC7参与NSCLC的发生发展。研究表明,NSCLC肿瘤细胞中长非编码RNA OPA 相互作用蛋白5 反义RNA1 能够抑制微小RNA-140-5p 的表达,进而增加HDAC7 mRNA 的稳定性,导致HDAC7 蛋白表达升高,HDAC7 能够诱导血管内皮生长因子A 的表达,促进淋巴管生成,促进肿瘤细胞的淋巴转移[13]。另外,HDAC7是内皮祖细胞诱导的新生血管形成中的关键调节因子,促进肿瘤血管新生及肿瘤增殖转移[13]。实验研究[14]发现,敲除NSCLC 肿瘤细胞中HDAC7的表达后,肿瘤细胞外信号调节激酶去磷酸化,抗血管生成基因如内皮抑素等的表达增加,进而抑制肿瘤血管管腔的形成。本研究中,HDAC7阳性NSCLC 患者预后较差,提示HDAC7 是新的评估NSCLC 预后的肿瘤标志物。分析其原因,可能与HDAC7 参与促进化疗耐药性形成有关。研究[15]表明,HDAC7 与MYC 结合到人有机阳离子转运蛋白OCT2 启动子处,增加OCT2 启动子基因处组蛋白3赖氨酸18 和27 位点的乙酰化修饰水平,激活OCT2的表达,导致肿瘤细胞对奥沙利铂等化疗耐药性的形成。利用HDAC7 抑制剂TMP195 能够诱导布鲁顿酪氨酸激酶的高乙酰化,增强单核细胞衍生的巨噬细胞的抗肿瘤效应,增强慢性淋巴细胞白血病患者抗体治疗的有效性[16]。因此,HDAC7的表达促进NSCLC 肿瘤的发生发展,是评估患者预后的肿瘤标志物,以HDAC7 为靶点的治疗是潜在的NSCLC 治疗方案。
USP10 是去泛素化酶家族成员,能够将细胞质中多种蛋白去泛素化,调节细胞增殖、凋亡及自噬。研究报道,USP10在肝癌[17]、前列腺癌[18]等多种肿瘤组织中高表达,其通过帮助中细胞从上皮性表型转化为间充质细胞,提高肿瘤细胞转移、侵袭能力。本研究中,NSCLC 中USP10 表达升高,提示USP10 参与NSCLC 的肿瘤进展。NSCLC 中USP10 的表达上调与缺氧有关。缺血缺氧状态可导致肿瘤组织缺氧诱导因子1α 转录上调,进一步上调USP10 的表达,USP10 能够阻止抑癌因子p53 进入肿瘤细胞核,促进 肿 瘤 恶 性 进 展[19]。本 研 究 中,USP10 表 达 与NSCLC 患者的不良临床病理特征有关,表明USP10促进NSCLC 肿瘤进展。研究发现,恶性肿瘤中的c-Myc 可诱导USP10 的转 录,介导p14ARF 的去泛素化,增强p14ARF 蛋白的稳定性,促进肿瘤细胞的发生及恶性转化[20]。此外,USP10 能够直接与Yes 相关蛋白/TAZ 相互作用,通过去泛素化来稳定Yes 相关蛋白/TAZ,激活下游c-myc 等癌基因的表达,促进肝细胞癌等恶性肿瘤的增殖和转移[6]。在本研究中,USP10 阳性表达的NSCLC 患者预后较差,表明USP10 是新的评估NSCLC 预后的肿瘤标志物。研究发现,USP10 能够与组蛋白去乙酰化酶6 相互作用,促进P53 基因突变的NSCLC 肿瘤细胞对顺铂等铂类化疗药耐药性形成,导致患者不良预后[21]。有 学 者[22]报 道,USP10 的 特 异 性 抑 制 剂Spautin-1 能够抑制黑色素瘤细胞凋亡,促进活性氧介导的DNA 损伤,与顺铂等化疗药物发挥协同抗肿瘤效应。本研究显示,NSCLC 中HDAC7 与USP10 表达呈显著正相关,提示两者可能存在相互作用关系。有学者[23]证实,NSCLC 中USP10 能够与促进HDAC7 去泛素化,增强HDAC7 的稳定性,HDAC7 一方面通过上调成纤维生长因子18 的表达,促进NSCLC 肿瘤细胞的增殖。另一方面与β-连环蛋白的相互作用,降低β-连环蛋白Lys49 的乙酰化水平,促进β-连环蛋白的核转移,增强肿瘤细胞的侵袭和迁移。
本研究中,低分化程度是影响NSCLC 患者预后的独立危险因素。低分化的NSCLC 肿瘤细胞恶性程度高,增殖能力强,肿瘤生长速度快,肿瘤容易侵犯周围组织,发生血管及淋巴结转移,导致患者不良预后。NSCLC 患者淋巴结转移是影响NSCLC 患者预后的重要因素,这与既往研究中淋巴结清扫的数量和范围能够显著改善早期NSCLC 患者的无复发生存率和总生存率的结果一致[24]。TNM 分期系统是临床上预测NSCLC 患者预后的重要依据,对于TNM 分期Ⅲ期NSCLC 患者,肿瘤负荷大,肿瘤细胞的侵袭和转移能力强,术后肿瘤复发和转移的风险较高,患者远期生存预后较差。
综上所述, NSCLC 癌组 织 中HDAC7、USP10表达升高,HDAC7、USP10 阳性表达与NSCLC 患者的不良临床病理特征及不良预后有关。HDAC7、USP10 可能作为新的NSCLC 预后相关肿瘤标志物。但本研究纳入样本量较小,未对不同临床病理特征的NSCLC 患者进行分层分析,也未深入研究HDAC7、USP10 在NSCLC 发展中的具体作用机制,未来需要进一步的基础和临床实验进行探索。
