放牧与舍饲牦牛日增重、瘤胃发酵和血液参数对比
2024-03-28刘红山马志远裴成芳吴刀知才让甘水燕周建伟
刘红山,马志远,裴成芳,吴刀知才让,甘水燕,周建伟
(1.草地农业生态系统国家重点实验室 / 兰州大学草地农业科技学院, 甘肃 兰州 730020;2.天祝藏族自治县畜牧技术推广站, 甘肃 武威 733200)
牦牛作为青藏高原的特有畜种,其肉、乳、皮、毛等畜产品为藏族同胞提供了重要的生活物资、生产资料和经济来源[1-2]。据统计,我国青藏高原牦牛存栏量1 600 多万头,占全球牦牛总数的90%以上[3]。从古至今,自然放牧一直是牦牛生产中最重要的养殖模式,且天然牧草是放牧牦牛赖以生存的唯一食物来源。然而,青藏高原的生态环境具有高海拔、缺氧、寒冷、强紫外线等不利条件,这也就造成了该地区植物生长期短、牧草生物量和养分含量低以及草畜季节性供应不平衡等生产瓶颈问题[4-5]。传统自然放牧模式下,牦牛一直都重复着“夏壮、秋肥、冬瘦、春乏”的恶性循环[6],每年冷季都会因养分摄入不足而造成其25%以上的体重损失,生产效率极其低下[7]。另外,草地放牧的季节性育肥模式也导致了秋季大量牦牛的集中出栏,造成牦牛畜产品商品率低,从而使得市场价格普遍偏低,这也直接影响了牧民的经济收入,且限制了区域经济的健康与可持续发展。
近年来,随着牧民思想的不断解放、藏区养殖技术水平的日益提高以及国家交通运输网络的层层构建,青藏高原牦牛养殖模式逐渐趋于多元化。例如,通过舍饲短期育肥方式,不但提高了牦牛的生产效率,解决了牦牛季节性出栏问题,而且也改善了牦牛肉品质,带动了牧民“脱贫致富”,同时也促进了藏区牧业经济的发展[8-9]。与自然放牧模式相比,舍饲育肥能够为家畜提供更加充足的食物供给、更科学的营养搭配以及更稳定可控的环境条件,所以该模式下的动物生产性能会更加高效[10-11]。然而,舍饲育肥模式需要圈舍修建、饲喂基础设施改造以及相对昂贵的商业饲料投入。这些都会大大增加生产成本。此外,舍饲牦牛由于受到饲养密度、圈舍环境、动物福祉以及饲粮组分等方面的限制,其机体免疫与抗氧化能力均会受到不同程度的影响[12]。研究表明,饲粮原料组成和营养水平是决定反刍动物瘤胃微生物区系、发酵功能和菌体蛋白产量的首要因素[13-14]。据此推测,牦牛在放牧与舍饲两种不同的育肥模式下,两处理组间在上述所涉及的几方面必定会存在巨大差异。
基于此,本试验拟通过对比研究放牧与舍饲两种饲养模式在育肥牦牛日增重、瘤胃发酵参数和血液生理生化指标等方面的差异,以期为生产实践中传统养殖模式下牦牛饲养转型升级和肥育模式决策提供一定的理论依据。
1 材料与方法
1.1 试验地概况
本试验于2021 年6 月至10 月在甘肃省武威市天祝藏族自治县乌鞘岭兰州大学牦牛试验站(102°48′34.32″ E,37°14′20.54″ N)进行。该地区位于青藏高原东北部,平均海拔3 154 m,年平均气温-0.2 ℃,年均降水量411 mm。试验区天然放牧草地主要以矮生嵩草(Kobresiavidua mysouroides)为优势种,伴生有平车前(Plantago depressa)、珠芽蓼(Polygonum viviparum)、垂穗披碱草(Elymus nutans)、鹅绒委陵菜(Potentilla anserina)等。
1.2 试验设计
试验采用随机区组设计,选取12 头年龄相同(4 岁)、体重相近(202 ± 5.2 kg) 、健康状况良好的去势公牦牛,随机分为2 组,即自然放牧组(natural grazing,NG) 和舍饲组(house-feeding,HF),每组各6 头牛。NG 组牦牛采用传统的草地放牧育肥模式;HF 组牦牛采用现代的短期舍饲育肥模式。NG 组牦牛饲粮为天然牧草,HF 组参照当地牦牛育肥场饲养规程来配置全混合饲粮,其营养水平如表1 所列。
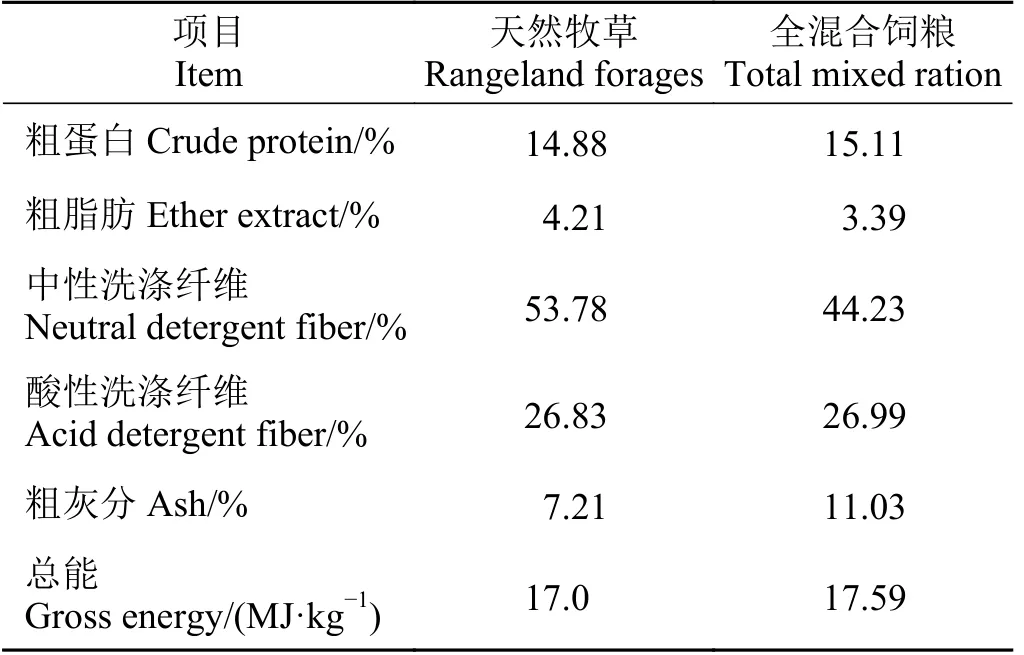
表1 天然牧草和全混合饲粮的营养成分(干物质基础)Table 1 Chemical composition of the rangeland forages and total mixed ration (DM basis)
1.3 饲养管理
试验开始前对所有育肥牛逐只注射伊维菌素以进行驱虫处理。NG 组牦牛按照当地传统放牧方式进行管理,其在高寒草地上进行全天候放牧,无任何补饲;HF 组牦牛单栏饲养,每天分别在07:30 和18:00 进行饲喂,按照剩料量约占总采食量10%的原则进行投料,自由采食和饮水。整个育肥试验期总共105 d,其中预试期15 d,正试期90 d。
1.4 样品采集
分别在正试期的第30 天、第60 天和第90 天,跟随放牧牦牛并观察其采食牧草的种类及株高,利用模拟采食法[15]采集天然牧草鲜样500 g;同时采集舍饲育肥条件下的全混合饲粮样品300 g。上述饲料样品分别装入自封袋中,于-20 ℃冰箱保存,用于后续营养成分的测定。
在正试期第90 天晨饲前,利用穿刺法通过试验牛颈静脉采集血液10 mL,其中2 mL 分装于抗凝采血管中,用于血液生理指标的测定;其余8 mL 血液静置30 min,然后在4 ℃、3 000 g 下离心15 min,取上清液分装于1.5 mL 的离心管中,于-20 ℃冰箱中保存,用于血液生化指标及激素水平的测定。利用口腔式胃管并辅以真空泵采集试验牦牛的瘤胃液150 mL,每次采样前使用温水将胃管及其收集装置清洗干净。为防止唾液污染,每次收集过程中弃去最开始的50 mL 瘤胃液,后续收集的100 mL 瘤胃液,经4 层纱布过滤后,立即使用pH 计(PB-10,广州市深华生物技术有限公司,北京) 测定滤液pH。将过滤后的瘤胃液分装于10 mL 离心管中,投入液氮速冻,带回实验室后转入-80 ℃超低温冰箱保存,用于后续氨态氮和挥发性脂肪酸浓度的测定。
1.5 指标测定与样品分析
1.5.1 日增重
在正试期第1 天和第90 天晨饲前,依次对育肥牦牛进行空腹称重,计算其平均日增重(average daily gain,ADG)。
1.5.2 天然牧草和全混合饲粮营养成分
天然牧草和全混合饲粮样品在65 ℃烘箱中处理48 h 后,粉碎过1 mm 筛,装入自封袋中保存。饲粮样品中的粗蛋白(crude protein,CP)含量测定采用凯氏定氮法,粗脂肪(ether extract,EE) 含量测定采用索氏提取法,灰分(Ash)含量测定采用直接灰分法,中性洗涤纤维(neutral detergent fiber,NDF)和酸性洗涤纤维(acid detergent fiber,ADF) 含量测定参照Van Soest 等[16]的方法,总能(gross energy,GE)含量采用全自动量热仪(IKA-C3000,艾卡仪器设备有限公司)进行测定。
1.5.3 瘤胃发酵参数
瘤胃液挥发性脂肪酸浓度的测定参考兰贵生[17]的方法,利用巴豆酸作为内标,使用气相色谱仪(Thermo Scientific,TRACE 1 300,Milan,Italy)测定,测定条件:毛细血管色谱柱(DB-FFAP,30 m × 0.32 mm ×0.25 μm,Agilent,USA),进样器和检测器温度均为240 ℃,空气流率350 mL·min-1,载气(N2) 流率20 mL·min-1,氢气流率35 mL·min-1,进样量1 μL,柱温箱温度从50 ℃起以25 ℃·min-1的速率升至190 ℃,维持5 min,再以10 ℃·min-1的速率升至200 ℃,维持5 min,之后以相同的速率升温至220 ℃并维持8 min。瘤胃液氨态氮浓度参照Hristov 等[18]利用比色法测定。
1.5.4 血液生理生化指标
血液生理指标在天祝藏族自治县华晟医院利用全自动血液细胞分析仪(BC-5000,深圳)测定,参数包括:白细胞(white blood cell,WBC)、红细胞数(red blood cell,RBC)、血红蛋白(hemoglobin,HGB)、红细胞压积(hematocrit,HCT)、红细胞平均体积(mean corpuscular volume,MCV)、平均血红蛋白量(mean hemoglobin,MCH) 、 平均血红蛋白浓度(mean hemoglobin concentration,MCHC)、红细胞体积分布宽度(width of red blood cell volume distribution,R-CV)、红细胞分布宽度(distribution width of red blood cells,R-SD)、血小板(platelet,PLT)、平均血小板体积(mean platelet volume,MPV) 、 血小板分布宽度(platelet distribution width,PDW) 和血小板压积(thrombocythemia,PCT)。血清生化指标与激素水均采用上海邦奕生物有限公司所提供的试剂盒参照说明书利用酶标仪(Labsystem Multiskan MS 352 型,芬兰)检测。葡萄糖(glucose,GLU)测定利用氧化酶法;生长激素(growth hormone,GH) 和β-羟基丁酸(β-hydroxybutyric acid,BHBA)测定采用酶联免疫反应(ELISA)法;甘油三酯(triglyceride,TG)测定利用单试剂比色(GPO-PAP) 法;总蛋白(total protein,TP)测定利用Doumas 法;白蛋白(albumin,ALB)测定利用甲酚绿(BCG)法。
1.5.5 血清抗氧化指标
超氧化物歧化酶(superoxide dismutase,SOD)活性、丙二醛(malondialdehyde,MDA)含量、总抗氧化能力(total antioxidant capacity,T-AOC)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)活性均采用上海邦奕生物有限公司所提供的试剂盒测定。
1.6 数据处理
采用Excel 2019 对试验数据进行初步整理,利用SPSS 22.0 软件独立样本t检验程序进行显著性分析。试验结果以平均值 ± 标准误表示,以P<0.05 表示处理组间差异显著。
2 结果与分析
2.1 不同育肥模式对牦牛日增重的影响
在暖季放牧模式下,NG 组牦牛平均日增重为383 g·d-1,HF 组牦牛平均日增重为521 g·d-1, HF 组显著高于NG 组(P< 0.05),且较NG 组提高了36% (图1)。
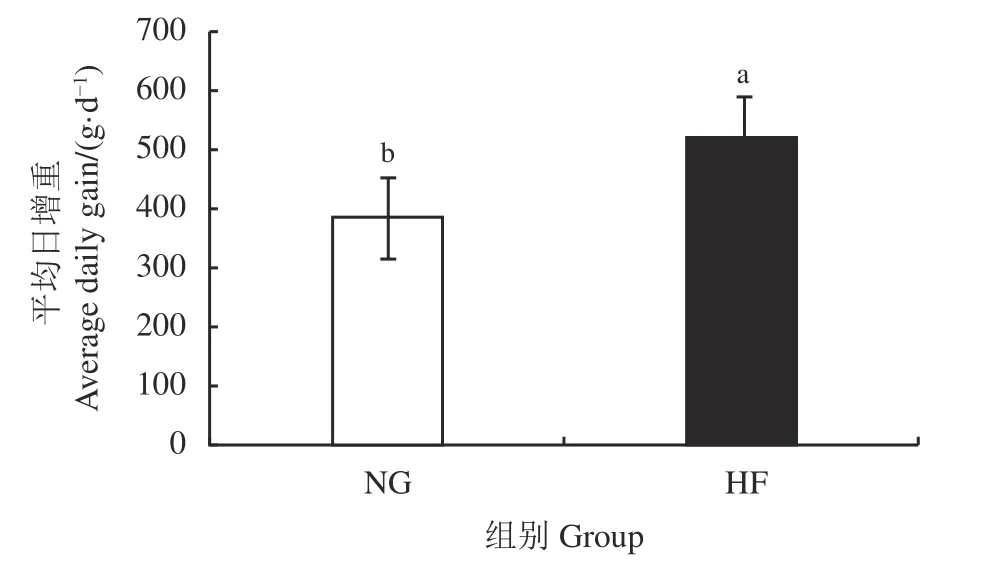
图1 不同育肥模式对牦牛平均日增重的影响Figure 1 Effect of different fattening patterns on average daily gain of yaks
2.2 不同育肥模式对牦牛瘤胃发酵参数的影响
如表2 所列,NG 组牦牛瘤胃液总挥发性脂肪酸、乙酸、丙酸、丁酸浓度和乙酸/丙酸均显著低于HF 组(P< 0.05),NG 组牦牛瘤胃液中的异丁酸和异戊酸浓度均显著高于HF 组(P< 0.01)。瘤胃液pH、氨态氮和戊酸浓度不受牦牛育肥模式影响(P> 0.05)。

表2 不同育肥模式对牦牛瘤胃发酵参数的影响Table 2 Effect of different fattening patterns on the rumen fermentation parameters of yaks
2.3 不同育肥模式对牦牛血液生理指标的影响
如表3 所列,NG 组牦牛血液中红细胞数、血红蛋白、红细胞压积、红细胞体积分布宽度和血小板数均显著高于HF 组(P< 0.05),NG 组牦牛血液白细胞数和平均血红蛋白量均显著低于HF 组(P< 0.05)。不同育肥模式对牦牛血液中红细胞平均体积、平均血红蛋白浓度、红细胞体积分布宽度、红细胞分布宽度、平均血小板体积、血小板分布宽度和血小板压积均无显著影响(P> 0.05)。
2.4 不同育肥模式对牦牛血清生化参数的影响
如表4 所列,不同育肥模式对牦牛血清生长激素、总蛋白、白蛋白、球蛋白、葡萄糖、β-羟基丁酸和甘油三酯含量均无显著影响(P> 0.05)。

表4 不同育肥模式对牦牛血清生化参数的影响Table 4 Effect of different fattening patterns on the serum biochemical parameters of yaks
2.5 不同育肥模式对牦牛血清抗氧化指标的影响
如表5 所列,NG 组牦牛血清中谷胱甘肽过氧化物酶活力显著高于HF 组(P< 0.01),而超氧化物歧化酶、丙二醛含量以及总抗氧化能力均不受育肥模式的影响(P> 0.05)。
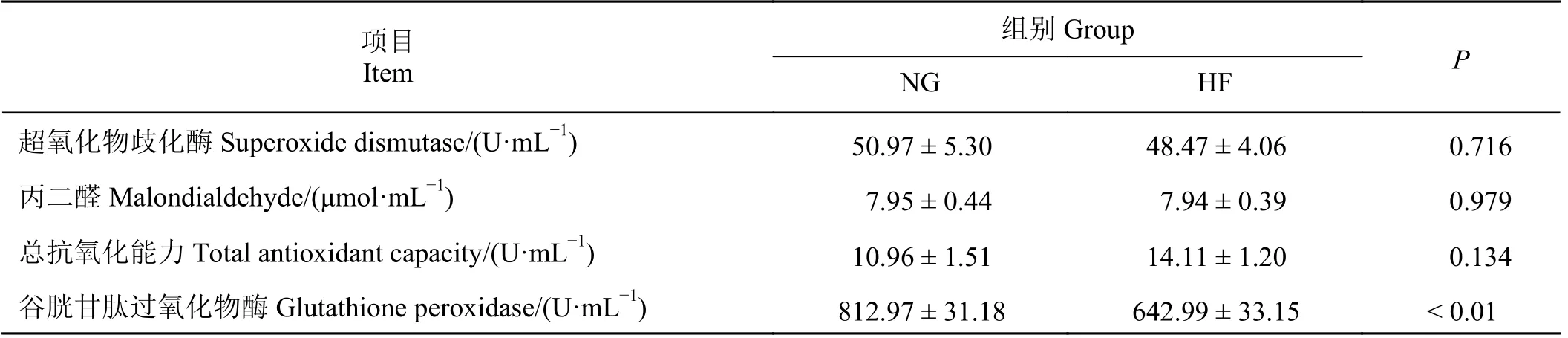
表5 不同育肥模式对牦牛血清抗氧化指标的影响Table 5 Effect of different fattening patterns on the serum antioxidant indexes of yaks
3 讨论
3.1 不同育肥模式对牦牛日增重的影响
最初牧草是反刍动物食物的唯一来源,后来随着人类知识体系的更新、科学技术水平的提高和生产方式的转变,反刍动物的饲养方式由单一的草原放牧逐渐向半舍饲和全舍饲的多元化饲养模式转变。研究表明,饲粮营养水平与家畜生长发育密切相关,是影响反刍动物体重、平均日增重以及料重比的重要因素[19-20]。与自然放牧相比,一方面舍饲育肥家畜的饲粮通常会添加玉米、大麦、豆粕等精料以提高其能量和蛋白质水平,进而增加动物的生产性能;另一方面,舍饲家畜的运动量更小,营养维持需要量更低,因而更多的营养物质可用于机体合成代谢。本研究中,舍饲组牦牛平均日增重显著高于放牧组,前者较后者提高了36%,相似的研究结果也在放牧与舍饲条件下的肉牛[21]、绵羊[22]和藏山羊[23]上有报道。郝力壮[24]研究发现,生长牦牛在青草期的日增重为380 g·d-1,与本研究中放牧组牦牛日增重接近(383 g·d-1);然而,舍饲组牦牛日增重差异较大,其变化范围在412~1 186 g·d-1[25-27],这可能是因为各研究中的饲粮营养水平不同。
3.2 不同育肥模式对牦牛瘤胃发酵参数的影响
pH 是直观反映反刍动物瘤胃发酵水平和健康状况的重要指标,主要受饲粮营养组成、挥发性脂肪酸产量、氨态氮浓度、唾液分泌量以及瘤胃食糜流速等因素的共同影响[28]。研究表明,当饲粮中精料比例逐渐增加,瘤胃pH 逐渐降低,而当pH 小于6.2 时,纤维降解菌的活性将会受到抑制[29]。本研究中,HF 添加了30%的精料,虽然pH 较NG 组小,但两组间差异不显著,且pH 均在6.2 以上,这说明试验牦牛均具有良好的瘤胃发酵状况。氨态氮是瘤胃微生物合成菌体蛋白的重要氮源之一[30],其含量主要受饲粮中蛋白质和非蛋白氮水平以及机体尿素循环效率的影响[31]。据报道,适合瘤胃微生物生长的最佳氨态氮浓度为6~30 mg·dL-1[32]。本研究中,氨态氮浓度分别是6.54 (放牧) 和7.20 mg·dL-1(舍饲),均在上述最佳范围之内。
挥发性脂肪酸是反刍动物重要的能量来源,占机体能量需求的70%~80%[33]。饲粮中的碳水化合物在瘤胃微生物的作用下被降解为挥发性脂肪酸,其中乙酸、丙酸和丁酸是挥发性脂肪酸的主要组成成分,占总挥发性脂肪酸的95% 以上[34]。由此可见,饲粮结构、营养水平、采食量和瘤胃微生物区系是影响挥发性脂肪酸产量的重要影响因素[35]。本研究中,舍饲组牦牛瘤胃液总挥发性脂肪酸、乙酸、丙酸和丁酸浓度均显著高于放牧组,这可能是两个试验组的饲粮组成不同所引起。舍饲组牦牛的饲粮由30%的精料和70%的燕麦青干草所组成,精料中可发酵碳水化合物含量较高,其也比牧草更易被微生物所发酵,且燕麦青干草与天然草原混合牧草养分含量相当[36-37],所以HF 组牦牛瘤胃液挥发性脂肪酸浓度高于NG 组。丙酸是葡萄糖合成的前提物质,是反刍动物糖异生的主要来源[27];同时乙酸和丁酸也是动物机体氧化供能的重要能源物质。本研究中,HF 组较NG 组具有更高的乙酸、丙酸和丁酸浓度,这与牦牛日增重数据相符。研究发现,当饲粮中精料比例增加时,丙酸型发酵模式得到增强,从而引起乙酸/丙算下降[38]。然而,本研究中NG 组的乙酸/丙酸低于HF 组,其原因可能是:1) NG 组牧草鲜嫩多汁,富含可溶性糖、维生素和其他生物活性物质,且较燕麦干草具有更低的纤维含量;2) HF组的精料含量较低,仅为30%。最新的文献也表明,牦牛在采食天然牧草时较采食燕麦干草时具有更低的乙酸/丙酸(4.56 和4.72)[39]。异丁酸和异戊酸均属于支链脂肪酸,其是支链氨基酸在微生物作用下经氢化脱氨基或脱羧基后的产物[40]。本研究中,NG 组牦牛瘤胃液中异丁酸和异戊酸浓度显著高于舍饲组,这表明天然牧草中可能存在丰富的瘤胃可降解蛋白。
3.3 不同育肥模式对牦牛血液生理生化指标的影响
血液是动物机体内环境的重要组成部分,可直接反映机体的新陈代谢与生理活动以及健康状况。白细胞是血液中无色有核血细胞的总称,包括单核细胞、中性粒细胞、嗜酸性粒细胞和淋巴细胞,其在机体损伤治愈、抵御病原体入侵和疾病的免疫方面起重要作用[41-42]。研究发现,牦牛在发生免疫应激反应时其血液中的白细胞数会急剧升高[43];本研究中,HF 组牦牛的血液白细胞数显著高于NG 组,这与蒙成志等[44]在放牧与舍饲绒山羊上所报道的研究结果相一致。这表明,与自然放牧组相比,舍饲组动物可能更容易受到某些应激而发生机体免疫应答反应,进而导致其血液白细胞数量的增加。血液中红细胞数、血红蛋白、红细胞压积可反映机体运输氧气和二氧化碳的能力[45],而牛血液中红细胞数、血红蛋白和红细胞压积的正常范围分别为(5 × 1012~10 × 1012)个·L-1、80~150 g·L-1和20%~40%[46]。在本研究中,NG 和HF 组牦牛的红细胞数、血红蛋白和红细胞压积浓度分别为5.32 × 1012和7.58 × 1012个· L-1、99.50 和127.83 g·L-1、29.55%和38.18%,均在上述正常范围之内。然而,NG 组牦牛的红细胞数、血红蛋白和红细胞压积均显著高于HF 组牦牛,这可能与放牧牦牛更高的活动量有关,因为在运动过程中机体需要消耗更多的氧气,加快血液循环速率,从而刺激血液中红细胞的生成[47]。血小板是哺乳动物血液中的有形成分之一,其在凝血功能中发挥重要作用,同时与机体抗寒能力密切相关[48]。研究发现,大鼠在经受寒冷刺激以后,其血液中的血小板数量及其凝聚率都会显著增加[49]。在青藏高原地区,即使在暖季,其户外早晚气温也相对较低,放牧家畜容易发生寒冷应激现象,而圈舍内的气温相对保持稳定。因此,NG 组牦牛可能是受到了寒冷刺激而引起血液中血小板数量的增加。
葡萄糖是反刍动物重要的供能物质之一,而血糖浓度可反映机体的能量稳态。当饲粮能量供应不足时,血液葡萄糖浓度会随之降低[50];然而,由于受到激素的调控作用,血糖浓度一般维持在一定的正常范围内[51]。本研究中,NG 和HF 组牦牛的血糖浓度分别是4.19 和4.32 mmol·L-1,均在生长期牦牛血糖的正常数值范围内(3.9~5.3 mmol·L-1)[52]。血液中β-羟基丁酸可用于评估反刍动物能量盈亏状态,其浓度会因机体脂肪酸氧化和酮体积累而增加[53]。一般认为,当β-羟基丁酸浓度大于1.0 mmol·L-1时,动物机体已经处于能量负平衡状态[54]。本研究中,NG 和HF 组牦牛的血液β-羟基丁酸浓度分别为317.67 和329.41 μmol·L-1,且组间无差异,这说明试验牦牛的能量摄入水平相对充足。总蛋白由白蛋白和球蛋白两部分组成,是血清固体成分中最多的一类物质,其可间接反映动物机体的蛋白质营养状况,亦可用于判断肝脏的蛋白质合成功能和肾脏的滤过作用[55]。另外,球蛋白与动物机体的免疫功能密切相关[56]。本研究中,血清总蛋白、白蛋白和球蛋白含量均在正常范围之内[57],且组间无差异,这说明试验牦牛蛋白质营养代谢状况良好。
3.4 不同育肥模式对牦牛血清抗氧化指标的影响
动物体内的氧化还原系统若失衡则会增加发生疾病的风险。谷胱甘肽过氧化物酶是一种可以清除自由基的抗氧化酶,其能够使有氧代谢的细胞免受自由基损害,也能为被氧化的细胞膜提供修复机制[58]。本研究中,NG 组牦牛血液的谷胱甘肽过氧化物酶活性显著高于HF 组,这与蒙成志[59]在山羊上的研究结果一致。其原因可能是:与舍饲相比,放牧动物由于需要觅食而具有更大的运动量,而运动时自由基的生成会增加,这时机体需要通过刺激清除自由基酶(谷胱甘肽过氧化物酶、超氧化物歧化酶、过氧化氢酶等)的增加或者提高非酶系的利用率,以使自由基的产生和清除达到平衡状态[60-61]。另外,研究发现,高寒植物中含有非常丰富的酚类、多不饱和脂肪酸和维生素等生物活性物质,而这些物质与动物机体抗氧化作用密切相关[62]。因此,NG 组牦牛血液中更高的谷胱甘肽过氧化物酶活性可能与其采食富含抗氧化活性物质的天然牧草有关。
4 结论
与传统放牧模式相比,短期舍饲育肥可以改善牦牛瘤胃发酵功能,提高其日增重,具有更高的生产效率和肥育效果;然而,放牧牦牛在血液学方面表现出更高的携氧与抗氧化能力,表明其对高原环境具有更好的适应能力。
