叶面喷施植物生长调节剂对紫花苜蓿内源激素及碳代谢的调控效应
2024-03-28李浩天隋晓青王鑫尧
李浩天,隋晓青,杨 静,王鑫尧
(新疆农业大学草业学院, 新疆 乌鲁木齐 830052)
紫花苜蓿(Medicago sativa)为豆科苜蓿属多年生草本植物,是我国人工种植面积最大的草种,素有“牧草之王”之称[1-2]。紫花苜蓿花期较长且具有无限开花的习性,由于其自身的生物学特性,只有一部分花最终能够发育为成熟的荚果,目前在大田生产中易因花序大量发育和开放而消耗大量营养,导致坐果率低,甚至出现不结果的情况[3]。因此,如何有效地降低苜蓿大田生产中由于花荚脱落而带来的损失,成为当前生产中亟需解决的一个重要问题。
植物生长调节剂(plant growth regulators,PGRs)是一种由人工合成的对植物生长发育具有调节作用的化学物质,可作为植物内源激素合成与代谢的重要外源信号物质[4],施用调节剂调控已广泛应用于作物增产的研究[5-6],不同生长调节剂在调节植物开花时间、花的形成及果实的发育中发挥着不同的作用[7]。植物激素作为信息传递物质,在植物的生长发育过程中具有重要的调控作用,生长调节剂能够影响植物内源激素的含量,在生长发育的各个时期维持内源激素的动态平衡,以保障作物的丰产[8]。增强源-库关系是包括紫花苜蓿在内所有作物高产的基础,源器官产生的碳同化物向库器官的运输及分配效率最终影响产量高低[9]。已有研究发现,生长调节剂可以增加源器官光合产物的输出和库器官碳同化物的输入,进而促进作物库器官的生长和发育[10-11]。烯效唑(uniconazole,S-3307) 是一种高效、低毒、低残留、低污染的新型植物生长延缓剂,具有控制营养生长,抑制细胞伸长、缩短节间、矮化植株,促进侧芽生长和花芽形成,可以明显增加花芽形成百分率,加速花芽分化的进程。胺鲜酯(diethyl aminoethyl hexanoate,DA-6) 是一种促进剂,可以提高光合效率,促进光合产物合成积累,促进碳代谢,能够有效调控源库系统碳水化合物代谢平衡,实现增产提质。
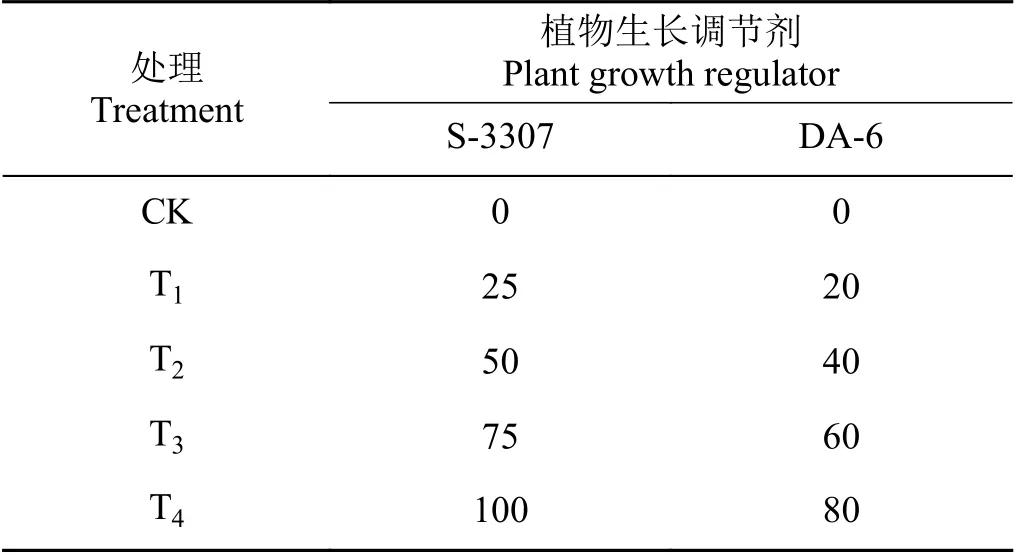
表1 S-3307 和DA-6 处理浓度Table 1 Treatment concentrations of S-3307 and DA-6
目前关于S-3307 和DA-6 调控紫花苜蓿开花后内源激素含量及碳同化物代谢动态变化的研究还鲜见报道。本研究通过喷施S-3307 和DA-6 处理,探讨外源调控措施对紫花苜蓿花后内源激素、碳同化物动态平衡及对脱落的影响,旨在为紫花苜蓿花荚脱落生理机制的研究以及丰产稳产栽培提供一定的理论依据。
1 材料与方法
1.1 材料与处理
试验材料选取紫花苜蓿品种‘新牧4 号’,由新疆农业大学草业学院提供。植物生长调节剂选用S-3307 和DA-6,均购于上海源叶生物科技有限公司。
以叶面喷施S3307、DA-6 为处理,以喷施清水为对照(CK),每个处理3 次重复,各小区喷施时均采用挡板遮挡处理,喷施浓度如表1 所列。试验小区采用随机区组排列,小区面积3 m × 2 m,播种行距为60 cm,株距为20 cm,每穴3~4 粒种子。喷施时期为初花期,喷施溶液量为200 mL·m-2。每小区于晴朗、无风、阳光不强烈的早晨09:30 之前人工手持式喷壶喷施。
1.2 试验地概况
大田试验于2022 年在新疆农业大学三坪农场草业综合试验站(87°21′13″ E,43°56′58″ N)进行。该站年均温7.20 ℃,年均降水量229 mm,土壤类型多为黄板土、灰黄土和白板土,试验地土壤为灰漠土。试验地土壤pH 为7.1,碱解氮含量为45.14 mg·kg-1,速效磷含量为13.3 mg·kg-1,速效钾含量为188 mg·kg-1,有机质含量为14.6 g·kg-1。
1.3 测定内容及方法
初花期喷施调节剂后,于第3 天开始取样。
农艺性状:1) 花荚脱落数的统计,脱落花荚采用倒置网袋法定期收集,调查植株上花荚和脱落花荚数目并做记录。收集后统一计算花荚脱落率。2)小花数/花序,在取样行内随机选取30 个生殖枝,在已选取的30 个生殖枝的不同部位随机选取30 个花序,统计小花数/花序。3)结荚数/花序,测定过程在种子成熟期完成,在取样行内随机选取30 株紫花苜蓿,分别对植株的所有花序及其对应的结荚数进行统计。
内源激素与碳代谢:处理组和对照组分别采集叶片、小花,采集后将样品在液氮中速冻30 min,取出保存于-80 ℃超低温冰柜中,用于内源激素、碳代谢指标的测定(各指标均进行3 次生物学重复)。脱落酸(abscisic acid,ABA)、赤霉素(gibberellen,GA3)及玉米素核甘(zeatin riboside,ZR)均采用酶联免疫法(ELISA)测定,试剂盒由诺敏科达(武汉)生物科技有限公司提供。可溶性糖、淀粉和蔗糖采用生化法进行测定,具体操作参考敏科达(武汉)生物科技有限公司提供的试剂盒说明书。
1.4 数据分析
利用Excel 2021 进行数据整理,SPSS 26.0 对数据进行单因素方差分析(one way-ANOVA),GraphPad Prism 9.5 绘制图形。
2 结果与分析
2.1 S-3307 和DA-6 对紫花苜蓿花荚脱落的影响
2.1.1 S-3307 和DA-6 对紫花苜蓿小花数的影响
初花期喷施PGRs 对紫花苜蓿小花数的影响情况表明,喷施S-3307 处理,紫花苜蓿小花数较对照呈现出“低浓度促进高浓度抑制”的趋势(图1),75 mg·L-1S-3307 处理,紫花苜蓿小花数达到最大,显著高于对照(P< 0.05),100 mg·L-1S-3307 处理,紫花苜蓿小花数降到最低,但与对照差异并不显著(P>0.05);不同浓度的DA-6 处理,与S-3307 处理不同,紫花苜蓿小花数较对照呈先上升后下降趋势,但均高于对照,但仅高浓度(60、80 mg·L-1)处理与对照差异显著(P< 0.05),60 mg·L-1DA-6 处理下紫花苜蓿小花数达到最大。
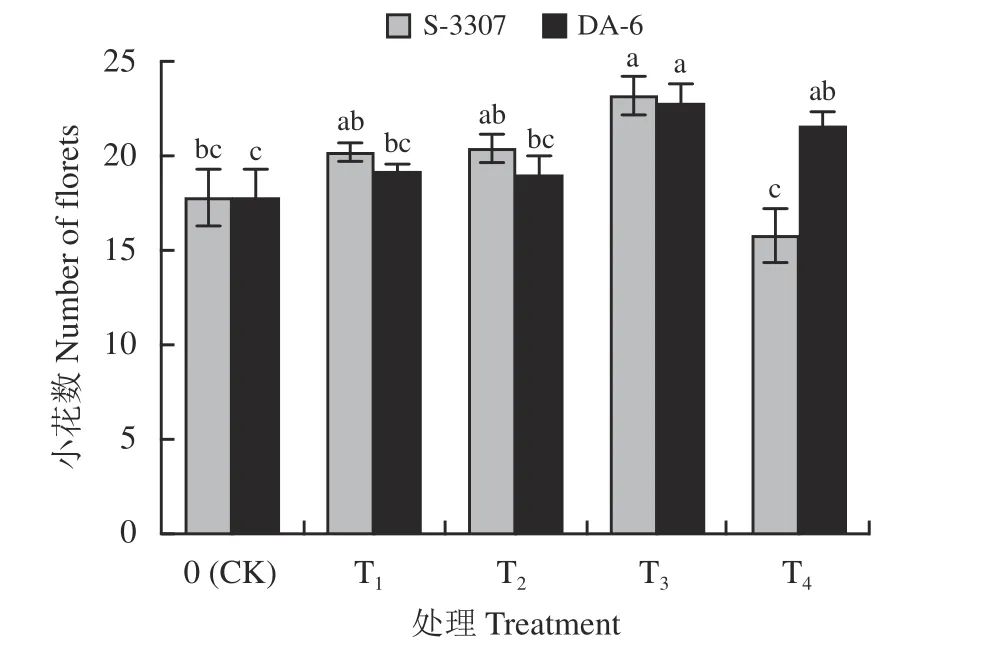
图1 初花期喷施不同调节剂对紫花苜蓿植株小花数的影响Figure 1 Effect of spraying different regulators on the number of florets in alfalfa plants during early blooming
综上,初花期喷施75 mg·L-1以下S-3307 和较高浓度的DA-6 均可有效提高紫花苜蓿小花数。
2.1.2 S-3307 和DA-6 对紫花苜蓿结荚数的影响
如图2 所示,喷施不同浓度的S-3307 处理间差异明显,25、50 mg·L-1处理虽提高紫花苜蓿结荚数,但与对照差异不显著(P> 0.05),75 mg·L-1处理紫花苜蓿结荚数达最大值且与对照差异显著(P<0.05),100 mg·L-1结荚数较对照下降,但并无显著差异;随着喷施DA-6 浓度的增加,紫花苜蓿结荚数呈现出整体上升的趋势,较低浓度DA-6 处理(20、40 mg·L-1)虽能提高紫花苜蓿结荚数,但与对照无显著差异,喷施高浓度(60、80 mg·L-1)均可显著增加紫花苜蓿结荚数,其中以60 mg·L-1表现最佳。
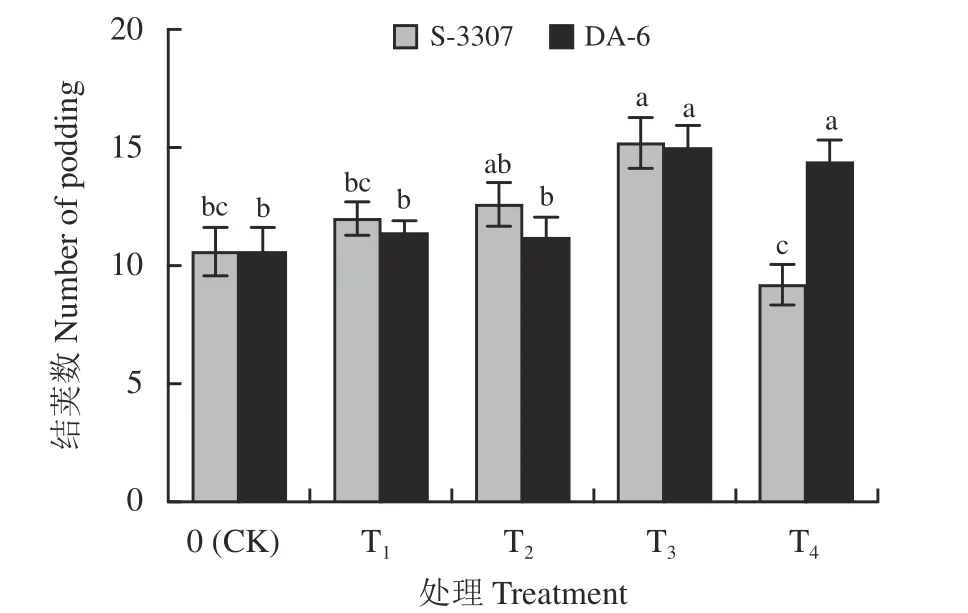
图2 初花期喷施不同调节剂对紫花苜蓿植株结荚数的影响Figure 2 Effect of spraying different regulators on the number of pods in alfalfa plants during early blooming
综上,初花期喷施75 mg·L-1以下S-3307 和较高浓度的DA-6 均可有效提高紫花苜蓿结荚数。
2.1.3 S-3307 和DA-6 对紫花苜蓿花荚脱落率的影响
喷施S-3307 处理与对照相比,紫花苜蓿花荚脱落率呈先升高后降低再升高趋势(图3),25 mg·L-1处理可提高紫花苜蓿花荚脱落率,50 mg·L-1处理较对照脱落率降低,但与对照间均无显著性差异(P>0.05),喷施75 mg·L-1紫花苜蓿花荚脱落率最小,与对照差异显著(P< 0.05);喷施DA-6 处理结果与S-3307不同,随着喷施浓度的增加,紫花苜蓿花荚脱落率呈先降低后升高的趋势,但均低于对照。20 mg·L-1处理花荚花荚脱落率与对照无显著差异,其他喷施浓度均可显著降低脱落率,其中60 mg·L-1处理紫花苜蓿花荚脱落率最小。
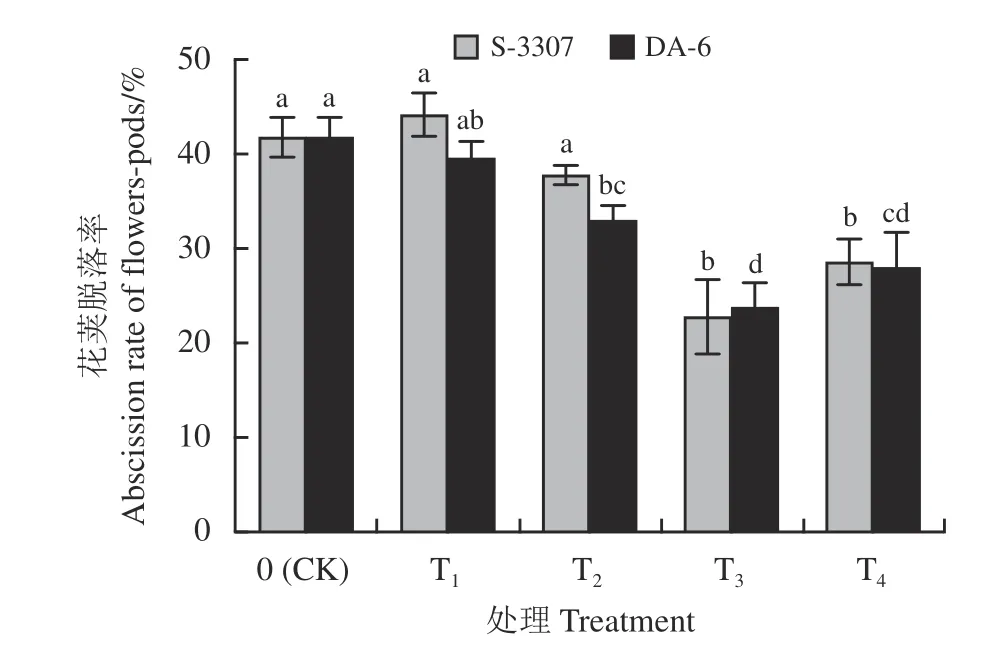
图3 初花期喷施不同调节剂对紫花苜蓿花荚脱落的影响Figure 3 Effect of spraying different regulators on the abscission rate of flowers/pods in alfalfa during early blooming
综上,初花期喷施较高浓度S-3307、DA-6 均可降低紫花苜蓿花荚脱落率,以喷施75 mg·L-1S-3307和60 mg·L-1DA-6 表现最佳。
2.2 S-3307 和DA-6 对紫花苜蓿内源激素含量的影响
2.2.1 紫花苜蓿内源脱落酸含量变化
初花期喷施S-3307,随着处理浓度的增加,叶片内源ABA 含量呈现出逐渐上升的趋势(图4),100 mg·L-1S-3307 处理,叶片内源ABA 含量达到最大,显著高于对照(P< 0.05);小花内源ABA 含量变化跟叶片类似,随着处理浓度的增加,小花内源ABA 含量呈现出逐渐上升的趋势,100 mg·L-1的S-3307 处理,小花内源ABA 含量达到最大,显著高于对照。
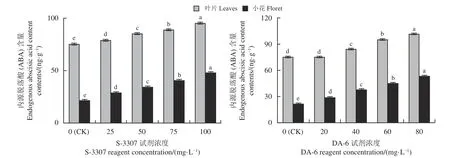
图4 初花期喷施不同调节剂对紫花苜蓿内源脱落酸含量的影响Figure 4 Effect of spraying different regulators on the endogenous abscisic acid content of alfalfa during early blooming
随初花期喷施DA-6 浓度的增加,叶片内源ABA 含量整体呈现出上升的趋势(图4),20 mg·L-1DA-6 处理,叶片内源ABA 含量与对照无显著差异(P> 0.05),80 mg·L-1DA-6 处理,内源ABA 含量达到最大,显著高于对照(P< 0.05);不同浓度的DA-6 处理,小花内源ABA 含量整体呈现出上升的趋势,80 mg·L-1的DA-6 处理下,内源ABA 含量达到最大,显著高于对照。
2.2.2 紫花苜蓿内源玉米素核甘含量变化
如图5 所示,喷施S-3307 处理,叶片内源ZR 含量差异显著(P< 0.05),随喷施浓度的增加紫花苜蓿叶片内源ZR 含量呈现出逐渐上升的趋势,100 mg·L-1S-3307 处理下,叶片内源ZR 含量达到最大,显著高于对照;小花内源ZR 含量与叶片内源ZR 含量变化趋势相同,呈逐渐上升的趋势,在100 mg·L-1时达最大,与对照差异显著。

图5 初花期喷施不同调节剂对紫花苜蓿内源玉米素核苷含量的影响Figure 5 Effect of spraying different regulators on the endogenous zeatin riboside content of alfalfa during early blooming
不同浓度的DA-6 处理,与S-3307 处理类似,叶片内源ZR 含量呈逐渐上升的趋势(图5),80 mg·L-1DA-6 处理叶片内源ZR 含量达最大,与对照差异显著(P< 0.05);小花内源ZR 含量与叶片变化一致,随DA-6 浓度增加呈现出逐渐上升的趋势,在80 mg·L-1时达到最大值,显著高于对照。
2.2.3 紫花苜蓿内源赤霉素含量变化
如图6 所示,随喷施S-3307 浓度增加,紫花苜蓿叶片内源GA3含量变化呈现出逐渐上升的趋势,在100 mg·L-1S-3307 处理下达到最大值,显著高于对照(P< 0.05);小花内源GA3含量变化与叶片内源GA3含量变化类似,随着喷施浓度的增加,紫花苜蓿小花内源GA3含量变化呈现出逐渐上升的趋势,在100 mg·L-1S-3307 处理下达到最大值,显著高于对照。
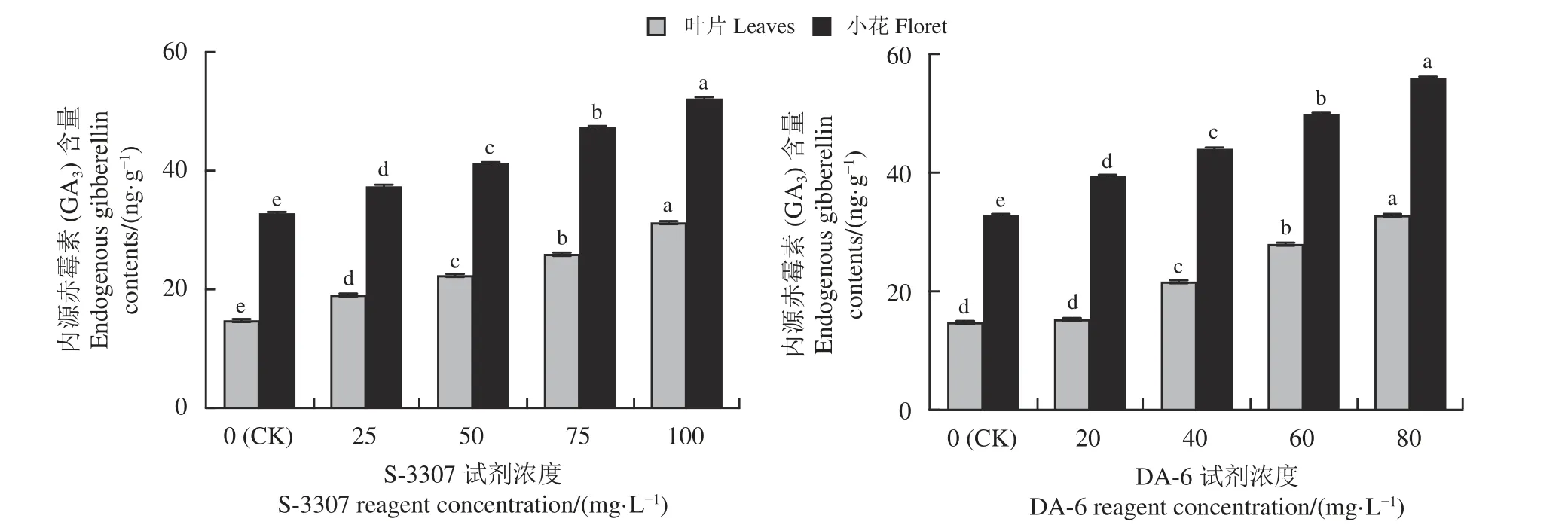
图6 初花期喷施不同调节剂对紫花苜蓿内源赤霉素含量的影响Figure 6 Effect of spraying different regulators on the endogenous gibberellin content of alfalfa during early blooming
不同浓度的DA-6 处理,叶片与小花内源GA3含量变化趋势相似(图6),随着喷施浓度的增加,叶片内源GA3含量呈逐渐上升的趋势,20 mg·L-1DA-6处理叶片内源GA3含量与对照差异不显著(P> 0.05),80 mg·L-1DA-6 处理叶片内源GA3含量达最大值,与对照差异显著(P< 0.05);小花内源GA3含量变化也呈现出逐渐上升的趋势,在80 mg·L-1DA-6 处理下,小花内源GA3含量达到最大值,显著高于对照。
2.3 S-3307 和DA-6 对紫花苜蓿碳同化代谢的影响
2.3.1 紫花苜蓿可溶性糖含量的变化
如图7 所示,喷施S-3307 处理,叶片可溶性糖含量变化趋势与小花可溶性糖含量变化趋势一致。随S-3307 浓度增加紫花苜蓿叶片可溶性糖含量变化呈现出逐渐上升的趋势,100 mg·L-1S-3307 处理下叶片可溶性糖含量达到最大值,显著高于对照(P<0.05);小花可溶性糖含量随着喷施浓度增加呈现出逐渐上升的趋势,在100 mg·L-1S-3307 处理下达到最大值,显著高于对照。
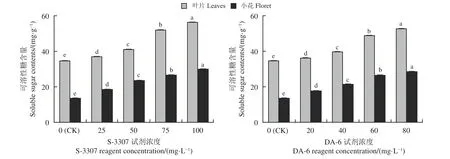
图7 初花期喷施不同调节剂对紫花苜蓿可溶性糖含量的影响Figure 7 Effect of different regulators on the soluble sugar content of alfalfa by spraying during early blooming
随DA-6 浓度增加,叶片可溶性糖含量较对照呈现出逐渐上升的趋势,在80 mg·L-1DA-6 处理下达最大值,较对照差异显著(P< 0.05);小花可溶性糖含量也呈现出逐渐上升的趋势,在80 mg·L-1DA-6处理下达最大值,较对照差异显著。
2.3.2 紫花苜蓿淀粉含量的变化
如图8 所示,喷施S-3307 处理,叶片和小花淀粉含量变化趋势一致,变化均呈现出逐渐上升的趋势,且显著高于对照(P< 0.05),100 mg·L-1S-3307 处理下淀粉含量达到最大值。
随DA-6 浓度增加,紫花苜蓿叶片淀粉含量变化呈现出逐渐上升的趋势,浓度越高,增长量越快,在80 mg·L-1DA-6 处理下达到最大值,较对照差异显著(P< 0.05);紫花苜蓿小花淀粉含量呈现出先下降后上升的趋势,较高浓度处理,小花淀粉含量增长变快,20 mg·L-1DA-6 处理,小花淀粉含量最小,80 mg·L-1DA-6 处理,小花淀粉含量达最大值,较对照差异显著。
2.3.3 紫花苜蓿蔗糖含量的变化
如图9 所示,喷施S-3307 处理,紫花苜蓿叶片蔗糖含量变化呈现出先上升后下降的趋势,但含量均高于对照,75 mg·L-1S-3307 处理,叶片蔗糖含量达到最大值,与对照差异显著(P< 0.05);小花蔗糖含量与叶片蔗糖含量变化趋势差异较大,呈现出“先降低后上升再降低”的趋势,与对照未表现出显著差异(P> 0.05),25 mg·L-1S-3307 处理,小花蔗糖最小,75 mg·L-1S-3307 处理,小花蔗糖含量达到最大值。

图9 初花期喷施不同调节剂对紫花苜蓿蔗糖含量的影响Figure 9 Effect of different regulators on the sucrose content of alfalfa by spraying during early blooming
随DA-6 处理浓度增加,紫花苜蓿叶片蔗糖含量呈现出“W”变化(图9),且均低于对照,但与对照无显著差异(P> 0.05);小花蔗糖含量变化与叶片相类似,随着喷施DA-6 浓度的增加,紫花苜蓿小花蔗糖含量变化整体表现为下降趋势,20 mg·L-1DA-6 处理,小花蔗糖含量最小,与对照差异显著(P< 0.05)。
2.4 紫花苜蓿内源激素与碳同化物相关关系分析
2.4.1 紫花苜蓿内源ABA 与淀粉和可溶性糖含量相关关系分析
如图10 所示,叶片内源ABA 含量变化与淀粉含量极显著正相关(P< 0.01),与可溶性糖含量极显著正相关(P< 0.01)。
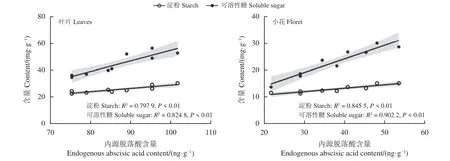
图10 初花期紫花苜蓿内源脱落酸与淀粉、可溶性糖含量的相关性Figure 10 Correlation between endogenous abscisic acid and starch and soluble sugar content in alfalfa during early blooming
小花内源ABA 含量变化与淀粉含量极显著相关(P< 0.01)与可溶性糖含量呈极显著正相关(P<0.01)。
2.4.2 紫花苜蓿内源ZR 与淀粉和可溶性糖含量相关关系分析
如图11 所示,叶片内源ZR 含量变化与淀粉含量表现出极显著正相关(P< 0.01),与可溶性糖含量极显著正相关(P< 0.01)。
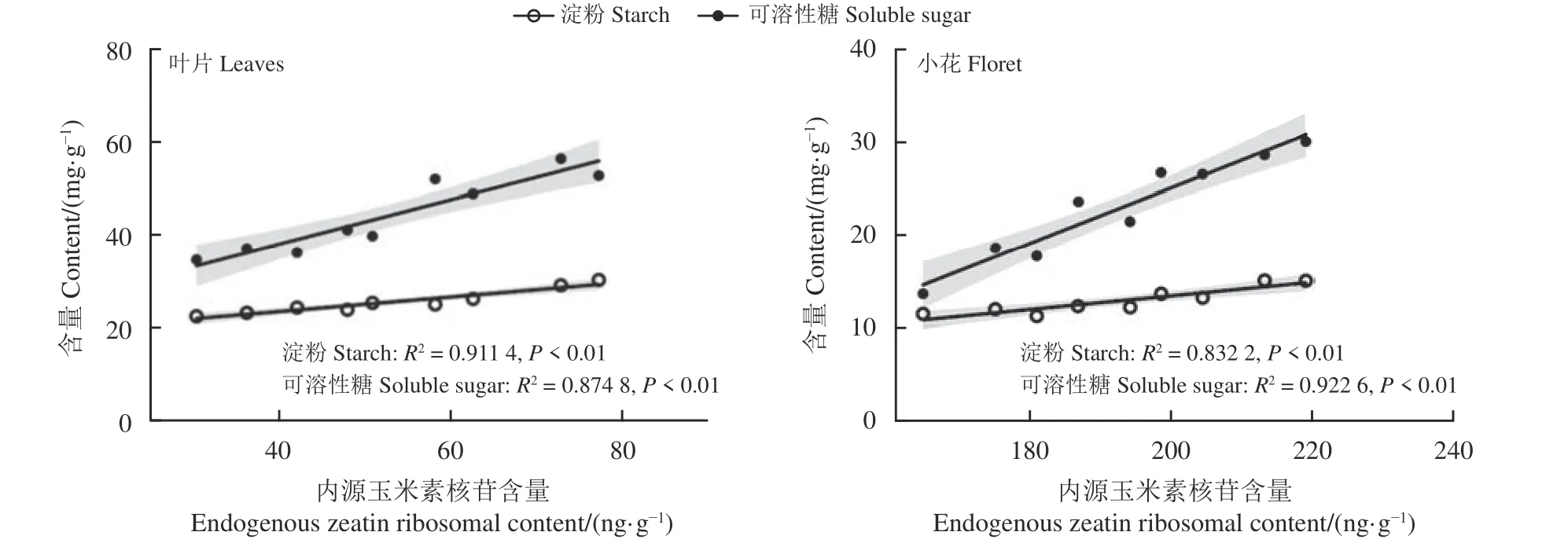
图11 初花期紫花苜蓿内源玉米素核苷与淀粉、可溶性糖含量的相关性Figure 11 Correlation between endogenous zeatin ribosomal, starch, and soluble sugar content in alfalfa during early blooming
小花内源ZR 含量变化与淀粉含量及可溶性糖含量均极显著正相关(P< 0.01) (图11)。
2.4.3 紫花苜蓿内源激素与碳同化物间相关关系分析
如图12 所示,初花期叶片内源激素间具有较大的相关性( + ),内源激素与淀粉、可溶性糖具有较大的相关性( + ),与蔗糖相关性并不显著。小花内源激素间同样表现出显著相关性,内源激素与淀粉、可溶性糖具有较大的相关性( + ),与蔗糖未表现出显著相关性。
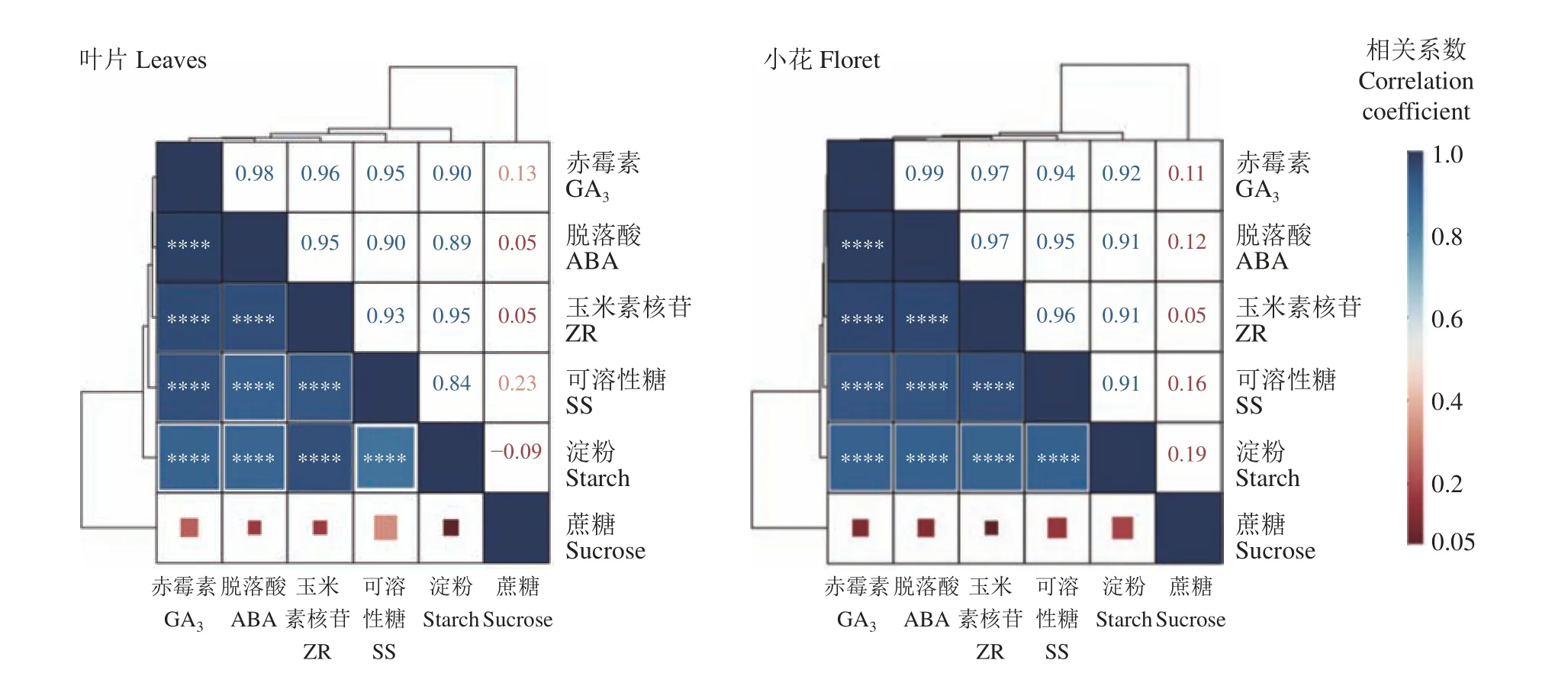
图12 初花期紫花苜蓿内源激素与碳同化物的相关性Figure 12 Correlation between endogenous hormones and carbon assimilates in alfalfa during early blooming
3 讨论
3.1 S-3307 和DA-6 处理对紫花苜蓿内源激素的影响
植物激素通过参与植物细胞的分裂与分化过程影响植物的生长发育,内源激素系统是影响叶片生长、发育和生理功能提高的主要内在原因[12],有研究表明细胞分裂素(cytokinin,CTK) 可以显著延缓叶片衰老,并可能作为一种引导同化物转运的重要信号,诱导营养物向其移动,维持或改变植物源库关系[13];赵春江等[14]研究发现,CTK 及GA3均可以抑制衰老,而ABA 具有明显促进衰老作用;El-Saeid等[15]研究发现喷施生长素(Indole-3-acetic acid,IAA)可提高豇豆(Vigna unguiculata)内源激素的含量,从而减少小花的脱落,进而提高坐果率;王廷芹和杨暹[16]在青花菜(Brassica oleracea)上的研究发现,喷施油菜素内酯可调控其体内IAA 和GA3含量,进而影响青花菜的花芽分化过程及花球的形成;叶面喷施多效唑,可以提高荔枝(Litchi chinensis)体内ABA、ZR 含量,降低GA3、IAA 含量,从而促进 ‘妃子笑’荔枝花芽分化和孕育[17];喷施矮壮素,可以促进葡萄(Vitis vinifera)枝条生长发育内ABA 和 ZR 的增加,控制葡萄的营养生长,从而促进其花芽发育[18]。本研究结果表明,S-3307、DA-6 处理均不同程度地提高了叶片及小花的ABA、ZR 和GA3含量,促进了叶片碳同化物的积累,进一步促进叶片的生长,延长叶片功能性,有效延缓叶片的衰老,在一定程度上提高制造光合产物的“源器官”的强度,从而更好地为“库器官”输入碳同化物,同时加强紫花苜蓿花芽分化的能力,可见,S-3307、DA-6 对紫花苜蓿生长发育的调控作用与其对内源激素水平的调控有关,但其中具体的调节机制尚需进一步探究。
3.2 S-3307 和DA-6 处理对紫花苜蓿碳同化物代谢的影响
碳代谢是植物体内有机物质合成、转化和降解的代谢过程,其代谢强度在植物生长发育过程中的动态变化直接影响光合产物形成、运输及营养的吸收[19]。想要获得高产不仅要求“源器官”(叶片)利用光能的效率高,“库器官”(小花) 接受同化物的量大,更要求源器官分配同化物质的能力强,紫花苜蓿源-流-库关系协调即为其获得高产的关键。叶片中的可溶性糖、蔗糖和淀粉是植物体内主要的碳水化合物, 在植株代谢过程中起着重要的作用[20]。大量研究均表明,喷施植物生长调节剂对植物碳代谢过程具有调控作用[21],开花之前植物各器官的有机物累积较为缓慢,开花期过程中则大量增加可溶性糖的积累量,之后淀粉含量也开始迅速积累[22]。不同浓度的DA-6 浸种能有效调控糜子(Panicummiliaceum)的光合特性,提高叶片蔗糖含量,使其健壮生长[23];齐德强等[24]研究发现,喷施S-3307 和DA-6 可以增加马铃薯(Solanum tuberosum)前期叶片内淀粉和蔗糖的含量,促进叶片中淀粉含量向茎中转运,促进了源器官的物质输出,显著提高马铃薯产量;孙福东等[25]在大豆(Glycine max)上的研究表明,叶面喷施S-3307 和 DA-6 可有效促进植株地上各器官物质积累,促进同化物向库器官籽粒运输,从而实现增产;Liu 等[10]研究认为,S-3307 和DA-6 有效调控源库系统碳水化合物代谢平衡。本研究结果表明,喷施调节剂对叶片中碳同化物的积累起到重要作用,显著促进 “源器官” 叶片的物质积累,同时加强“源器官”向“库器官”输入的能力,即小花碳同化物积累能力显著加强,S-3307、DA-6 处理叶片和小花淀粉、可溶性糖含量表现为有效增加,S-3307 处理叶片和小花蔗糖含量总体上表现为有效增加,DA-6 处理叶片蔗糖含量未与对照表现出差异,小花蔗糖含量较对照表现为下降的状态,这一结果与前人使用调节剂普遍提增加蔗糖含量的结果并不完全一致,分析认为这可能与年际差异有关。本研究中只针对紫花苜蓿的部分碳同化产物进行了分析,S-3307、DA-6 对紫花苜蓿生理活性的调控, 可能还受植株体内其他信号转导和相关基因的调控,其机理还有待进一步研究。
4 结论
初花期喷施S-3307、DA-6 可增加紫花苜蓿的小花数和结荚数,同时降低紫花苜蓿花荚脱落率,两种植物生长调节剂均不同程度地提高了紫花苜蓿叶片及小花内源ABA、ZR 和GA3含量,同时可有效增加紫花苜蓿叶片及小花中可溶性糖、淀粉的含量,与对照相比,S-3307 可提高叶片蔗糖含量,有利于改善源库关系。两种植物生长调节剂均有效的调控了紫花苜蓿碳同化产物合成、运输和转化,即“源”(叶片)和“库”(小花)之间的协调。结合本研究结果,喷施75 mg·L-1S-3307 效果最佳,60 mg·L-1DA-6 次之。
