裙带菜多糖羧甲基化修饰及降血糖活性
2024-03-28李灿张慧慧刘会平张欣马笑笑王兵刘盈张晓晶
李灿,张慧慧,刘会平,张欣,马笑笑,王兵,刘盈,张晓晶
(天津科技大学 食品科学与工程学院,天津 300457)
近年来,糖尿病的发病率急剧增加,其中约90%患者被诊断为Ⅱ型糖尿病,成为全球威胁人类健康的第三大常见疾病[1]。目前用于糖尿病治疗的降糖药物都有一些副作用,如引起心血管疾病、胃肠道问题等,可能会对身体产生严重影响[2-3]。海藻一直被认为是生物活性多糖的天然来源,具有降血糖、抗血栓、抗病毒、抗炎等作用,近几年已逐渐成为研究热点[4-5]。裙带菜是一种生长在温暖海湾中的可食用海藻,具有优良的食用和药用价值。裙带菜以其优越的营养价值和丰富的活性成分被广泛熟知,褐藻糖胶是裙带菜中重要的活性成分之一[6]。
通过化学改性开发新型多糖衍生物是一个研究热点,如羧甲基化被认为是引入官能团和提高多糖生物活性的有效手段,该反应的主要优点是易于加工,化学试剂成本低,产物无毒[7]。刘贵珍等[8]对罗汉果多糖的羧甲基化修饰条件进行优化并研究其体外降血糖能力,发现羧甲基化罗汉果多糖对α-淀粉酶的抑制作用有所增强。李雪晖等[9]对南瓜多糖的羧甲基化修饰条件进行优化并研究其体外降血糖能力,发现羧甲基化南瓜多糖对α-葡萄糖苷酶的抑制作用有所增强。目前,关于裙带菜的羧甲基化修饰方面的研究鲜见报道。田数等[10]通过提取裙带菜多糖并对其进行羧甲基化修饰和抗氧化活性研究,但并未对多糖的修饰工艺进行优化。
为优化裙带菜多糖的羧甲基化修饰条件,本研究通过红外光谱扫描、热重分析、X-射线衍射试验对两种多糖进行初步结构表征,并以两种多糖对α-淀粉酶和α-葡萄糖苷酶的抑制作用来评估裙带菜多糖及羧甲基化产物的体外降血糖活性,以期为开发潜在的天然口服降糖剂或功能性食品提供科学依据。
1 材料与方法
1.1 材料和试剂
裙带菜叶片:大连龙海胜水产有限公司。纤维素DE-52、Sephadex G-100:瑞达恒辉公司;500 Da 透析袋、葡萄糖标准品、牛血清白蛋白、二硝基水杨酸酯(dinitrosalycilate,DNS)、总酚检测试剂盒、阿卡波糖、磷酸缓冲盐溶液(phosphate buffered saline,PBS)、α-淀粉酶(猪胰腺,5 U/mg)、α-葡萄糖苷酶(7.5 U/mg):北京索莱宝科技有限公司;异丙醇、氯乙酸、冰醋酸、氢氧化钠、乙醇酸、乙酸铵、变色酸:天津市江天化工技术股份有限公司;可溶性淀粉、4-硝基苯基-β-D-吡喃葡萄糖苷(4-nitrophenyl β-D-glucopyranoside,pNPG):上海源叶生物科技有限公司;所用试剂均为分析纯。
1.2 仪器与设备
紫外可见分光光谱仪(UV-2550PC):日本岛津仪器有限公司;多功能酶标仪(Synergy HTX):美国伯腾仪器有限公司;热重分析仪(Q50):美国TA 仪器(沃特世有限责任公司);傅里叶红外光谱仪(IS50):美国尼高利仪器有限公司;X-射线衍射仪(日本Rigaku Ultima IV):广州智汇科学仪器有限公司。
1.3 方法
1.3.1 多糖纯化
先前试验通过CaCl2溶液提取裙带菜褐藻糖胶后逐级沉淀得到4 组多糖样品(UPP-45、UPP-55、UPP-65、UPP-75),其中UPP-65 组分降血糖效果较好[11]。采用DEAE-52 纤维素柱和Sephadex G-100 柱进一步纯化UPP-65 组分。将UPP-65 溶液(10 mg/mL)上样到DEAE-52 纤维素柱(1.6 cm×40 cm)上,并用超纯水和系列浓度梯度的NaCl 溶液(0.1、0.3、0.5、0.7 mol/L)以1.6 mL/min 的流速逐步洗脱。采用苯酚-硫酸法检测馏分中的多糖含量,由于超纯水洗脱液中的总糖含量较高,因此对超纯水洗脱液再进一步纯化。将超纯水洗脱液浓缩,然后冷冻干燥,以10 mg/mL 的浓度在Sephadex G-100 色谱柱上样,洗脱液为超纯水,条件为0.6 mL/min,4 mL/管,得到洗脱曲线,收集最高管获得纯化多糖并命名为UPP(Undariapinnatifidapolysaccharide)。
1.3.2 基本化学组成测定
以葡萄糖为标准品,采用苯酚-硫酸法测定UPP的总糖含量[12]。以半乳糖醛酸为标准品,采用间羟基联苯法测定糖醛酸含量[13]。以牛血清白蛋白为标准品,采用考马斯亮蓝法测定蛋白质含量[14]。以葡萄糖为标准品,采用3,5-二硝基水杨酸法测定还原糖含量[15]。通过总酚检测试剂盒测定总酚含量[16]。
1.3.3 紫外全波长扫描
将多糖样品配制成1 mg/mL 的溶液,对照组为蒸馏水,在190~500 nm 范围内进行紫外光谱扫描。
1.3.4 羧甲基衍生物的制备
UPP 的羧甲基化基于Yu 等[17]的方法进行修改,将UPP(200 mg)与异丙醇(20 mL)混合搅拌30 min 后加入一定浓度的NaOH 溶液(10 mL),在室温下搅拌1.5 h。然后加入一定量的异丙醇和氯乙酸溶液,在一定温度下搅拌3 h。将反应混合物冷却至室温,用冰醋酸调节pH 值至中性,并在500 Da 透析袋中用蒸馏水透析72 h,旋蒸浓缩后冷冻干燥,得到CM-UPP。
1.3.5 羧甲基化取代度(degree of carboxymethylation substitution,DS)的测定
裙带菜多糖的羧甲基化取代度测定基于Shi 等[18]的方法进行修改,吸取不同体积的乙醇酸对照品和CM-UPP(均为1 mg/mL)至具塞试管(25 mL)内,加入NaOH 溶液(0.25 mol/L)补足至1 mL,然后各加入0.1% 变色酸溶液(5 mL)和浓硫酸(1 mL),水浴加热0.5 h 后冷却至室温,滴加30%乙酸铵溶液,使各具塞试管内溶液至刻度,在570 nm 处测定吸光度值。DS(Y)的计算公式如下。
式中:Y为羧甲基化修饰取代度;m为每克羧甲基糖样品中相当于乙醇酸的量,g;162 为多糖的失水葡萄糖单元的摩尔质量,g/mol;76 为乙醇酸摩尔质量,g/mol;80 为CH2COONa 取代后每单位的净增加量,g/mol。
1.3.6 单因素试验
1.3.6.1 氯乙酸浓度对取代度的影响
称取200 mg UPP 与20 mL 异丙醇混合搅拌30 min,加入10 mL 20%的NaOH 溶液在室温下搅拌1.5 h。加入4 mL 异丙醇作为溶剂,然后再加入6 mL 氯乙酸溶液(0.5、1.0、1.5、2.0、2.5 mol/L),65 ℃搅拌3 h,得到羧甲基化多糖后测定取代度,确定最佳氯乙酸浓度。
1.3.6.2 反应温度对取代度的影响
称取200 mg UPP 与20 mL 异丙醇混合搅拌30 min,加入10 mL 20% 的NaOH 溶液在室温下搅拌1.5 h。加入4 mL 异丙醇作为溶剂,然后再加入6 mL 1.5 mol/L 氯乙酸溶液,在一定反应温度(45、55、65、75、85 ℃)下搅拌3 h,得到羧甲基化多糖后测定取代度,确定最佳反应温度。
1.3.6.3 NaOH 浓度对取代度的影响
称取200 mg UPP 与20 mL 异丙醇混合搅拌30 min,加入10 mL 一定浓度(15%、20%、25%、30%、35%)的NaOH 溶液,在室温下搅拌1.5 h。加入4 mL异丙醇作为溶剂,然后再加入6 mL 1.5 mol/L 氯乙酸溶液,65 ℃搅拌3 h,得到羧甲基化多糖后测定取代度,确定最佳NaOH 浓度。
1.3.7 响应面试验设计
根据单因素试验结果,采用Box-Behnken 原理设计取代度优化试验,考察氯乙酸浓度、反应温度、NaOH浓度对羧甲基化取代度的影响,确定多糖的最佳提取条件。试验因素和水平见表1。

表1 响应面试验各因素和水平Table 1 Factors and levels of response surface test
1.3.8 傅里叶红外光谱分析
称取多糖样品(1.0 mg)和干燥的KBr 粉末(150.0 mg),充分研磨、压为薄片,置于傅里叶红外光谱仪中,在4 000~400 cm-1范围内扫描16 次,分辨率为4 cm-1[19]。
1.3.9 热重分析
称取5.0 mg 多糖粉末,将样品置于热重分析仪的氧化铝坩埚中,以N2为载气,流速为20 mL/min,设置初始温度和结束温度分别为25 ℃和600 ℃,以10 ℃/min的速度进行加热测试。
1.3.10 X-射线衍射分析
分别取50 mg UPP 和CM-UPP 样品,将表面压平后置于X-射线衍射仪的检测板上进行X 射线扫描,扫描条件:2θ,变化范围5°~90°,速度2°/min。
1.3.11 体外降血糖活性试验
1.3.11.1 α-淀粉酶的抑制活性测定
根据Xu 等[20]的方法测定UPP 和CM-UPP 对α-淀粉酶的抑制活性。以阿卡波糖为阳性对照,用25 µL不同浓度梯度的多糖溶液与α-淀粉酶溶液(25 µL,40 U/mL)混匀,37 ℃孵育10 min 后,加入1% 的可溶性淀粉溶液(25 µL,0.1 mol/L PBS 溶液配制),混匀置于99 ℃的水浴锅,反应15 min 后迅速冷却至室温,立即与50 µL DNS 溶液反应,置于95 ℃的水浴锅水浴5 min 显色后,冰水浴迅速冷却,加入750µL 蒸馏水,于540 nm 处测定吸光度。α-淀粉酶抑制率(Y1,%)计算公式如下。
式中:A1表示样液反应后吸光度;A2表示α-淀粉酶替换为PBS 溶液后重复实验的吸光度;A0表示样液替换为PBS 溶液后重复实验的吸光度。
1.3.11.2 α-葡萄糖苷酶的抑制活性测定
根据Chen 等[21]的方法测定多糖对α-葡萄糖苷酶的抑制活性。以阿卡波糖为阳性对照,用150µL 不同浓度梯度的多糖溶液与α-葡萄糖苷酶溶液(50 µL,0.8 U/mL)混匀,37 ℃孵育10 min。加入pNPG 溶液(100 µL,0.9375 mmol/L),37 ℃反应20 min 后加入Na2CO3溶液(500µL,1 mol/L)停止反应,于405 nm 处测定吸光度。α-葡萄糖苷酶抑制率(Y2,%)计算公式如下。
式中:A1为反应溶液的吸光度;A2表示α-葡萄糖苷酶替换为PBS 后重复试验的吸光度;A0表示样液替换为PBS 后重复实验的吸光度。
1.4 数据处理
所有测定指标均作3 次平行处理,利用SPSS16.0软件对数据统计学进行处理,所有数据均以平均值±标准差表示。使用Origin2018 和Graphpad Prism 8 对图表制作与处理。
2 结果分析
2.1 多糖分离纯化
UPP-65 的DEAE-52 纤维素柱和Sephadex G-100柱层析洗脱曲线如图1 所示。

图1 UPP-65 洗脱曲线图Fig.1 Elution curve of UPP-65
由图1 可知,主要得到1 个洗脱峰。收集、浓缩、冻干这一组分多糖,并通过Sephadex G-100 葡聚糖凝胶过滤柱进一步纯化,收集最高管,冻干后得到纯多糖(UPP)用于后续羧甲基化试验。
2.2 基本组成成分分析
UPP 的基本组成成分结果如表2 所示。

表2 UPP 基本化学成分测定结果Table 2 Results ofbasic chemicalcomposition determination of UPP%
由表2 可知,纯化后的多糖组分总糖含量较高且无还原糖存在,总糖含量为(93.94±0.47)%。蛋白质含量和总酚含量均低,分别为(0.97±0.26)%和(0.03±0.01)%,表明多糖含杂质较少。UPP 的糖醛酸含量较低,为(1.90±0.31)%,表明纯化后的多糖为中性多糖。
2.3 紫外光谱分析
UPP 的紫外光谱扫描如图2 所示。
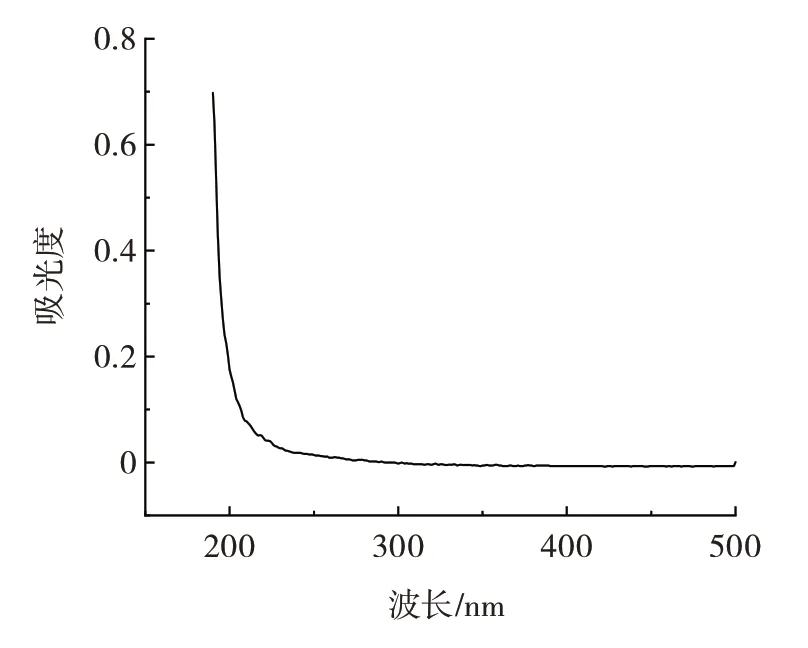
图2 UPP 的紫外光谱扫描Fig.2 Ultraviolet spectrum analysis of UPP
由图2 可知,多糖溶液在260 nm 和280 nm 处均无明显的吸收峰,表明UPP 不含或含有少量的核酸和蛋白质,这一结果与UPP 化学成分测定的蛋白质含量较少的结果相一致。
2.4 单因素试验结果分析
2.4.1 氯乙酸浓度对羧甲基化取代度的影响
氯乙酸浓度对羧甲基化取代度的影响见图3。
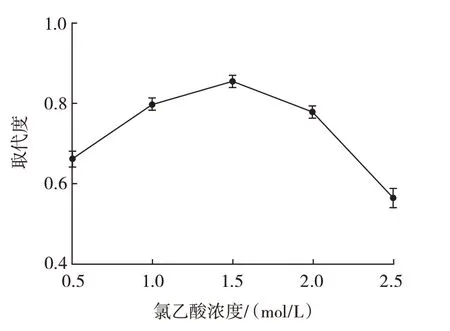
图3 氯乙酸浓度对羧甲基化取代度的影响Fig.3 Effect of chloroacetic acid concentration on carboxymethylation substitution
由图3 可知,当氯乙酸浓度小于1.5 mol/L 时,随着氯乙酸浓度的增加,取代度逐渐增加,但浓度达到1.5 mol/L 后,取代度逐渐下降。在碱性的环境中,多糖的羟基会被去质子化暴露出孤电子对,更容易与氯乙酸发生取代反应,但过量的氯乙酸会直接破坏碱性环境,不利于取代反应的进行,且过量的氯乙酸会与氢氧化钠生成乙醇酸钠导致取代度降低[22]。因此选择氯乙酸浓度为1.5 mol/L 左右进行响应面试验设计。
2.4.2 反应温度对羧甲基化取代度的影响
反应温度对羧甲基化取代度的影响见图4。

图4 反应温度对羧甲基化取代度的影响Fig.4 Effect of reaction temperature on carboxymethylation substitution
由图4 可知,适当的反应温度有利于提高CMUPP 的取代度,当反应温度低于65 ℃时,取代度随反应温度升高而升高,在65 ℃时取代度最高,之后逐渐下降。这是因为低温很难加速氯乙酸钠与羟基的反应,也很难加速羧甲基的形成[23]。但温度过高,取代度反而会降低,其原因可能是反应温度升高会减小空间反应,不利于醇氧化物的形成[24]。因此选择反应温度为65 ℃左右进行响应面试验设计。
2.4.3 NaOH 浓度对羧甲基化取代度的影响
NaOH 浓度对羧甲基化取代度的影响见图5。
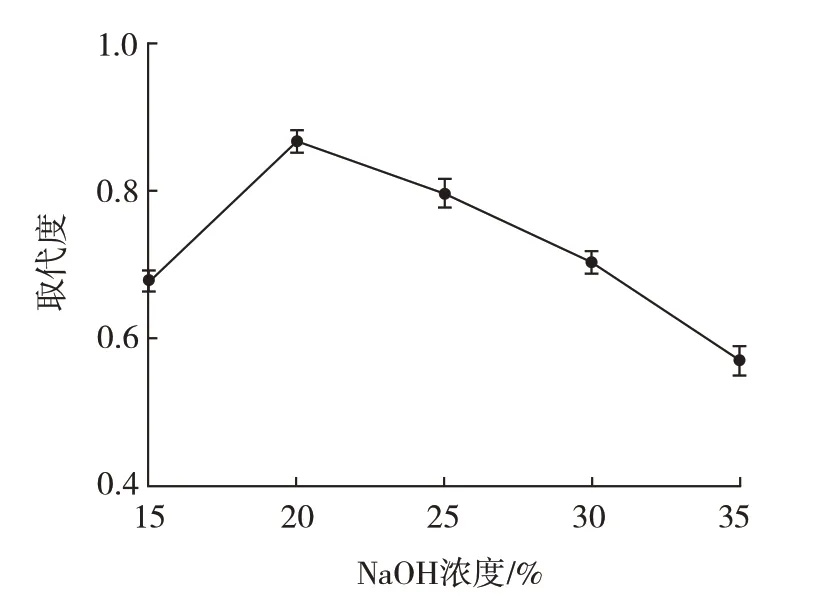
图5 NaOH 浓度对羧甲基化取代度的影响Fig.5 Effect of NaOH concentration on carboxymethylation substitution
由图5 可知,NaOH 浓度为15%~35% 时,多糖的取代度先增大后减小,NaOH 浓度为20%时,取代度最大。这是因为羧甲基化反应本质为亲核取代反应,NaOH 浓度过低时,多糖羟基的去质子化程度低,亲核性较弱。氢氧化钠浓度过高时,过量的氢氧化钠与氯乙酸接触的机会也增多,可能发生副反应,不利于取代度反应的进行[25]。因此选择NaOH 浓度为20% 左右进行响应面试验设计。
2.5 响应面结果分析
2.5.1 响应面试验结果与分析
在单因素试验结果的基础上,利用Desin-Expert10.0 采用响应面法进一步优化UPP 羧甲基化的反应条件。试验设计及结果见表3。
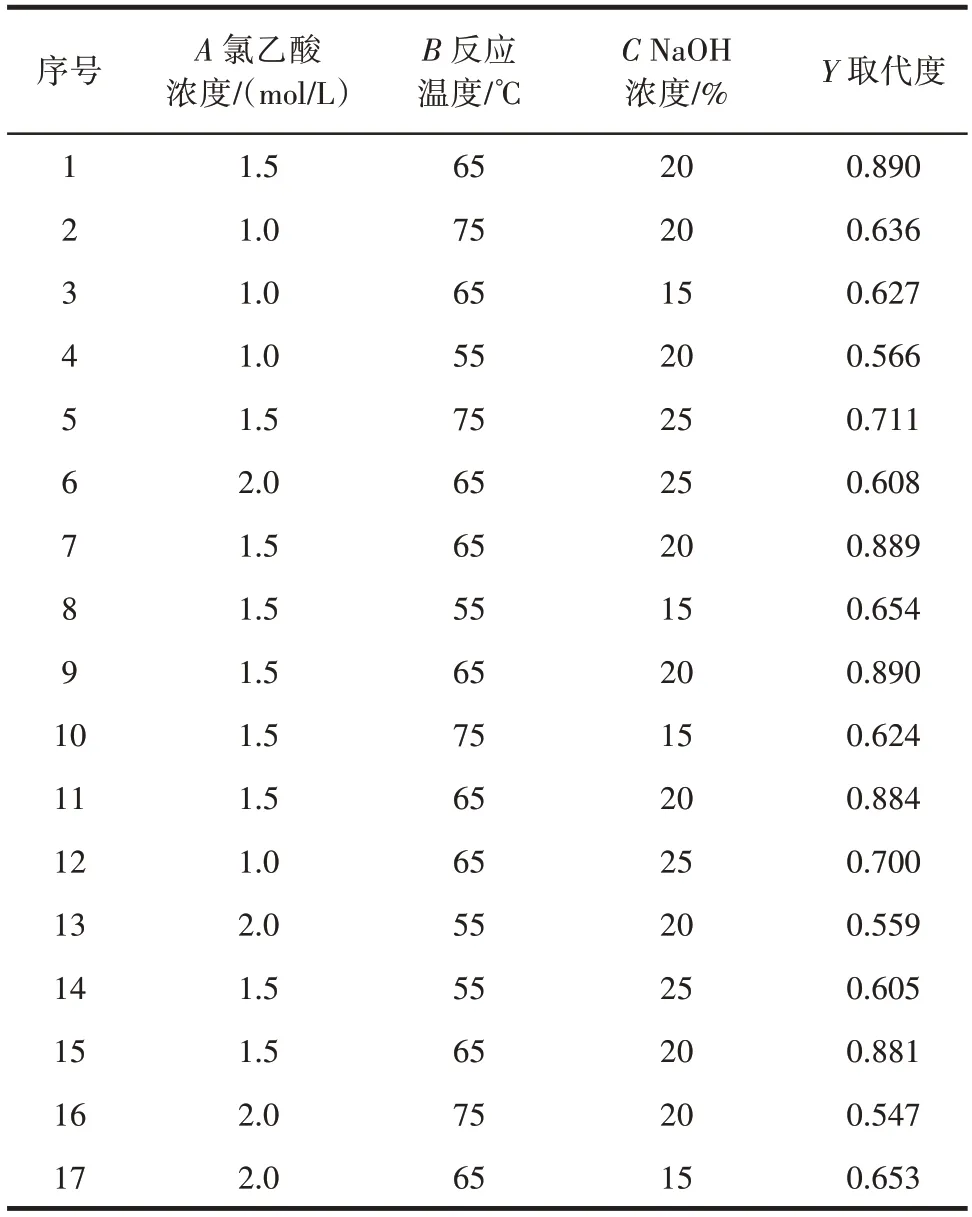
表3 响应面试验设计Table 3 Design of response surface test
利用Design-Expert 10.0 软件对试验数据进行多元回归拟合,得到二阶多项式回归方程为Y=0.89-0.020A+0.017B+8.25×10-3C-0.021AB-0.03AC+0.034BC-0.16A2-0.15B2-0.084C2。
2.5.2 方差分析和二次多项回归方程拟合
对模型进行方差分析,结果见表4。
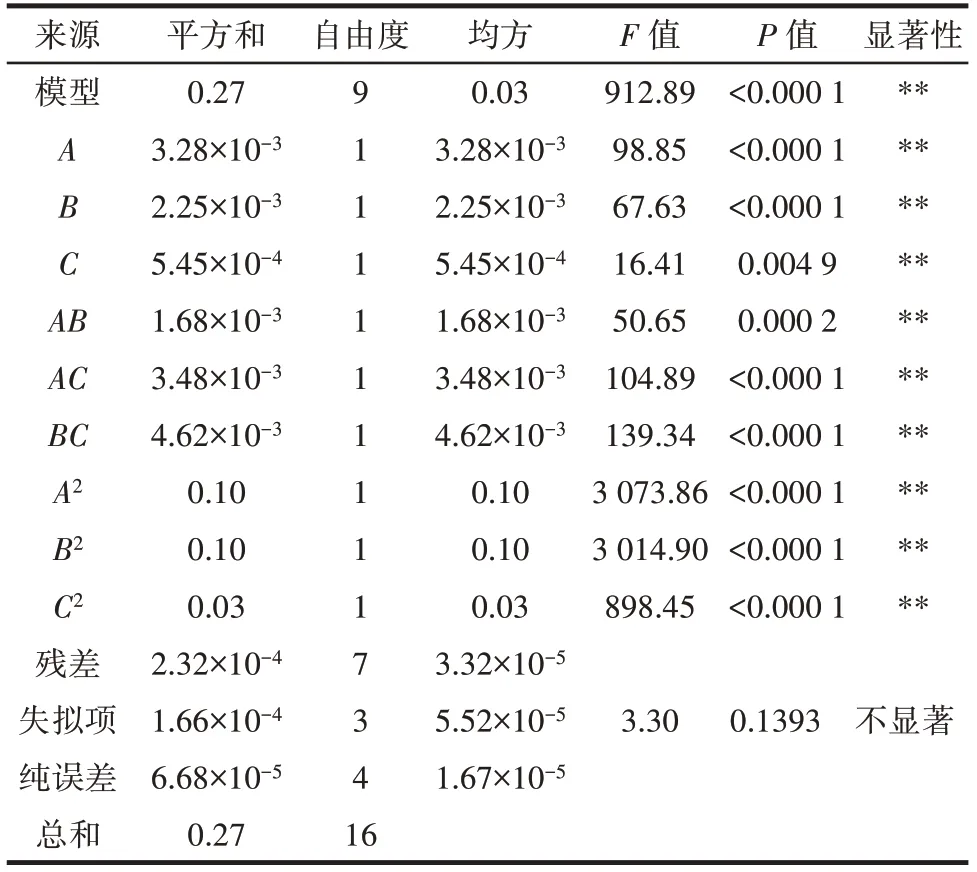
表4 方差分析Table 4 Variance analysis
由表4 可知,模型F值为912.89,P<0.000 1,表明回归模型极显著且模型拟合度良好。相关系数R2和校正决定系数R2Adj分别为0.999 1 和0.998 1,表示此模型能较好预测羧甲基化取代度,试验结果与分析结果差异较小,具有较高的可信度。由F值可知,3 个因素对羧甲基化取代度的影响程度为A>B>C,即氯乙酸浓度>反应温度>NaOH 浓度。
2.5.3 响应面和等高线分析
各因素交互作用的响应面如图6 所示。
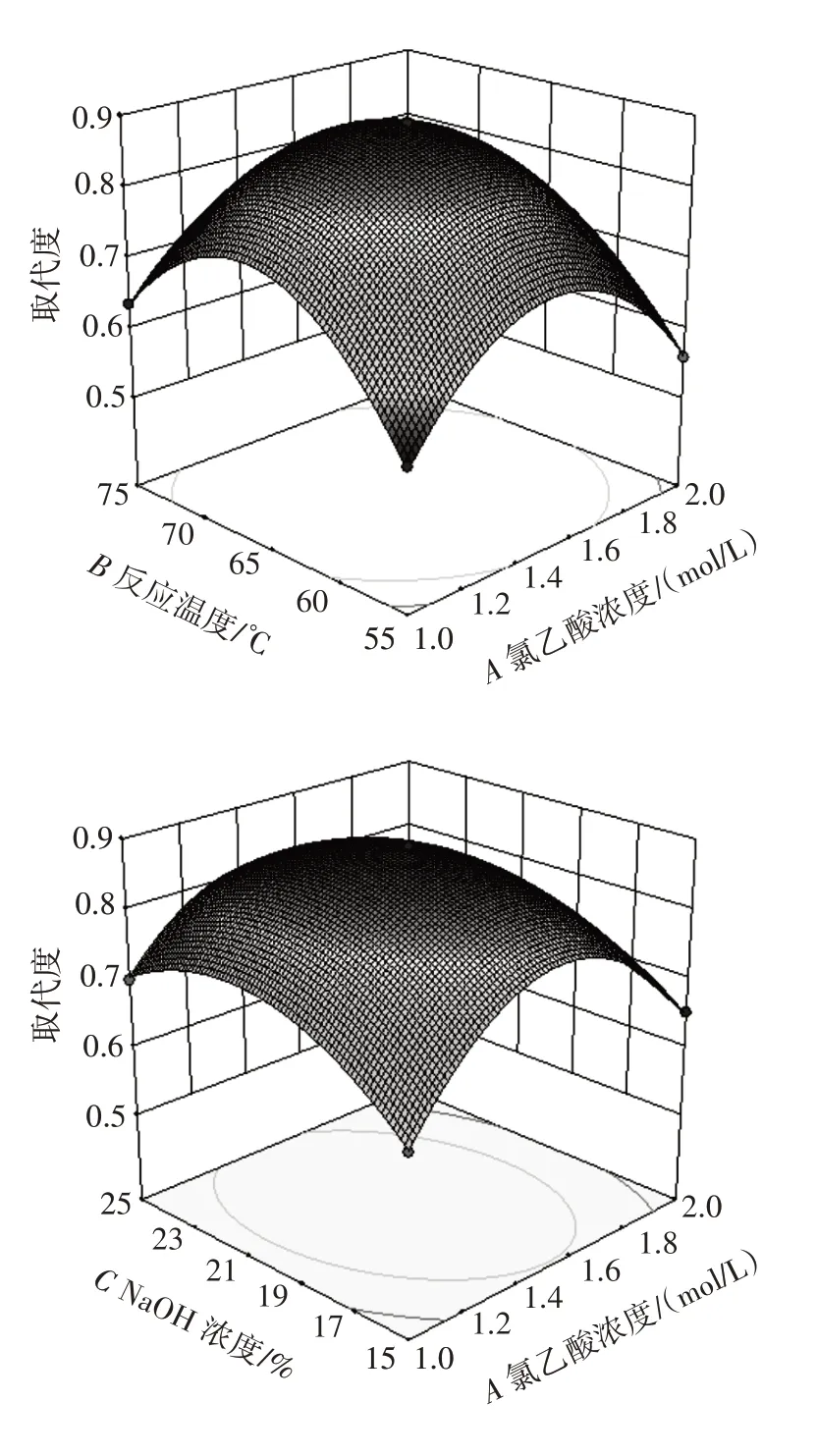

图6 各因素交互作用对取代度影响的响应面Fig.6 Response surface plots of effects of interaction among various factors on degree of substitution
由图6 可知,响应面的开口均向下,曲面呈中间凸四周凹的形状,说明曲面有最高点,即存在最优条件,这也表明3 个因素两两之间均有交互作用。响应面图可以直观反映出各因素对羧甲基化取代度的影响,曲面越陡,影响越大。响应面曲面在底部的投影图中氯乙酸浓度与NaOH 浓度、NaOH 浓度与反应温度之间的二维等高线图均为椭圆形,表明因素之间交互作用极显著,而氯乙酸浓度与反应温度之间的二维等高线图近似圆形,表明氯乙酸浓度与反应温度交互作用的显著性低于另外两组因素的交互作用,与表4 中的方差分析结果一致。
2.5.4 验证试验结果分析
根据响应面试验得出羧甲基化取代度最优条件为氯乙酸浓度1.462 mol/L、反应温度65.682 ℃、NaOH 浓度20.383%,此时羧甲基化取代度为0.888。在实际试验过程中将条件修正为氯乙酸浓度1.46 mol/L、反应温度65 ℃、NaOH 浓度20%,利用修正条件重复3 次对UPP 羧甲基化修饰,得到羧甲基化取代度为0.887。实际得率与预测得率相差较小,说明用此模型预测羧甲基化取代度可行。
2.6 红外光谱扫描分析
UPP 和CM-UPP 的傅里叶红外光谱分析见图7。
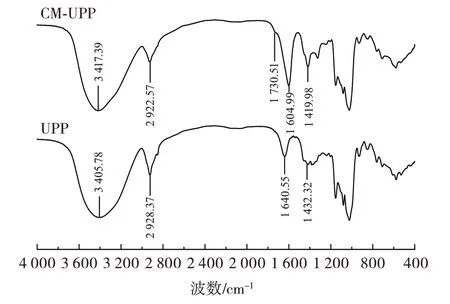
图7 UPP 和CM-UPP 的红外光谱图Fig.7 Infrared spectra of UPP and CM-UPP
由图7 可知,UPP 中3 405.78 cm-1出现了O—H 伸缩振动;2 928.37、1 432.32 cm-1两处分别出现了C—H伸缩振动和C—H 弯曲振动;1 640.55 cm-1出现了C O伸缩振动,以上为多糖的特征吸收峰[26]。1 200~1 000 cm-1范围内的吸收峰由C—O—C 糖苷环的振动产生,表明UPP 中含有吡喃糖。
引入-CH2COOH 后,CM-UPP 中除含有以上多糖的基本特征峰外,在1 730.51 cm-1处增加了新的吸收峰,表明糖醛酸含量增加[16]。并且1 604.99 cm-1处的C O 伸缩振动以及1 419.98 cm-1处的C—H 弯曲振动幅度均有加强,表明UPP 羧甲基化成功[27]。
2.7 热重分析(thermo-gravimetric analysis,TGA)
UPP 和CM-UPP 的TGA 曲线见图8。

图8 UPP 和CM-UPP 的TGA 曲线Fig.8 TGA curves of UPP and CM-UPP
由图8 可知,UPP 和CM-UPP 均有3 个不同的失重阶段。第一阶段在100 ℃以下,可能由于多糖游离和结合水的蒸发,UPP 和CM-UPP 的初始质量损失率分别为6.29% 和9.99%[28]。第二阶段在200~400 ℃之间,出现了明显的质量损失,归因于多糖的热分解及生物聚合物结构的分解,UPP 和CM-UPP 的失重率分别为59.26% 和56.83%[29]。第三阶段在450~600 ℃之间,剩余多糖缓慢碳化,最终转化为灰分和无机成分。与UPP 相比,CM-UPP 在第二阶段损失质量少,说明CM-UPP 具有更强的热稳定性,这一结果可能与CMUPP 比UPP 糖醛酸高有关[30]。
2.8 X-射线衍射(X-ray diffraction,XRD)试验
X 射线衍射是研究多糖结构的重要技术,可用于分析材料晶体结构的一种方法[31]。XRD 中晶体结构显示为尖锐的窄衍射峰,而无定型结构显示为宽峰[16]。UPP 和CM-UPP 的XRD 结果见图9。

图9 UPP 和CM-UPP 的XRD 图Fig.9 XRD diagram of UPP and CM-UPP
由图9 可知,在5°~80°(2θ)范围内,UPP 和CMUPP 在21°左右均出现1 个衍射峰,这是主要的结晶反射区,谱图中无尖峰出现,这表明两种多糖无结晶现象,是一种无定型结构。该结果与丁素芸等[32]的研究结果相似。两者衍射峰宽窄程度不同,CM-UPP 衍射峰的宽度和强度均高于UPP,表明羧甲基化修饰可能会破坏多糖内部的晶体结构[33]。
2.9 体外降血糖活性分析
2.9.1 UPP 和CM-UPP 对α-淀粉酶的抑制
以阿卡波糖为阳性对照,通过测定两种多糖对α-淀粉酶活性的抑制作用来研究其体外降血糖作用。UPP 和CM-UPP 对α-淀粉酶的抑制作用见图10。
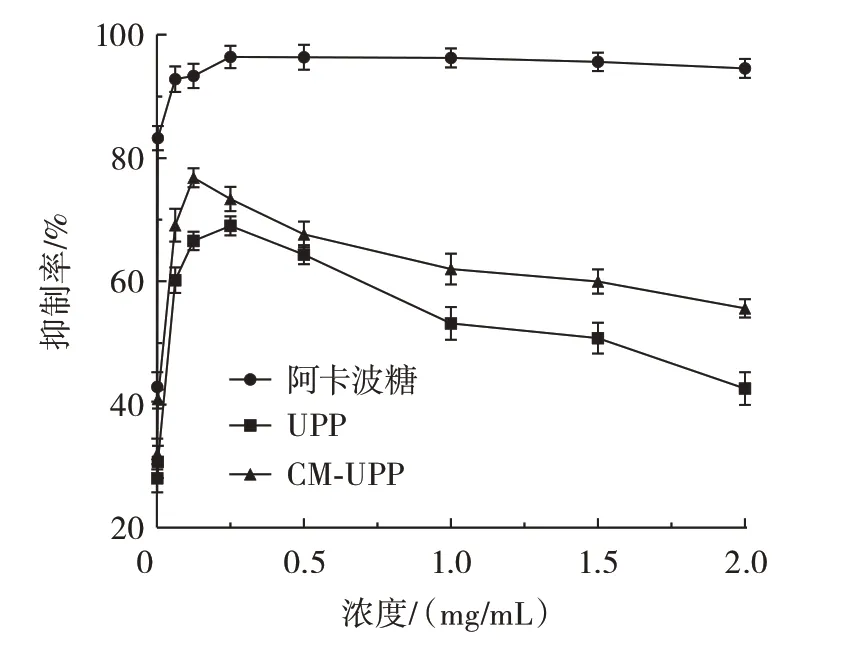
图10 UPP 和CM-UPP 对α-淀粉酶的抑制作用Fig.10 Inhibitory effect of UPP and CM-UPP on α-amylase
由图10 可知,UPP、CM-UPP 均对α-淀粉酶有抑制作用,抑制程度都低于阿卡波糖。两种多糖对α-淀粉酶的抑制无剂量依赖关系,呈现先升高后降低的趋势,此现象与陈舒桐等[34]研究结果相似。UPP 在0.25 mg/mL 时达到最高抑制率,抑制率为69.01%。CM-UPP 在0.125 mg/mL 时达到最高抑制率,抑制率为76.82%。CM-UPP 的抑制率较高表明羧甲基化修饰增强多糖的α-淀粉酶抑制能力。引入-CH2COOH 后,裙带菜多糖的酸性糖增多,可能会增强羧甲基化裙带菜多糖对α-淀粉酶的抑制作用,此现象与Chen 等[35]研究结果相似。
2.9.2 UPP 和CM-UPP 对α-葡萄糖苷酶的抑制
以阿卡波糖为阳性对照,通过测定两种多糖对α-葡萄糖苷酶活性的抑制作用来研究其体外降血糖作用。UPP 和CM-UPP 对α-葡萄糖苷酶的抑制作用见图11。

图11 UPP 和CM-UPP 对α-葡萄糖苷酶的抑制作用Fig.11 Inhibitory effect of UPP and CM-UPP on α-glucosidase
由图11 可知,UPP、CM-UPP 均对α-葡萄糖苷酶有抑制作用,抑制程度均低于阿卡波糖。UPP 和CM-UPP 对α-葡萄糖苷酶的抑制呈浓度依赖关系,随着多糖浓度的增加,两种多糖对α-葡萄糖苷酶的抑制率逐渐升高。阿卡波糖、UPP、CM-UPP 的IC50值分别为0.002、3.467、0.503 mg/mL,CM-UPP 的IC50值低于UPP,可以看出羧甲基化修饰增强了多糖对α-葡萄糖苷酶的抑制作用,其原因可能是由于裙带菜多糖中引入了-CH2COOH 后,其电负性和水溶性有所改变,所以增强了羧甲基化裙带菜多糖对α-葡萄糖苷酶的抑制作用[9]。
3 结论
通过DEAE-52 纤维素柱和Sephadex G-100 柱层析对分级醇沉组分UPP-65 进行纯化,获得中性多糖UPP。通过对UPP 的基本化学组成分析可知,UPP 不含有还原糖,其总糖、糖醛酸、蛋白质、总酚含量分别为(93.94±0.47)%、(1.90±0.31)%、(0.97±0.26)%、(0.03±0.01)%。利用响应曲面法对UPP 的羧甲基化修饰进行最佳工艺优化:氯乙酸浓度为1.46 mol/L、反应温度为65 ℃、NaOH 浓度20%,此时羧甲基化取代度为0.887。
采用红外光谱扫描、热重和X-射线衍射对两种多糖进行初步结构表征。由红外光谱分析可知,UPP 和CM-UPP 都具有多糖的基本特征峰,并且UPP 羧甲基化修饰成功。由热重分析结果可知,CM-UPP 比UPP具有更强的热稳定性。由X-射线衍射试验可知,两种多糖均无结晶现象,为无定型结构。
体外降血糖试验表明UPP 和CM-UPP 均对α-淀粉酶活性和α-葡萄糖苷酶有一定的抑制作用,但都低于阿卡波糖的抑制作用。两种多糖对α-淀粉酶的抑制呈现先升高后下降的趋势,UPP 在0.25 mg/mL 时达到最高抑制率,抑制率为69.01%,CM-UPP 在0.125 mg/mL 时达到最高抑制率,抑制率为76.82%;两种多糖对α-葡萄糖苷酶的抑制均呈剂量依赖关系,UPP 和CM-UPP 的IC50值分别为3.467 mg/mL 和0.503 mg/mL。与UPP 相比,CM-UPP 抑制率更好,表明羧甲基化修饰能够增强裙带菜多糖的体外降血糖活性,为裙带菜多糖的应用研究提供了一定的理论基础。
