植物复合饮料对Ⅱ型糖尿病小鼠的降糖作用
2024-03-28黄雅晨李瑶李振港李琦杜婷杜欣军
黄雅晨,李瑶,李振港,李琦,杜婷,杜欣军
(食品营养与安全国家重点实验室,天津科技大学食品科学与工程学院,天津 300457)
糖尿病是一种治疗周期久、医疗成本高的代谢性疾病,已成为威胁人类健康的第三大非传染性疾病[1],不仅严重影响了人们的生理健康、降低了生活质量,也对国家医疗和经济发展造成了一定负担。Ⅱ型糖尿病(Type 2 diabetes mellitus,T2DM)占糖尿病患者总数的90% 以上[2]。随着病程发展,患者会出现组织器官病变,极易导致患者死亡[3-4]。目前,临床大多使用降血糖药物或人工注射胰岛素进行糖尿病治疗[5]。然而,长期服用降血糖药物会对患者身体造成难以挽回的损伤[6-8]。合理膳食是维持正常血糖水平的一种重要方式,研究发现许多药食同源的植物次生代谢物具有良好的降糖功效且长期服用不会对身体造成损伤[9-10]。
青钱柳(Cyclocaryapaliurus),属胡桃科青钱柳属,是中国南方特有的稀有单子叶植物[11],2013 年被列为新资源食品[12]。自20 世纪70 年代以来,青钱柳逐渐成为一种具有特殊风味的保健茶,对肥胖和糖尿病患者有益[13],也是湖南西南地区土家族的一种常见药材[14]。青钱柳叶中存在超过136 种化合物,主要包括黄酮类、多糖类和三萜类化合物以及酚酸、脂肪酸和多种微量元素[15-18]。《中医药资源》第一版的典籍中记载,青钱柳的树皮和叶片具有清热解毒、生津止渴的潜在功效[14]。多项研究表明青钱柳叶具有较为理想的降血糖和降血脂功能[19-21]。桑叶富含多种活性成分,对降血糖、抗肥胖具有良好的功效[22-25]。我国桑叶资源极为丰富,开发基于桑叶的食品有利于拓宽桑叶应用途径和产品价值[26]。怀山药,是药食同源植物,富含甾体、多糖、皂苷等多种活性成分[27-28],具有降血糖、降血脂、降尿酸、抗炎、促进消化等多种功效[27,29-31]。市场上大部分怀山药仅用于鲜食或者打粉等粗加工,对于其深加工综合利用仍存在不足[32]。
目前市售降血糖产品主要以冲泡茶饮为主,由于功效成分的摄入有限,大大限制了其功效作用。本研究将青钱柳、桑叶及怀山药提取物复配制成一款复合饮料,通过高脂饲料联合链脲佐菌素注射诱导建立T2DM 小鼠模型,并评价复合饮料对糖尿病小鼠的治疗效果,以期为植物基降糖饮料开发提供理论依据。
1 材料与方法
1.1 材料与试剂
SPF 级C57BL/6J 雄性小鼠[体质量(19.0±1.0)g]、垫料、饲料:斯贝福(北京)生物技术有限公司;青钱柳提取物:西安瑞尔丽生物工程有限公司;怀山药提取物:郑州康吉元生物科技有限公司;桑叶提取物:陕西安康康元医药科技有限公司;仁和-盐酸二甲双胍缓释片(规格0.5 g):河北山姆士药业有限公司;胰岛素酶联免疫检测试剂盒、胰高血糖素样肽-1 酶联免疫检测试剂盒、糖化血清蛋白检测试剂盒、总胆固醇检测试剂盒、甘油三酯检测试剂盒、低密度脂蛋白检测试剂盒:南京建成生物科技有限公司。
1.2 主要仪器
安稳+型血糖仪:三诺生物传感股份有限公司;Milli-Q®HX 7000 超纯水仪:密理博仪器(上海)有限公司;GJJ-1/25 高压均质机:上海诺尼轻工机械有限公司;SY-1-2 恒温水浴锅:巩义市予华仪器有限责任公司;BSA224S-CW 分析天平:德国赛多利斯公司;JA260313 电子天平:上海精科天美科学仪器有限公司;5424C-150339 型台式离心机:艾本德(中国)有限公司;SCIENTA-48 高通量组织研磨机:宁波新芝生物科技股份有限公司;MR-96A 酶标仪:赛默飞世尔科技有限公司。
1.3 实验方法
1.3.1 复合饮料制作工艺及操作要点

操作要点:
1)过筛:按青钱柳提取物∶怀山药提取物∶桑叶提取物为15∶10∶1(质量比)混合后过60 目筛,筛出大颗粒杂质的同时使物料混合均匀。
2)复配:添加复合稳定剂之前将其先进行溶解后再与其他物料混合,防止稳定剂溶解不完全影响产品口感及状态。
3)均质:在压力为35 MPa,温度为50 ℃条件下均质2 次,提高物料分布均匀性,使产品各组分均一稳定。
4)脱气:除去液体中溶解的空气和附着于浆质粒子表面的气体,抑制物料起伏,减少灌装及灭菌时起泡。
5)灌装:采用真空灌装以减少产品与空气的接触,保证产品质量。
6)灭菌:采用高温杀菌的方法,95 ℃保持20 min。
1.3.2 动物实验设计
选用84 只健康6~8 周龄SPF 级雄性C57BL/6J小鼠,饲养温度为(23±2)℃,湿度为50%,12 h 光照和12 h 黑暗交替,小鼠自由摄食和饮水,定期更换垫料、饲料和无菌水,饲养1 周后,84 只C57BL/6J 小鼠被随机分成正常组(24 只)和造模组(60 只)。正常组24 只小鼠被分为正常饲养组(normal control,NC)和正常灌胃饮料组(beverage control,BC),并饲喂标准饲料;对造模组小鼠腹腔注射60 mg/kg 链脲佐菌素(streptozotocin,STZ)同时持续喂食高脂饲料以诱导建立T2DM 小鼠模型,72 h 后当小鼠空腹血糖值大于11.1 mmol/L,伴随“三多一少”症状且下一个72 h 的空腹血糖值稳定升高即为造模成功。将造模成功后的T2DM 小鼠随机均分为5 组,分别为糖尿病模型组(diabetes control,DC)、二甲双胍组(metformin,Met,60 mg/kg)、饮料低剂量组(beverage in low dose group,BL,150 mg/kg)、饮料中剂量组(beverage in middle dose group,BM,300 mg/kg)、饮料高剂量组(beverage in high dose group,BH,600 mg/kg),每组12 只。实验期间对7 组小鼠分别灌胃对应溶剂,持续5 周,小鼠自由采食饮水,每天上午9 点灌胃。
1.3.3 生理指标测定
每周一21 时称量小鼠体质量、饮食量、饮水量;每周二9 时测量小鼠空腹血糖值,测量前10 h 对小鼠禁食;5 周灌胃期结束,小鼠禁食10 h 后灌胃2.0 g/kg 葡萄糖溶液,并在0、30、60、90、120 min 时测定小鼠血糖值。随后摘取小鼠眼球取血,分离血清并检测胰岛素水平,计算胰岛素抵抗指数;利用各类试剂盒检测胰高血糖素样肽-1、糖化血清蛋白、血脂水平。脱颈处死后解剖小鼠,取肝脏、胰腺后称重,保存于多聚甲醛溶液中用于后续病理切片分析。利用实时荧光聚合酶链式反应(real-time quantitative polymerase chain reaction,qRT-PCR)检测肝脏中胰岛素代谢通路关键基因的mRNA 相对表达量,目的基因的引物序列信息见表1。

表1 引物序列Table 1 Primers
胰岛素抵抗指数(homeostatic model assessment of insulin resistance,HOMA-IR)计算公式如下。
式中:H为HOMA-IR;I为血清胰岛素水平,mIU/mL;F为空腹血糖水平,mmol/L;22.5 为校正因子,指在正常理想个体中5µU/mL 血浆胰岛素,对应4.5 mmol/L的血糖水平。
1.4 数据统计分析
使用IBM SPSS Statistics 23.0 和Graph Pad Prism 8.0 进行数据分析;组间均值比较采用单因素方差分析,使用t检验方法,结果用平均值±标准差表示。
2 结果与分析
2.1 复合饮料对Ⅱ型糖尿病小鼠饮食量、饮水量及体质量的影响
复合饮料对Ⅱ型糖尿病小鼠饮食量、饮水量及体质量的影响见图1。由图1 可知,BM、BH 组小鼠饮食量有一定上升但与NC 组无明显差异,饮水量呈上升状态。灌胃期间,DC 组小鼠体质量持续下降,BL 组与BH 组小鼠体质量呈下降趋势但下降程度弱于DC 组,BM 组小鼠体质量较稳定,无明显下降。BH 组小鼠体质量减轻较多但根据血糖水平等其它指标综合考虑,可能是由于剂量较高而产生降脂作用导致小鼠体质量减轻。上述结果表明复合饮料可以显著改善糖尿病小鼠“三多一少”的症状。
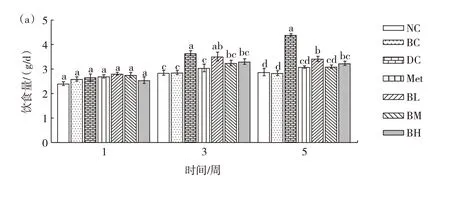
图1 复合饮料对T2DM 小鼠饮食量、饮水量及体质量的影响Fig.1 Effects of beverage on food intake,water intake and body weight in T2DM mice
2.2 复合饮料对Ⅱ型糖尿病小鼠空腹血糖水平的影响
复合饮料对Ⅱ型糖尿病小鼠空腹血糖水平的影响见图2。

图2 复合饮料对T2DM 小鼠空腹血糖值的影响Fig.2 Effects of beverage on fasting blood glucose levels in T2DM mice
由图2 可知,DC 组小鼠空腹血糖水平在整个灌胃期间持续升高。灌胃1 周后,Met 组及饮料干预组小鼠空腹血糖持续下降。复合饮料干预5 周后,BL、BM、BH 组小鼠的空腹血糖分别下降了26.64%、38.49%、36.80%。
2.3 复合饮料对Ⅱ型糖尿病小鼠口服葡萄糖耐量的影响
复合饮料对T2DM 小鼠口服葡萄糖耐量曲线及其曲线下面积的影响见图3。

图3 复合饮料对T2DM 小鼠口服葡萄糖耐量曲线及其曲线下面积的影响Fig.3 Effects of beverage on OGTT and area under the curve in T2DM mice
由图3 可知,灌胃葡萄糖120 min 后,DC 组血糖稍有下降但仍未恢复至初始水平。与DC 组相比,BL、BM、BH 组的曲线下面积值分别降低了11.55%、19.81% 和14.11%(P<0.001),BM 组效果最佳。上述结果表明复合饮料可以改善T2DM 小鼠葡萄糖的吸收状况,降低餐后血糖水平。
2.4 复合饮料对Ⅱ型糖尿病小鼠血清胰岛素水平的影响
复合饮料对T2DM 小鼠血清胰岛素水平和胰岛素抵抗指数的影响见图4。

图4 复合饮料对T2DM 小鼠血清胰岛素水平和胰岛素抵抗指数的影响Fig.4 Effects of beverage on serum insulin level and HOMA-IR in T2DM mice
由图4 可知,与NC 组相比,DC 组小鼠的血清胰岛素水平高度显著升高(P<0.001),说明小鼠出现胰岛素抵抗症状。饮料干预组小鼠血清胰岛素水平与胰岛素抵抗指数均高度显著降低(P<0.001)。上述结果表明复合饮料能够提高胰岛素敏感性,改善胰岛素抵抗。
2.5 复合饮料对Ⅱ型糖尿病小鼠胰高血糖素样肽-1水平的影响
复合饮料对T2DM 小鼠血清胰高血糖素样肽-1 水平的影响见图5。
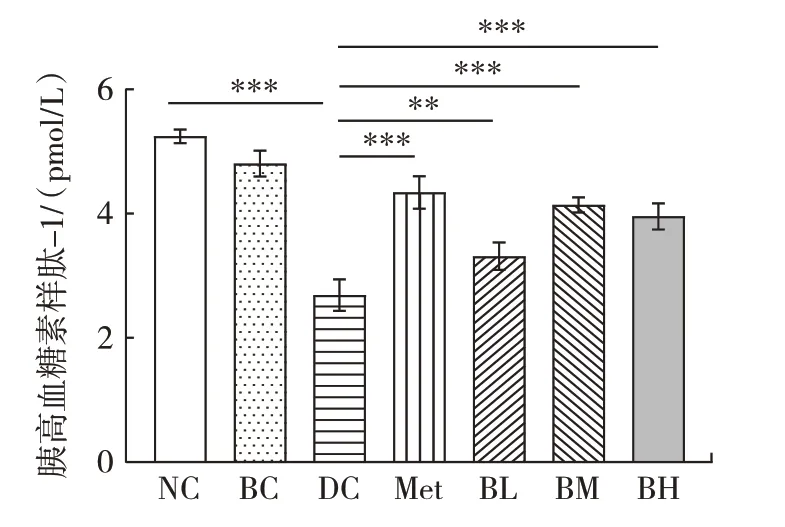
图5 复合饮料对T2DM 小鼠血清胰高血糖素样肽-1 水平的影响Fig.5 Effects of beverage on serum GLP-1 level in T2DM mice
由图5 可知,与NC 组相比,DC 组小鼠血清胰高血糖素样肽-1 水平高度显著降低(P<0.001),说明小鼠胰高血糖素样肽-1 代谢紊乱,不能有效调控血糖。与DC 组相比,Met、BL、BM、BH 组小鼠血清胰高血糖素样肽-1 水平均高度显著升高(P<0.01),分别升高了61.60%、23.04%、53.90%、46.84%。
2.6 复合饮料对Ⅱ型糖尿病小鼠糖化血清蛋白水平的影响
复合饮料对T2DM 小鼠糖化血清蛋白水平的影响见图6。

图6 复合饮料对T2DM 小鼠糖化血清蛋白水平的影响Fig.6 Effects of beverage on GSP level in T2DM mice
由图6 可知,与NC 组相比,DC 组小鼠糖化血清蛋白水平高度显著升高(P<0.001)。与DC 组相比,BM、BH 组小鼠糖化血清蛋白水平均高度显著降低(P<0.001),分别降低了32.80%、29.53%。表明复合饮料能够较好的控制小鼠血糖水平的升高。
2.7 复合饮料对Ⅱ型糖尿病小鼠肝脏组织病理学的影响
复合饮料对T2DM 小鼠肝脏组织形态学影响见图7。

图7 复合饮料对T2DM 小鼠肝脏组织形态学影响Fig.7 Effects of beverage on liver morphology in T2DM mice
由图7 可知,NC 组与BC 组小鼠肝脏组织结构正常,细胞排列整齐紧密,肝细胞胞核清晰。DC 组小鼠的肝脏组织结构重度异常,肝细胞大面积重度脂肪变性,肝实质内可见炎症细胞浸润。复合饮料干预组小鼠肝胞质内脂滴数量明显减少,肝实质内未见炎症。
2.8 复合饮料对Ⅱ型糖尿病小鼠胰腺组织病理学的影响
复合饮料对T2DM 小鼠胰腺组织形态学影响见图8。
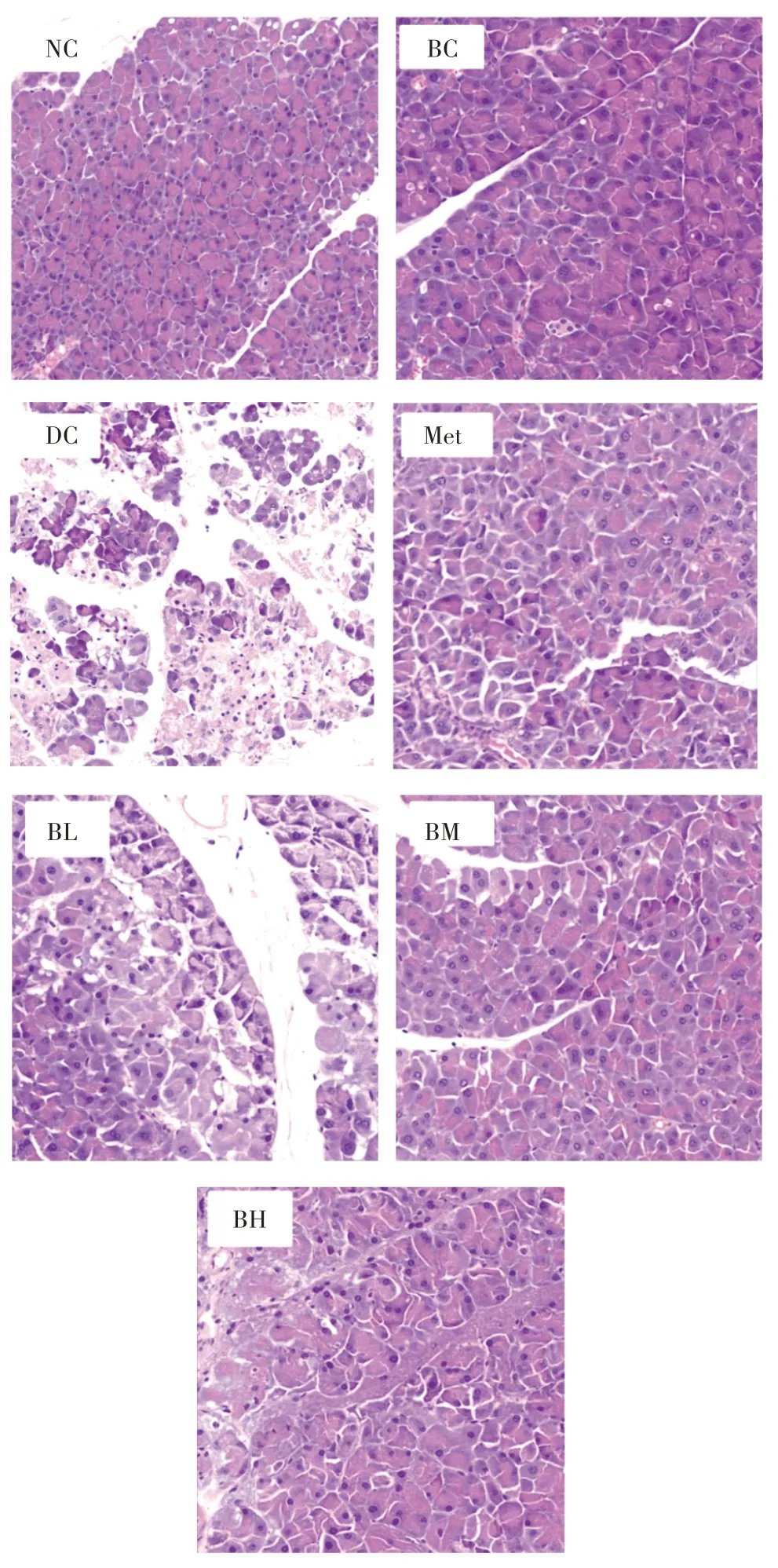
图8 复合饮料对T2DM 小鼠胰腺组织形态学影响Fig.8 Effects of beverage on pancreas morphology in T2DM mice
由图8 可知,NC 组与BC 组小鼠胰腺组织结构正常,腺泡细胞胞核清晰,胞质丰富。DC 组小鼠胰腺组织结构重度异常,视野内组织结构紊乱,大面积腺泡细胞坏死,个别腺泡细胞内可见空泡。复合饮料干预组小鼠胰腺组织结构轻度异常,视野内组织结构紧密,少量腺泡细胞坏死,以中剂量组作用效果最为明显。
2.9 复合饮料对Ⅱ型糖尿病小鼠肝脏胰岛素通路关键基因表达的影响
复合饮料对胰岛素受体(insulin receptor,IR)、胰岛素受体底物-1(insulin receptor substrate-1,IRS-1)、胰岛素受体底物-2(insulin receptor substrate-2,IRS-2)mRNA 表达的影响见图9。
由图9 可知,与NC 组相比,DC 组小鼠肝脏中IR、IRS-1、IRS-2 的表达量均高度显著下调(P<0.001),说明模型组小鼠胰岛素转运信号传递受阻。复合饮料干预组的肝脏IR、IRS-1 的mRNA 表达量与DC 组相比显著上调(P<0.05),而IRS-2 的mRNA 表达水平无显著性差异(P>0.05)。BM、BH 组与Met 组小鼠肝脏中IR 的表达水平无显著性差异(P>0.05)。此外,与阳性对照组相比,实验组小鼠肝脏中IRS-1、IRS-2 的表达量均显著下调。综上结果表明复合饮料可能通过上调IR和IRS-1 的mRNA 表达水平来提升Ⅱ型糖尿病小鼠胰岛素信号转导,进而促进葡萄糖转运,缓解血糖水平。
3 讨论
桑叶中的各种成分已被证明具有降血糖活性,包括1-脱氧野尻霉素(1-deoxynojirimycin,1-DNJ)、类黄酮、多糖,绿原酸和芦丁等[33],其中黄酮类化合物被证明能够抑制糖尿病大鼠的小肠双糖酶,1-DNJ 可以通过抑制α-葡萄糖苷酶来降低糖尿病模型小鼠的血糖水平[34]。
桑叶多糖被证明在体外实验中具有清除羟基自由基和超氧阴离子自由基效应,并可以通过清除自由基和修复被破坏的胰腺β 细胞来保护糖尿病小鼠的胰岛免受损伤,并修复被破坏的胰β 细胞[35]。
怀山药中多糖含量丰富[36],Zhang 等[37]通过体外实验测定怀山药多糖对α-淀粉酶抑制作用效果,验证了怀山药多糖的降血糖功效,Fan 等[38]发现怀山药多糖可增加糖尿病小鼠的抗氧化酶活性水平。它被认为是预防胰腺β 细胞氧化损伤的膳食自由基清除剂的重要作用。
Wang 等[39]的试验结果表明青钱柳活性提取物具有降血糖以及改善口服糖耐量的功效。青钱柳多糖和黄酮的降血糖机制,一方面可能是通过调节肝脏糖代谢,增加肝糖原合成及葡萄糖消耗量,抑制糖异生作用,进而降低血糖浓度;另一方面,可能是通过增加胰岛细胞数目,增大胰岛细胞面积,减轻胰岛细胞变性程度,恢复病变胰岛细胞的结构和功能,调节代谢,从而起到治疗糖尿病的作用[40]。
通过建立链脲佐菌素注射建立Ⅱ型糖尿病小鼠模型,来评估复合饮料的体内降血糖效果,结果发现复合饮料能够降低糖尿病小鼠空腹血糖值,其中与模型组相比中剂量饮料组小鼠空腹血糖下降了38.49%、糖化血清蛋白水平显著升高了53.90%、糖化血清蛋白水平也显著降低了32.80%、小鼠肝脏、胰腺组织形态未见明显损伤,因此复合饮料可能通过抑制α-葡萄糖苷酶活性、提升胰岛素信号转导,促进葡萄糖转运治疗等机制来缓解Ⅱ型糖尿病及一系列并发症。
4 结论
研究采用高脂饲喂联合STZ 注射建立T2DM 小鼠模型,通过灌胃复合饮料探究其对T2DM 的糖脂代谢调节作用及剂量效应关系,并从分子水平进一步探究复合饮料调控T2DM 小鼠胰岛素转运通路关键基因的mRNA 表达的作用机制。结果表明复合饮料具有良好的降血糖功效。小鼠“三多一少”症状、空腹血糖值、血清胰岛素水平、糖化血清蛋白水平、血脂水平、肝脏及胰腺组织损伤均得到改善。复合饮料可能通过上调IR 和IRS-1 的mRNA 表达水平来提升胰岛素信号转导,进而促进葡萄糖转运。综上所述,该植物复合饮料可调节小鼠糖脂代谢,促进胰岛素信号传递,进而调控机体葡萄糖转运代谢水平。
