豌豆蚜几丁质脱乙酰酶(ApCDAs)的鉴定及表达特性
2024-03-28陶妍李春春张克信孔利利刘长仲
陶妍 李春春 张克信 孔利利 刘长仲


摘 要 通过BLAST比对和软件分析,共筛选出4个豌豆蚜(Acyrthosiphon pisum)几丁质脱乙酰基因 ( ApCDA1、 ApCDA2、 ApCDA3和 ApCDA5),并分析了其生物学信息;通过实时荧光定量PCR技术,发现4个ApCDAs在各發育阶段均有表达,其中, ApCDA1基因在1龄、2龄若虫和成虫期表达量较高; ApCDA2基因在4龄若虫的表达量高于其他龄期; ApCDA3基因在各发育阶段后期的表达量显著高于前期和中期,2龄若虫后期表达量最高; ApCDA5基因在3龄若虫的表达量偏高,2龄后期的表达量最高;此外, ApCDA1和 ApCDA3在3龄若虫和成虫中肠、胚胎和表皮内的表达量均显著高于 ApCDA2和 ApCDA5。结果表明,ApCDAs基因对豌豆蚜的生长发育和蜕皮具有重要作用。
关键词 豌豆蚜;几丁质脱乙酰酶;表达模式;RT-qPCR
豌豆蚜(Acyrthosiphon pisum)是一种重要的农业害虫,属蚜科(Aphididae)无网管蚜属(Acyrthosiphon),为害香豌豆、蚕豆、苜蓿、草木犀、大豆等草本豆科植物[1]。另外,豌豆蚜还可以传播苜蓿花叶病毒和豌豆耳突花叶病毒等多种植物病毒[2],对农业生产造成重大损失。长期以来,蚜虫的防治主要依靠化学农药,然而,大面积使用化学农药,致使大量天敌被杀,3R问题日渐严重[3-4],生物农药具有低毒、无残留、不易产生抗药性等特点,为蚜虫治理的首选杀虫剂。目前,豌豆蚜作为模式蚜虫其基因组测序已完成[5],为豌豆蚜的生物防治和进一步的分子试验奠定了基础。
几丁质(Chitin)又称甲壳素、壳多糖[6],主要存在于昆虫的表皮、中肠、围食膜、体壁和气管上皮中,在昆虫的生长发育过程中,保护其免受病原物等的侵害[7-8]。几丁质对昆虫而言,不仅有支撑、保护和抵御环境压力的作用[9],也与昆虫的蜕皮及翅的形成密切相关[10]。研究表明,在褐飞虱中几丁质含量越少,脱皮越困难,翅的表型越畸形[10]。在昆虫中,几丁质传统上被认为是表皮、气管和营养基质的中心成分。然而,最近一些研究报道,与几丁质相关的基因在几种昆虫物种的卵巢、卵和蛋壳中表达[11-13]。因此在生物防治中,几丁质代谢的关键酶成为了潜在的绿色农药 靶标。
几丁质脱乙酰酶(Chitin deacetylase,CDA) 是几丁质降解酶系成员之一,能够催化几丁质水解,转化为壳聚糖[14-15]。几丁质脱乙酰酶(CDA)的主要作用底物有几丁质、壳聚糖、壳寡糖等[16] 。由于CDA的来源不同, 其酶学性质也存在差异性。到目前为止, 自然界所发现的CDA都是糖蛋白。2005年,Guo等[17]首次从粉纹夜蛾[Trichoplusia ni (Hübner)]中筛选得到几丁质脱乙酰酶(TnPM-P42),并发现该蛋白与几丁质结合紧密。研究发现,黄野螟(Heortia vitessoides)、粉纹夜蛾(Trichoplusia ni)、黑腹果蝇(Drosophila melanogaster)和赤拟古盗(Tribolium castaneum)等在表皮的形成过程中均受到CDAs的影响[17-20],且 CDA3在亚洲柑橘木虱的3龄若虫和表皮中高表达[21], CDA5在暗黑鳃金龟幼虫中高表达。目前,几丁质脱乙酰酶的研究已经应用于多种昆虫[18-24],其中包括豌豆蚜。
几丁质脱乙酰酶通过控制几丁质的代谢,进而控制其生长机制,是生物防治的作用靶标。本研究筛选ApCDAs基因,分析ApCDAs基因的基本信息,构建系统发育树,使用实时荧光定量PCR(RT-qPCR)方法分析ApCDAs基因在不同发育阶段及不同组织中的表达模式,为进一步探究ApCDAs的生理功能奠定了理论基础,为豌豆蚜的生物防治提供新思路。
1 材料与方法
1.1 供试材料
植物材料:蚕豆品种‘临蚕6号购买于甘肃省农业科学院,蚕豆种子种植到带土(土壤∶草炭∶蛭石=3∶2∶1)的塑料花盆(直径9 cm,每盆育苗4株)中。盆栽蚕豆在无虫的光照培养箱中培养,温度20 ℃±1 ℃,相对湿度70%±10%,光暗周期为 16 h L∶8 h D。选取生长发育一致的蚕豆叶片用于试验。
供试虫源及饲养条件:豌豆蚜采集于甘肃农业大学昆虫实验室,多代培养。在光照培养箱中培养,温度20 ℃±1 ℃,相对湿度70%±10%,光暗周期为 16h L∶ 8h D(未接触任何杀虫剂),采用蚕豆叶片饲养。
1.2 序列比对及分析
在豌豆蚜数据库中下载豌豆蚜几丁质脱乙酰酶基因的数据信息,通过NCBI网站上的BLAST在线程序进行基因的搜索及比对,下载豌豆蚜及其他昆虫的CDA基因,在SMART (https:∥smart.embl.de) 网站中进行豌豆蚜几丁质脱乙酰酶的蛋白质结构域进行分析;使用在线网站 ExPASy(https://web.expasy.org/protparam/)预测氨基酸的等电点和分子质量,以DNAMAN 8和MEGA 7进行序列比对及系统发育树的 建立。
1.3 样品的准备
取生长状况良好的成蚜在放有蚕豆叶片的培养皿中进行繁殖,每个培养皿中放入10头成蚜,产蚜3 h后移去成蚜,收取不同龄期若蚜的前期、中期和后期样品,以及成蚜产蚜前和产蚜后样品;并对3龄若蚜和成蚜进行解剖收样,收取其中肠、胚胎和表皮。将所收取的样品迅速放入液氮中冷冻,并置于-80 ℃冰箱,备用。
1.4 总RNA的提取及cDNA的合成
将-80 ℃冰箱中的样品取出,采用TRIzol法(Invitrogen,TRIzolReagent)提取豌豆蚜样品的RNA,使用微量分光光度计对提取到的RNA进行浓度及纯度检测,合格的置于-80 ℃冰箱,备用。取1 μg质检合格的RNA,使用TaKaRa反转录试剂盒对提取到的RNA进行反转录,得到cDNA的第1条链,具体方法参考TaKaRa反转录试剂盒说明书。将反转录产物置于-20 ℃冰箱,备用。
1.5 引物的设计及RT-qPCR反应
根据基因序列信息,使用Primer Premier 6设计基因的引物,并在NCBI网站进行比对,以确保该引物只对该基因一处位点起作用(如表1),通过查阅文献确定内参基因[25]。以反转录获得的cDNA为模板,使用表1 中的引物序列和TIANGEN试剂盒进行实时荧光定量PCR测定。利用2-△△CT方法对豌豆蚜不同发育阶段和3龄若虫及成虫不同组织的几丁质脱乙酰酶基因的表达量进行分析[26]。使用Microsoft Excel 2021和SPSS 26.0软件统计试验数据,采用单因素方差分析法(ANOVA)进行差异显著性分析。
2 结果与分析
2.1 豌豆蚜CDA蛋白质序列分析和系统发育树分析
通过在NCBI网站上的BLAST在线程序进行基因的搜索及比对,共得到4个ApCDAs基因(表2),4个豌豆蚜几丁质脱乙酰酶基因所编码的氨基酸长度为479~998 bp,蛋白分子质量为 54.49~112.65 ku,理论等电点为5.12~7.23。
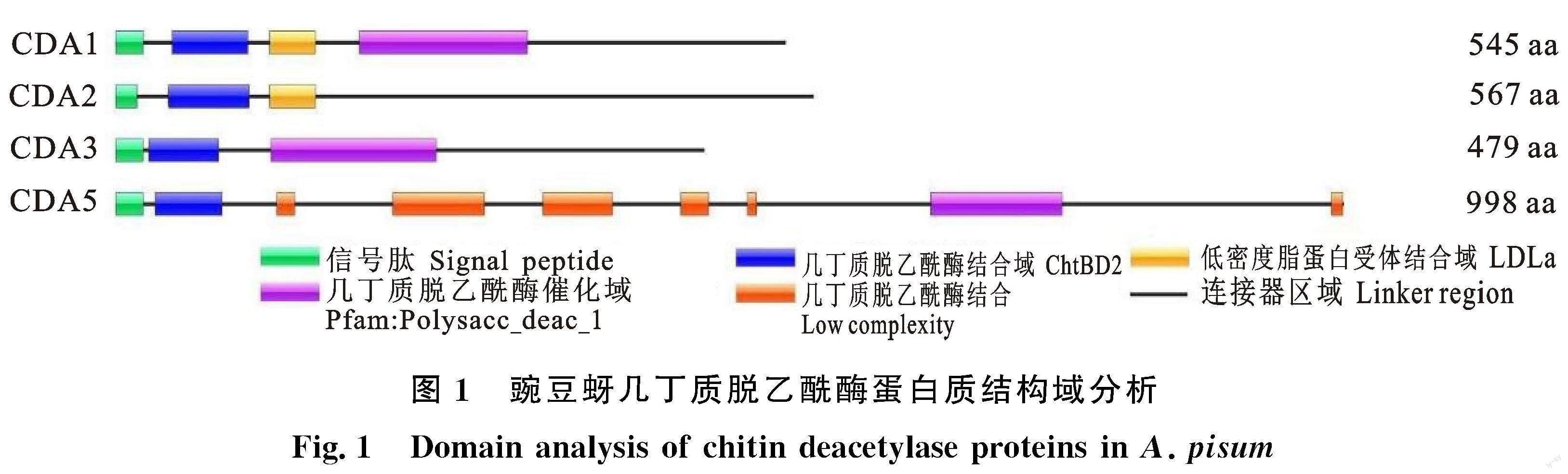
豌豆蚜几丁质脱乙酰酶的蛋白质结构(图1),蛋白质ApCDA1、 ApCDA2、 ApCDA3和ApCDA5均有1个信号肽在起始位点处,且均有1个几丁质脱乙酰酶结合域,ApCDA1、 ApCDA3和ApCDA5具有几丁质脱乙酰酶催化域,仅有ApCDA1和ApCDA2具有低密度脂蛋白受体结构域,ApCDA5具有6处低复杂度区域。
将豌豆蚜与其他昆虫的CDA进行比对,基于邻位归并法(NJ)和Kimura-2参数模型构建系统发育树(图2)。豌豆蚜的 CDA1基因与普通草蛉(Chrysoperla carnea)、烟草甲(Lasioderma serricorne)及白魔按蚊(Anopheles albimanus)的 CDA1基因聚在一起,美国白蛾(Hyphantria cunea)、甜菜夜蛾(Spodoptera exigua)和云杉色卷蛾(Choristoneura fumiferana)的 CDA2聚在一起,稻纵卷叶螟(Cnaphalocrocis medinalis)和黄野螟(Heortia vitessoides)的 CDA2聚在一起,赤拟古盗(Tribolium castaneum)、中华盗蝗(Oxya chinensis)和东亚飞蝗(Locusta migratoria)的 CDA2聚在一起,这些昆虫又与豌豆蚜的 CDA2基因聚在一起,豌豆蚜的 CDA3与白背飞虱(Sogatella furcifera)和褐飞虱(Nilaparvata lugens)的 CDA3聚在一起, CDA5与赤拟古盗和黑腹果蝇(Drosophila melanogaster)的 CDA5聚在一起,表明所筛选基为豌豆蚜CDA基因,豌豆蚜 CDA2基因与其他昆虫的 CDA2基因亲缘关系较远,且通过系统发育树证明豌豆蚜CDA基因与白背飞虱及褐飞虱的CDA基因亲缘关系 较近。[FL)]
2.2 豌豆蚜CDA基因的时空表达
2.2.1 不同龄期的表达模式 通过实时荧光定量PCR检测几丁质脱乙酰酶基因在不同发育阶段(1龄、2龄、3龄、4龄若蚜和成蚜)的不同时期(前期、中期和后期)的特异性表达模式,ApCDAs基因在所收集的所有豌豆蚜样本中均有表达(图3),表明ApCDAs在均参与了豌豆蚜的几丁质代谢过程。所有4个ApCDAs在3龄和4龄均在中期的表达量最低; ApCDA3、 ApCDA5在1龄和2龄前中后的表达量逐渐升高;除了 ApCDA3外,其余3个ApCDAs在成虫产蚜后的表达量均高于产蚜前。
ApCDA1在2龄中期的表达量最高,且显著高于后期(P<0.05),后期的表达量又显著高于前期(P<0.05);在4龄前中后其的表达量均低于其他龄期;在1龄后期的表达量显著高于中期(P<0.05),中期的表达量又显著高于前期(P<0.05);成蚜的表达量明显高于其他ApCDAs(图3-A)。
ApCDA2在各个龄期的表达(图3-B)有所不同,在4龄若虫的前、中、后期表达量均最高,成蚜的表达量最低,且明显低于其他ApCDAs;与其他龄期不同,1龄若虫在中期的表达量最高,前期的表达量最低;2龄若虫后期的表达量显著高于中期(P<0.05),中期的表达量又显著高于前期(P<0.05)。
ApCDA3在2龄若虫后期的表达量最高,且3龄、4龄若虫和成虫的表达量无明显差异;3龄和4龄若蚜后期的表达量显著高于中期(P< 0.05),且前期与中期及后期的表达量差异显著(图3-C)。
ApCDA5在2龄后期表达量最高,成蚜的表达量最低;3龄若蚜前中后期表达量无显著差异,3龄和4龄若虫在前期的表达量最高,中期的表达量最低(图3-D)。
2.2.2 不同組织的表达模式 通过实时荧光定量PCR检测ApCDAs基因在不同组织中的表达模式,结果表明,ApCDAs基因在豌豆蚜的中肠、胚胎及表皮中均有表达,但表达水平存在差异(图4)。 ApCDA1和 ApCDA3在3龄若虫和成虫的中肠、胚胎以及表皮的表达量均高于 ApCDA2和 ApCDA5,且 ApCDA5在3龄若虫和成虫中的表达量均最低。在3龄若虫中,ApCDAs在表皮中的表达量均显著高于中肠和胚胎(P<0.05),且每个基因在胚胎和表皮中的表达无显著差异。
不同ApCDAs在成蟲不同组织的表达模式显示, ApCDA1在胚胎的表达量显著高于表皮 (P<0.05),在表皮的表达量又显著高于中肠 (P<0.05); ApCDA2和 ApCDA3在胚胎和表皮的表达量显著高于中肠(P<0.05),且 ApCDA3在中肠、胚胎及表皮的表达量均高于其他基因,胚胎和表皮无显著差异,但胚胎的表达量略高于表皮; ApCDA5在表皮的表达量显著高于中肠和胚胎(P<0.05),中肠与胚胎间的表达量无显著差异,且该基因在中肠、胚胎和表皮的表达量 极低。
3 讨 论
几丁质是昆虫外骨骼的主要组成成分,在生长发育过程中作用重大[8]。几丁质脱乙酰酶是几丁质代谢过程中的重要酶类之一[27],在生物防治中,已经被证明其为杀虫剂的潜在靶标[22],可通过抑制该酶有效控制害虫[23]。豌豆蚜为害范围广[5],造成的经济损失严重,可通过抑制该酶有效控制豌豆蚜。本试验通过ApCDA基因的搜索和BLAST比对筛选了4个豌豆蚜几丁质脱乙酰酶基因,分别为 ApCDA1、 ApCDA2、 ApCDA3和 ApCDA5,分析发现该基因的氨基酸序列与昆虫脱乙酰酶的氨基酸序列相符,表明筛选得到的氨基酸序列为豌豆蚜几丁质脱乙酰酶序列。系统发育树分析发现, ApCDA3与白背飞虱和褐飞虱的CDA亲缘关系较近。作为调控蚜虫代谢的重要基因之一,研究该基因的功能,既可了解豌豆蚜的发育,又可评估其在害虫防治中的用途。
因此,本试验主要对ApCDAs的时空表达进行研究,分析其在豌豆蚜不同发育时期及不同组织内的表达模式。通过实时荧光定量PCR发现,4个ApCDAs基因在豌豆蚜每一个发育阶段及组织内均有表达,且具有不同的表达特点。 ApCDA1和 ApCDA2基因与黄野螟几丁质脱乙酰酶 CDA1和 CDA2基因的表达相似[18],在成虫和3龄若虫的中肠表达量均最低,3龄若虫的表皮表达量最高,且在蜕皮前(后期)表达量上升, ApCDA1和 ApCDA2基因与表皮的形成有关,在成虫胚胎的表达量最高,因为豌豆蚜需在成虫期进行产蚜,胚胎比若虫期更为发达,表达量最高。亚洲柑橘木虱 CDA3基因在表皮表达量最高,中肠表达量最低[21],与 ApCDA3基因在3龄若蚜表达量一致,成虫在胚胎表达量高于表皮,原因与 ApCDA1和 ApCDA2基因一致,亚洲柑橘木虱共有包括卵在内的6个发育阶段,在3龄若虫的表达量最高,而豌豆蚜与其发育历期不同,所以最高表达量出现在2龄后期。暗黑鳃金龟幼虫和赤拟谷盗的 CDA5基因在中肠的表达量最高[20,22,24],稻纵卷叶螟的 CDA5基因参与蜕皮,在表皮中的表达量最高,朱砂叶螨的 CDA5在卵期的表达量最高[28], ApCDA5基因在3龄稳定表达,且表达量较高,3龄若虫和成虫与稻纵卷叶螟一致,均在表皮表达量最高。
总之,本试验通过RT-qPCR检测,证明ApCDAs基因在豌豆蚜不同发育阶段和组织中均有表达,表达量上有相似性,但又存在许多差异。CDA基因已被证明是杀虫剂的潜在靶标,本试验结果补充了ApCDAs基因家族的数据,为基于靶向杀虫基因的筛选奠定基础,并为ApCDAs蛋白为靶标的豌豆蚜生物防治提供了理论支撑。
4 结 论
筛选了豌豆蚜几丁质脱乙酰酶基因( ApCDA1、 ApCDA2、 ApCDA3和 ApCDA5),并获得其cDNA的全长序列;分析了其蛋白质结构域,建立了与其相关的系统发育树;通过RT-qPCR测定了不同发育阶段及不同组织的表达量,推测ApCDAs基因参与了豌豆蚜蜕皮和新表皮的形成过程。
参考文献 Reference:
[1] 刘靖涛,王 倩,赵 瑞,等.豌豆蚜触角转录组化学感受蛋白的鉴定,表达和结合特性分析[J].昆虫学报,2022, 65(3):261-270.
LIU J T,WANG Q,ZHAO R,et al. Identification,expression and binding specificity of chemosensory proteins in the antennal transcriptome of the pea aphid,Acyrthosiphon pisum (Hemiptera:Aphididae)[J].Acta Entomologica Sinica,2022,65(3):261-270.
[2] NAULT B A,SHAH D A,DILLARD H R,et al.Seasonal and spatial dynamics of alate aphid dispersal in snap bean fields in proximity to alfalfa and implications for virus management[J].Environmental Entomology,2004,33(6):1593-1601.
[3] CHKHUBIANISHVILI T,KAKHADZE M,MALANIA I,et al.Potential of Lecanicillium spp.for use against the melon aphid and cucumber powdery mildew[C]∥This meeting was supported by the “COST Action 862” Bacterial Toxins for Insect Control,2009,45:259-262.
[4] GAO Y,LEI Z,REITZ S R.Western flower thrips resistance to insecticides:detection,mechanisms and management strategies [J].Pest Management Science,2012,68(8):1111-1121.
[5] International Aphid Genomics Consortium.Genome sequence of the pea aphid Acyrthosiphon pisum[J].PLoS biology,2010,8(2):e1000313.
[6] SPINDLER K D,SPINDLER-BARTH M,LONDERSHAUSEN M.Chitin metabolism:a target for drugs against parasites [J].Parasitology Research,1990,76(4):283-288.
[7] HOGENKAMP D G,ARAKANE Y,ZIMOCH L,et al.Chitin synthase genes in Manduca sexta:characterization of a gut-specific transcript and differential tissue expression of alternately spliced mRNAs during development [J].Insect Biochemistry and Molecular Biology,2005,35(6):529-540.
[8] MARGUERITE,RINAUDO.Chitin and chitosan:Properties and applications [J].Progress in Polymer Science,2006,31(7):603-632.
[9] MERZENDORFER H,ZIMOCH L.Chitin metabolism in insects:structure,function and regulation of chitin synthases and chitinases[J].Journal of Experimental Biology,2003,206(24):4393-4412.
[10] 楊萌萌.海藻糖酶及其抑制剂(Validamvcin)对褐飞虱海藻糖和几丁质代谢的调控研究[D].杭州:杭州师范大学,2016
YANG M M,Regulating effects of trehalase and its inhibitor (Validamycim) on the trehalose and chitin metabolism in Nilaparvata lugens [D].Hangzhou:Hangzhou Normal University,2016.
[11] MOREIRA M F,SANTOS A,MAROTTA H R,et al.A chitin-like component in Aedes aegypti eggshells,eggs and ovaries [J].Insect Biochemistry and Molecular Biology,2007,37(12):1249-1261.
[12] SOUZA-FERREIRA P S,MANSUR J F,BERNI M, et al.Chitin deposition on the embryonic cuticle of Rhodnius prolixus:the reduction of CHS transcripts by CHS-dsRNA injection in females affects chitin deposition and eclosion of the first instar nymph [J].Insect Biochemistry and Molecular Biology,2014,51:101-109.
[13] ARAKANE Y,SPECHT C A,KRAMER K J,et al.Chitin synthases are required for survival,fecundity and egg hatch in the red flour beetle,Tribolium castaneum [J].Insect Biochemistry and Molecular Biology,2008,38(10):959-962.
[14] KRAMER K J,KOGA D.Insect chitin:physical state,synthesis,degradation and metabolic regulation [J].Insect Biochemistry,1986,16(6):851-877.
[15] ZHAO Y,RO-DONG P,MUZZARELLI R.Chitin deac- etylases:properties and applications [J].Marine Drugs,2010,8(1):24-46.
[16] 张 岩,关菲菲,伍宁丰,等.几丁质脱乙酰酶的研究进展[J].生物技术通报,2019,35(11):179-186.
ZHANG Y,GUAN F F,WU N F,et al. Research progress on chitin deacetylase [J].Biotechnology Bulletin,2019,35(11):179-186.
[17] GUO W,LI G,PANG Y,et al.A novel chitin-binding protein identified from the peritrophic membrane of the cabbage looper,Trichoplusia ni[J].Insect Biochemistry and Molecular Biology,2005,35(11):1224-1234.
[18] 王春燕.黄野螟几丁质脱乙酰基酶CDA1和CDA2基因的表達分析及功能研究[D].广州:华南农业大学,2019
WANG CH Y.Expression and function analysis of Chitin Deacetylase(CDA1/2)in Heortia vitessoides (Lepidoptera:Crambidae) [D].Guangzhou:South China Agricultural University,2019.
[19] LIU S H,LI H F,YANG Y,et al.Genome-wide identification of chitinase and chitin deacetylase gene families in the oriental fruit fly,Bactrocera dorsalis (Hendel)[J].Comparative Biochemistry and Physiology Part D:Genomics and Proteomics,2018,27:13-22.
[20] DIXIT R,ARAKANE Y,SPECHT C A,et al.Domain organization and phylogenetic analysis of proteins from the chitin deacetylase gene family of Tribolium castaneum and three other species of insects [J].Insect Biochemistry and Molecular Biology,2008,38(4):440-451.
[21] YU H Z,LI N Y,LI B,et al.Immune functional analysis of chitin deacetylase 3 from the asian citrus psyllid Diaphorina citri [J].International Journal of Molecular Sciences,2020,21(1):64.
[22] JAKUBOWSKA A K,CACCIA S,GORDON K H,et al.Downregulation of a chitin deacetylase-like protein in response to Baculovirus infection and its application for improving Baculovirus infectivity [J].Journal of Virology,2010,84(5):2547-2555.
[23] 李 景,杨宝东,郭 巍.甜菜夜蛾几丁质脱乙酰酶基因 ( secda5)的原核表达及多克隆抗体制备[J].北京农学院学报,2016,31(1):38-41.
LI J,YANG B D,GUO W.Prokaryotic expression and polyclonal antibody preparation of chitin deacetylase ( secda5) from Spodoptera exigua [J].Journal of Beijing University of Agriculture,2016,31(1):38-41.
[24] 赵 丹,闫晓平,陆秀君,等.暗黑鳃金龟几丁质脱乙酰酶 HpCDA5基因的细胞表达及活性分析 [J].中国生物防治学报,2018,34(5):686-692.
ZHAO D,YAN X P,LU X J,et al.Expression and characteration of the Chitin Deacetylase 5 gene from Holotrichia parallela larvae [J].Chinese Journal of Biological Control,2018,34(5):686-692.
[25] 王文军.芥子油苷对豌豆蚜细胞色素P450s和谷胱甘肽S-转移酶诱导表达的影响[D].兰州:甘肃农业大学,2021
WANG W J.Effects of glucosinolates on induction of cytochrome P450s and glutathione S-transferase in pea aphid Acyrthosiphon pisum [D].Lanzhou:Gansu Agricultural University,2021.
[26] PFAFFL M W.A new mathematical model for relative quantification in real-time RT-PCR [J].Nucleic Acids Research,2001,29(9):e45.
[27] TSIGOS I,MARTINOU A,KAFETZOPOULOS D, et al.Chitin deacetylases:new,versatile tools in biotechnology [J].Trends in Biotechnology,2000,18(7):305-312.
[28] 宋莉紅,丁 超,陈 研,等.朱砂叶螨几丁质脱乙酰基酶 TecCDA5基因克隆及表达特征分析[J].北京农学院通报,2021,36(4):7-13.
SONG L H,DING CH,CHEN Y,et al.Molecular cloning and expression analysis of chitin deacetylase gene TecCDA5 from Tetranychus cinnabarinus [J].Journal of Beijing University of Agriculture,2021,36(4):7-13.
Identification and Expression of Aphid Chitin Deacetylases (ApCDAs) in Acyrthosiphon pisum
Abstract
Through BLAST and software analysis,we identified four chitin deacetylation genes ( ApCDA1, ApCDA2, ApCDA3 and ApCDA5) in Acyrthosiphon pisum,and analyzed their biological characteristics.Real-time PCR indicated that all four ApCDAs were expressed at developmental stages. ApCDA1 exhibited higher expression in first instar nymphs,second instar nymphs and adults,while ApCDA2 displayed higher expression in the fourth instar nymphs compared to other instars.The expression of ApCDA3 was significantly higher at the late stage of development than at the early and middle stages,with peak expression occurring at the late stage of the second instar nymphs.Furthermore,the expressions of ApCDA1 and ApCDA3 were significantly higher than those of ApCDA2 and ApCDA5 in the midgut,embryo and epidermis of third instar nymphs and adults.In summary,ApCDAs play a key role in the growth and development of pea aphid.
Key words Acyrthosiphon pisum; Chitin deacetylase; Expression pattern; RT-qPCR
