灵武长枣干腐病病原菌的分离鉴定及生物学特性研究
2024-03-28马乔女贾慧顾欣赵岩王新谱
马乔女 贾慧 顾欣 赵岩 王新谱


摘 要 为明确灵武长枣干腐病病原菌的种类及其生物学特性,通过对灵武长枣干腐病发病枝条采样,采用组织分离法进行病原菌分离,柯赫氏法则验证和形态学、分子生物学鉴定。结果表明:分离获得3株疑似病原菌,经柯赫氏法则验证确定GF1菌株为灵武长枣干腐病病原菌。依据形态学和分子生物学鉴定,确定GF1菌株为木贼镰孢菌(Fusarium equiseti)。GF1菌株菌丝生长的最适温度为25~30 ℃,最适pH为6;孢子萌发的最适温度为28 ℃,最适pH为7;光照条件有利于孢子萌发;孢子致死条件为55 ℃/20 min和60 ℃/ 10 min及以上处理。
关键词 灵武长枣;干腐病;病原菌;木贼镰孢菌
灵武长枣(Ziziphus jujuba Mill. cv. Lingwuchangzao)是宁夏特色经济林优良品种,原产地为宁夏灵武市。灵武长枣果实大、汁液多、质地酥脆,可食率达94%[1],具有显著的生态、社会与经济效益。该产业已成为当地农民增收致富的主要途径之一。
近年来,灵武长枣的设施栽培技术快速发展,但管理不当常引起果树病害。其中,灵武长枣干腐病已在灵武市多处设施温棚中出现。宁夏大学农业微生物资源开发与植物保护团队观察发现,该病害多发于树势较弱的果树,在枝干基部、接近嫁接口的部位最先发病。发病初期,枝条皮孔明显增大并向外突起,表皮变得粗糙,枝干上呈现淡紫色病斑,并逐渐沿枝干纵向扩展,直至整枝干枯。病斑处稍凹陷,严重时出现龟裂。病部与健部之间存在明显的界线。发病后期,病斑变为黑褐色,且表面密生黑色小点。干腐病病情较严重的树木,其木质部发生离层,皮层内侧呈褐色。因为病部发生腐烂干缩,疏导组织阻断,使地上部分呈现病态,如树势衰弱,树木无法正常萌发,不能正常开花坐果,叶片黄化、果实萎蔫且提早脱落。当病害严重时,会形成环绕树干茎部的病斑,疏导组织完全破坏,导致全树枯死。该病害已严重影响灵武长枣果树的生长和产量。
目前,枣树干腐病研究仅见山西枣树干腐病的相关报道[2-3]。山西省枣树干腐病的病原菌为壳梭孢属的七叶树壳梭孢菌(Fusicoccum aesculi)[2],其在发病后期,病斑为浅灰色,表皮皮孔无异常。在灵武长枣干腐病的发病后期,病斑呈灰黑色,表面密生黑色小点,皮孔突起。研究表明,病害的发生与作物品种特性、地域气候和栽培管理方式等有关,不同品种的枣树对同种病原菌的易感性具有差异,不同病原菌也可能导致植株表现出相似的病状[4-6]。因此,有必要明确灵武长枣干腐病的致病菌。目前,对该病害采用化学药剂进行防治,主要有世高、凯润和多菌灵等药[7]。冯慧静等[8]通过ISSR(inter- simple sequence repeat)技术对枣干腐病病原菌的群体组成进行研究,结果表明该群体具有丰富的遗传多样性,群体内多样性大于群体间多样性。这不仅有利于枣树抗性育种工作的顺利开展,同时也可以为更深入地了解病害发生规律和制定高效的病害防治策略奠定基础。
本研究拟对灵武长枣干腐病的病原菌进行分离与纯化,经柯赫氏法则确定致病菌,继而采用形态学和分子生物学技术对病原菌进行分类鉴定,并探明其基本生物学特性,为灵武长枣干腐病的科学防治提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 供试材料 灵武长枣干腐病发病枝条和健康枝条均采集于灵武市枣园设施温棚(东经 106°34′14″,北纬 38°127′34″,海拔高度1 113 m)。2021年3月,从具有干腐病病征(发病后期)的枣树上采集发病枝条样本20份,同时于未发病温棚采集健康枝条20份。用无菌密封袋密封,尽快带回试验室开展病原菌的分离。
1.1.2 主要仪器和供试培养基 LDZX-30FBS立式压力蒸汽灭菌锅(上海申安医疗器械厂),SW-CJ-2FD超净工作台(苏州安泰空气技术有限公司),RQX-250智能人工气候箱(浙江托普仪器有限公司),HH-2数显恒温水浴锅(常州润华电器有限公司),HeMa9600基因扩增仪(珠海黑马医学仪器有限公司)。马铃薯葡萄糖培养基(potato dextrose agar,PDA),用于菌株的分离、纯化、活化、保存及生物学特性研究。
1.2 试验方法
1.2.1 疑似病原菌的分离纯化 将发病枝条先用无菌水冲洗3~4次,再用体积分数75%酒精擦拭1~2次,使用无菌刀片将发病组织切成小块(0.5 cm×0.5 cm),在體积分数3%次氯酸钠溶液中浸泡3~5 min进行消毒,取出后再用无菌水冲洗3~5次。将处理好的病枝组织置于PDA平板中央,28 ℃,相对湿度(relative humidity,RH)85%,黑暗条件下培养5 d。用无菌接种针挑取菌落边缘的菌丝,转接至新PDA平板,如此进行 3~5次纯化培养,获得分离菌株的纯培养物。菌株活化条件为PDA培养基,28 ℃,RH 85%,光照培养。将活化培养5 d的菌株置于4 ℃保存。
1.2.2 孢子悬液的制备 按“1.2.1”方法活化疑似病原菌,于28 ℃,RH 85%,光照条件下培养 7 d,待菌落产生大量孢子。先用无菌接种针刮掉平板中的菌丝,再用少量无菌水冲洗平板3 次,收集冲洗液并补加无菌水至总体积为100 mL。室温条件下充分振荡(190 r·min-1,80 min)使孢子团分散,经8层无菌纱布过滤,用血球计数板确定孢子浓度,制备1×106 CFU·mL-1的孢子悬液。
1.2.3 致病性测定 依据柯赫法则,将疑似病原菌回接至健康枝条培养观察并与田间发病症状比较,再从具有典型发病症状的枝条病变部位分离菌株,分离菌株的方法同“1.2.1”,以确定致病菌株。分别采用实验室离体接种和田间活体接种两种方法对疑似病原菌进行致病性测定。
离体接种试验:选取新鲜健康、3 a~5 a生、生长状况相似的枝条,用无菌剪刀剪取12~ 15 cm表皮光滑无伤的枝条,先用体积分数75%乙醇擦拭2~3次,无菌水冲洗3次,用无菌滤纸将表面水分吸干。将直径5 mm圆形滤纸片进行高温灭菌。每张滤纸片上滴加孢子悬液0.05 mL制成带菌滤纸片。枝条打孔接种处理。用无菌打孔器(直径5 mm)在枝条上打孔,打孔的深度到木质部。将带菌滤纸片接种孢子的一面粘贴在枝条接种区上。在500 mL锥形瓶底部铺一层滤纸,下置脱脂棉经高压蒸汽灭菌处理。将无菌水注入脱脂棉,达到饱和状态;滤纸全部湿润,用于保持环境湿度。将接种后的枝条纵向置于锥形瓶内,提前用石蜡对枝条两头密封,可避免枝条与水直接接触而造成局部湿度过大,用透气封口膜扎紧烧杯口。以等量无菌水代替孢子悬液作对照。每处理10个重复。将试验装置置于28 ℃,RH 85%的恒温光照培养箱,12 L/12 D(12 h light/ 12 h darkness)培养14 d,观察枝条的发病情况。
田间活体接种试验:6-7月份,在田间选用健康的3 a~5 a生、生长状况相似的枝条,在枝条上选取20 cm的一段,先后用酒精擦洗2~3次,用无菌水冲洗2~3次。接种区打孔及接种方式同离体接种试验。接种后用保鲜膜包好接种区,防止杂菌的影响。以等量无菌水代替孢子悬液作对照。每个处理10个枝条,接种后第14 天观察、统计接种枣树枝条的发病情况。
依据离体接种试验和田间接种试验的结果,以枝条发病情况与枣干腐病病状相同的菌株为高度疑似病原菌,继而采用“1.2.1”的方法对回接发病的病枝进行病原菌的分离、纯化,通过与原接种的菌株比较,确定病原菌菌株。
1.2.4 病原菌的鉴定 形态学鉴定:活化纯培养菌株,条件同“1.2.1”。用平板培养法测定病原菌菌落的生长速度,以及菌落形态特征的观察。采用普通光学显微镜观察菌丝、分生孢子、分生孢子堆等形态特征并对其进行测量。依据《菌物字典》[9]和《中国真菌志》[10]对病原菌进行形态学鉴定。
分子鉴定:将病原菌接种在PDA培养基上,在28 ℃,RH 85%,光照条件下培养5 d收集菌丝体。将菌丝体溶解于50 mmol·L-1 NaOH溶液中,沸水浴15 min,恢复至室温,提取病原菌DNA。采用通用引物ITS引物,扩增体系有2 ×TsingKE Master Mix 25 μL,Forward primer(10 μmol·L-1)1.0 μL,Reverse Primer(10 μmol·L-1)1.0 μL和dH2O 22 μL,反应程序为94 ℃ 10 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1.5 min,30个循环。PCR扩增反应完毕后,取2 μL进行琼脂糖凝胶(质量体积分数为1%)电泳。经过PCR产物纯化,收集DNA,送至广州赛哲生物科技有限公司进行测序[11-13]。测序结果经BLAST比对和同源性分析,采用NJ法构建系统发育树。
1.2.5 培养温度对病原菌菌丝生长与孢子萌发的影响 利用无菌打孔器(直径5 mm)在培养 7 d的病原菌菌落边缘打取菌饼,接种至PDA平板中央,将平板分别置于15、20、25、30、35、40 ℃的恒温箱中保湿(RH 85%)光照培养,每个处理重复3次。记录菌落生长情况,以菌丝生长最快的培养温度为基准,选取临近温度再次培养病原菌,根据菌丝的生长速度变化,最终确定菌丝的最适生长温度范围。采用凹玻片培养法,在无菌凹玻片中注入0.01 mL病原菌孢子悬液,采用15、20、25、30、35、40 ℃的条件培养24、48 h后依次进行显微计数。每个凹玻片统计200个孢子中萌发的孢子数量。每处理3重复。孢子萌发率计算公式如下:
孢子萌发率=萌发孢子数/200×100%
1.2.6 培养基pH对病原菌菌丝生长与孢子萌发的影响 制备pH分别为4、5、6、7、8的PDA平板,按“1.2.4”方法接种病原菌菌饼并培养7 d,记录菌落生长情况。分别用1 mol·L-1的NaCl和NaOH试剂调节孢子悬液pH为4、5、6、7、8,按“1.2.4”方法进行凹玻片培养,统计孢子萌发率。每处理3次重复。
1.2.7 光照时间对病原菌菌丝生长与孢子萌发的影响 设置3种光照条件,分别为24 L(24 h light)、12 L/12 D(12 h light/12 h darkness)、 24 D (24 h darkness),其他方法同“1.2.4”,培养 7 d,记录PDA平板上菌落的生长情况,统计病原菌的孢子萌發率。每处理3个重复。
1.2.8 病原菌分生孢子致死温度和时间的测定 在无菌试管内加入1 mL病原菌孢子悬液,分别置于40、45、50、55、60 ℃的恒温水浴锅中,分别处理5、10、15、20、25、30 min后迅速水浴冷却至室温。取0.01 mL处理后的孢子悬液滴于凹玻片上,28 ℃,光照条件下,保湿培养48 h,统计孢子萌发率。
1.3 数据处理
采用SPSS 25.0软件进行方差分析与差异显著性检验(Duncans新复极差法),Microsoft excel 2010进行绘图与制表,MEGA 7.0建立菌株系统发育树。
2 结果与分析
2.1 病原菌的分离与致病性测定
分离获得疑似病原真菌3株,分别编号为GF1、GF2、GF3。在离体接种试验中,接种10~14 d,接种GF1菌株的枝条全部发病,症状与田间自然发病症状(图1-A、1-B)相似,即枝条表皮呈黑色,表面出现黑色小点,为病原菌的分生孢子堆(如图2-C);组织干枯,木质部产生离层,木质部和韧皮部分离,皮层内侧变褐(1-C、1-D)。GF2接种10~14 d后,接种部位出现砖红色病斑,病斑边缘有黑色的晕圈,木质部上出现浅褐色水渍状病斑,与田间自然发病症状不同,如图1-E。GF3菌株接种10~14 d后,接种部位无发病现象,接种部位的边缘仅出现黑圈,木质部没有发生病变,如图1-F。对照未发病。
在田间活体接种试验中,接种GF1的枣树有发病现象,发病率为60.00%,接种枝条的发病症状与自然发病症状相似,至14 d 可观察到典型病症(1-G)。GF2、GF3在田间无明显发病症状(1-H、1-I)。对接种GF1发病的枝条进行再次进行微生物的分离和鉴定,获得与GF1形态特征一致的菌株。
2.2 病原菌的形态学鉴定
GF1菌株在PDA培养基上,28 ℃,RH 85%,光照条件下的生长速度为12.86 mm·d-1。气生菌丝呈棉絮状。培养初期,菌落正反面均为白色;培养4~5 d,菌落表现呈黄褐色(图2-A),背面为深棕色(图2-B)。菌丝为光滑、透明的有隔菌丝,出现大孢子堆(图2-C)。培养期间,未观察到病原菌的小型分生孢子(图2-D)。大型分生孢子呈镰刀状,略微向内弯曲,两端呈锥形,基孢有足,有3~6个隔膜,孢子大小(6.52~ 16.50) μm×(2.42~5.39) μm。经形态学鉴定,初步判断GF1菌株为镰孢菌属(Fusarium sp.)真菌。
2.3 病原菌的分子鉴定
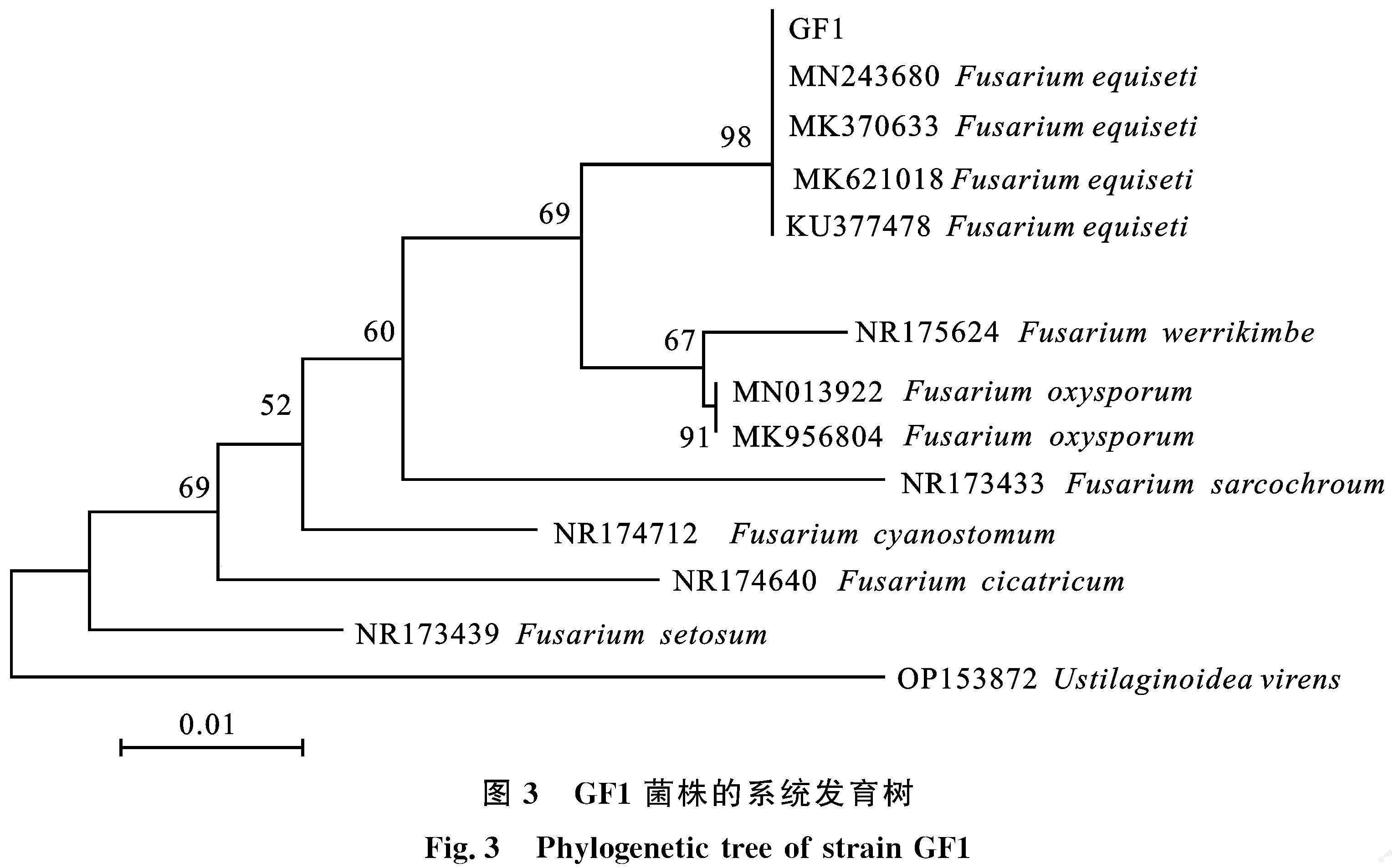
将GF1菌株的测序结果录入NCBI,获得Genbank编号MT348611。根据BLAST结果,构建GFI菌株的系统发育树,如图3。分析可知,GF1菌株的测序结果与Fusarium equiseti(Genbank编号:MK621018、MN243680、MK370633等)序列相似性达100%,通过CABI databases(http://www.speciesfungorum.org/Names/Names.asp)数据库对比分析,初步确定该菌分类地位为子囊菌门(Ascomycota)、粪壳菌纲(Sordariomycete)、肉座菌目(Hypocreales)、丛赤壳菌科(Nectriaceae)、镰孢菌属(Fusarium)、木贼镰孢菌(Fusarium equiseti)。
2.4 培养温度对病原菌菌丝生长和孢子萌发的影响
由表1可知,GF1菌丝在10 ℃~35 ℃环境中均可生长,其最适生长温度为25 ℃~30 ℃。培养3 d和5 d,25 ℃和30 ℃处理的菌落直径显著大于其他处理(P<0.05)。培养至第7 天, 25 ℃和30 ℃处理的菌落直径无显著差异 (P>0.05)。低于25 ℃,菌落直径显著降低 (P<0.05),说明温度对菌丝生长具有显著影响 (P<0.05)。温度对GF1的分生孢子萌发率影响较大,适宜萌发的温度为25 ℃~30 ℃。
2.5 培养基pH对病原菌菌丝生长和孢子萌发的影响
如表2, GF1菌株在pH为4~8的PDA培养基上均可生长。在pH为6和7处理中,培养 7 d的菌落直径达90.00 mm,显著高于其他处理(P<0.05),说明pH为6~7最适合菌丝生长。在pH为7的PDA中培养48 h,GF1的孢子萌发率达96.00 %,显著高于其他处理(P<0.05),说明孢子萌发的培养基最适pH为7。
2.6 光照对病原菌菌丝生长和孢子萌发的影响
光照有利于GF1的菌丝生长和孢子萌发(表3)。培养至第3天和第5天,24 L的菌落直径显著高于其他处理(P<0.05),说明其最有利于菌丝生长。至第7天,各处理的菌落直径无显著差异(p>0.05)。光照条件对GF1的孢子萌发影响较大。培养24 h,24 L和12 L/12 D的孢子萌发率显著高于24 D(P<0.05)。培養48 h,24 L处理的孢子萌发率为87.00 %,显著高于其他处理(P<0.05)。说明,24 L的光照条件最有利于分生孢子的萌发。
2.7 病原菌分生孢子的致死温度和时间
由表4可知,随着温度和高温处理时间的增加,孢子萌发率呈下降趋势。处理15~25 min时,60 ℃处理的孢子萌发率为零,50 ℃和55 ℃处理的孢子萌发率显著低于45 ℃和40 ℃(P<0.05);处理30 min时,60 ℃、55 ℃的孢子萌发率为0,50 ℃处理的孢子萌发率显著低于45 ℃和40 ℃(P<0.05)。因此,GF1菌株分生孢子致死温度和时间为55 ℃/20 min和60 ℃/10 min。
3 讨 论
据报道,多种镰孢菌可导致枣树病害,如茄腐镰孢菌(F. solani)引起枣树枯死病、尖镰孢菌(F. oxysporum)引起新疆枣根腐病等,以上病害的症状均与灵武长枣干腐病有较大差异[14-16]。木贼镰孢菌是一种常见的植物致病菌,可导致橡胶树基腐病[17]、柑橘树根腐病[18]、苹果树根系病害等[19]。本研究首次发现,木贼镰孢菌侵染灵武长枣导致其形成干腐症状。不同的是,山西省的枣树干腐病主要为害5 a~6 a生的骏枣、灰枣、酸枣、鸡心枣和梨枣的枝条,病原菌为七叶树壳梭孢菌[20]。灵武长枣干腐病主要发病于设施温棚栽培的、 3 a~5 a生的灵武长枣枝条,病原菌为木贼镰孢菌。因此,二者在致病菌和发病植物种类、栽培环境等各方面均具有差异。有关灵武长枣干腐病的发病机理及患病枣树生理特征变化规律有待进一步探索。
研究表明,木贼镰孢菌菌丝生长的最适温度为25 ℃,最适pH为6;24 h光照条件下菌丝生长速度最快,孢子萌发率最高[20]。本研究表明,GF1菌株的菌丝生长、孢子萌发的最适温度范围均为25~30 ℃;菌丝生长最适pH为6~7,孢子萌发最适pH为7,均接近或呈中性;24 h光照有利于GF1的菌丝生长和孢子萌发。木贼镰孢菌的致死温度为60 ℃/10 min[21]。本试验测得孢子的致死温度为55 ℃/20 min或60 ℃/10 min,与前人研究结果相同或相近。
在回接试验中,与温室自然发病症状比较,离体接种的枝条发病症状与其吻合,而田间接种的发病症状与其具有差异。田间活体接种的发病症状与自然发病症状相比,病斑较小,颜色更深,生长速度较慢,表皮皮孔并未突起,黑色小点数量较少。分析原因,一是温室发病时间为3月中旬,光照周期短,光线经塑料薄膜反射和折射,温室内的光照强度较弱。田间回接在6-7月,光照周期较长,光照强度较强,对病原菌的侵染具有不同影响;二是温室通风较差,属高温高湿环境。在试验室模拟温室的温湿条件,枝条表皮变得粗糙,皮孔变大、突起,可为孢子和菌丝提供良好的依附场所和侵染条件,获得与田间典型病征相似的结果。而田间回接试验为6-7月,夜晚温度较低,降雨量较少,通风良好,温湿度均远低于温室。温度和湿度的变化不仅影响真菌病原体的侵染状况,高温高湿还会促使果树皮孔的增大和突起。因此,菌株的生物学特性、寄主种类、自然环境与气候等都会影响木贼镰孢菌的环境适应性及其对植物的侵染[22]。未来,综合运用环境调节措施和其他病害防治技术在温室中防控灵武长枣干腐病,并阐明其调控机理,将成为下一步的研究方向。
4 结 论
本研究从灵武长枣干腐病发病枝条上分离获得病原菌,经柯赫氏法则验证,形态学和分子生物学鉴定,确定GF1菌株为木贼镰孢菌。不同温度、pH和光照条件对GF1菌株的菌丝生长和孢子萌发具有不同影响。GF1的菌丝在10~ 35 ℃均可生长,菌丝生长和孢子萌发的最适温度均为25~30 ℃;菌丝生长和孢子萌发的最适pH分别为6~7和7;24 h光照有利于菌丝生长和孢子萌发;分生孢子的致死温度和时间为55 ℃/20 min和60 ℃/10 min及以上。本研究结论为温室中灵武长枣干腐病的防治研究提供了理论依据。
参考文献 Reference:
[1] 贾 昊,高 露,火旭堂,等. 不同树龄灵武长枣果实主要品质指标比较与分析[J]. 西北农业学报,2020,29(1):56-65.
JIA H,GAO L,HUO X T,et al. Comparison between fruit and different tree ages in Ziziphus jujuba Mill. cv. ‘Lingwuchangzao[J]. Acta Agriculturae Boreali-occidentalis Sinica,2020,29(1):56-65.
[2] 赵晓军,周建波,赵子俊,等. 枣树干腐病病原菌的鉴定[J]. 菌物学报,2009,28(3):332-335.
ZHAO X J,ZHOU J B,ZHAO Z J,et al. The pathogen causing stem dry rot of Ziziphus jujube [J]. Mycosystema,2009,28(3):332-335.
[3] 赵晓军,周建波,任 璐. 枣树干腐病菌生物学特性研究[J]. 山西农业大学学报(自然科学版),2011,31(5):434-439.
ZHAO X J,ZHOU J B,REN L. Study on biological characteristics of Fusicoccum aesculi [J]. Journal of Shanxi Agricultural University(Natural Science Edition),2011, 31(5):434-439.
[4] 冉俊祥. 印度发现一种新的大丽花病原菌——木贼镰刀菌[J]. 植物检疫,1990(1):77.
RAN J X. Fusarium equisetum,a new pathogen of dahlia(Dahli variabilis) [J]. Plant Quarantine,1990(1):77.
[5] LORI G A. Population of Fusarium spp. in soils from the arid regions and effect of water potential on their growth [J]. Revista Argentina de Microbiologia,1991,23(3):130-137.
[6] GUPTA V,RAZDAN V K,JOHN D,et al. First report of leaf blight of Cyperus iria caused by Fusarium equiseti in India [J]. Plant Disease,2013,97(6):838.
[7] 趙晓军,周建波,王 英,等. 枣树新病害(干腐病) 病原菌对不同类型杀菌剂的室内活性测定[J]. 山西农业科学,2008,36(1):88-89.
ZHAO X J,ZHOU J B,WANG Y,et al. Toxicities of nine fungicides against the pathogen of dry decay disease-a new jujube disease [J]. Journal of Shanxi Agricultural Sciences ,2008,36(1):88-89.
[8] 冯慧静,文才艺,尹新明,等. 中国枣树干腐病菌(Botryosphaeria dothidea)群体遗传多样性的ISSR分析[J]. 果树学报,2017,34(8):977-987.
FENG H J,WEN C Y,YIN X M,et al. Population genetic diversity analysis of Chinese jujube branch canker pathogens(Botryosphaeria dothidea) in China using ISSR markers [J]. Journal of Fruit Science ,2017,34(8):977-987.
[9] KIRK P M,CANNON P F,MINTER D W,et al. Ainsworth & Bisbys Dictionary of the Fungi. 10th ed [M].Walling ford:CABI Publishing,UK,2008.
[10] 臧 穆. 中國真菌志[M]. 北京:科学出版社,2013.
ZANG M. Chinese Fungi [M]. Beijing:Science Press,2013.
[11] 王喜刚,杨 波,郭成瑾,等. 宁夏回族自治区马铃薯镰刀菌根腐病病原菌的分离鉴定与致病性测定[J]. 植物保护学报,2020,47(3):609-619.
WANG X G,YANG B,GUO CH J,et al. Identification and pathogenicity test of pathogens causing potato Fusarium root rot in Ningxia Hui Autonomous Region [J]. Acta Phytophylacica Sinica,2020,47(3):609-619.
[12] KIM J,CHHETRI G,KIM I,et al. Methylobacterium terrae sp. nov.,a radiation-resistant bacterium isolated from gamma ray-irradiated soil [J]. Journal of Microbiology,2019,57(11):959-966.
[13] 张晓云,任 可,李维蛟.通过ITS序列分析鉴定云南重楼内生真菌[J]. 江西农业学报,2020,32(3):42-47.
ZHANG X Y,REN K,LI W J. Identification ofendophytic fungi by ITS sequence analysis in Paris Polyphylla var. yunnanensis [J]. Acta Agriculturae Jiangxi,2020, 32(3):42-47.
[14] MIRZAEE M R,JAHANI M,MAHMOUDI H,et al. First report of jujube dieback caused by Fusarium solani [J]. Journal of Plant Pathology,2011,93(4):4-75.
[15] WANG X,XIAO C,JI C,et al. Isolation and characterization of endophytic bacteria for controlling root rot disease of Chinese jujube [J]. Journal of Applied Microbiology,2021,130(3):926-936.
[16] 杨环羽. 灵武长枣炭疽病的病原菌鉴定及其综合防治研究[D]. 银川:宁夏大学,2019.
YANG H Y. Research on the identification of pathogen and integrated control of anthracnose on Zizphus jujube Mill. cv. Lingwuchangzao [D]. Yinchuan:Ningxia University,2019.
[17] 秦云霞,卢基来,周慧珍,等. 橡胶树基腐病致病菌——木贼镰刀菌的分离及鉴定[J]. 农业科学,2017,7(9):621-629.
QIN Y X,LU J L,ZHOU H ZH,et al. Isolation and identification of Fusarium equiseti causing rubber tree stem rot [J]. Journal of Agricultural Sciences,2017,7(9):621-629.
[18] EZRARI S,LAHLALI R,RADOUANE N,et al. Characterization of Fusarium species causing dry root rot disease of citrus trees in Morocco [J]. Journal of Plant Diseases and Protection,2021,128(2):431-447.
[19] PREZ-CORRAL D A,GARCA-GONZLEZ N Y,GALLEGOS-MORALES G,et al. Isolation of actinomycetes associated to apple trees rhizosphere antagonistic to Fusarium equiseti [J]. Revista Mexicana de Ciencias Agrícolas,2015,6(7):1629-1638.
[20] 赵子俊,林忠敏,赵晓军. 山西省枣树主要病害及防治[J]. 中国果树,2000(1):48.
ZHAO Z J,LIN ZH M,ZHAO X J. The main diseases of jujube trees in Shanxi and their control [J]. China Fruit,2000(1):48.
[21] 金社林,郭 成,魏宏玉,等. 玉米穗腐病樣品中木贼镰孢菌的分离鉴定及生物学特性[J]. 草地学报,2014,22(1):182-187.
JIN SH L,GUO CH,WEI H Y et al. Isolation,identification and biological characteristics of Fusarium equiseti from maize ear rot samples [J]. Acta Agrestia Sinica,2014,22(1):182-187.
[22] 李雪萍. 青藏高原青稞根腐类病害及其对根际土壤微生态的影响[D]. 兰州:甘肃农业大学,2017.
LI X P.Naked barley root rot diseases and influence on its rhizosphere microecology in Qinghai-tibet plateau,China [D]. Lanzhou:Gansu Agricultural University,2017.
Isolation,Identification and Biological Characteristics of Pathogens of Dry Rot of Lingwuchangzao Jujube
Abstract In order to determine the species and understand the biological characteristics of the pathogenic bacteria causing dry rot in Lingwuchangzao jujube,tissue isolation was used to isolate the pathogenic bacteria,and their pathogenicity was confirmed following Kochs postulate. The causal agents were identified based on the morphological characteristics and molecular biology. The results showed that three different morphological characteristics(GF1,GF2 and GF3) were isolated and purified and strain GF1 was confirmed to be pathogenic to the dry rot of Lingwuchangzao jujube according to Kochs postulate. GF1 was identified as Fusarium equiseti by morphological characteristics and molecular biology. Optimal conditions for hyphae growth of strain GF1 were observed at temperatures between 25 ℃ and 30 ℃,with a pH of six. Spore germination is most favorable at 28 ℃,with a pH of seve.Light conditions are conducive to spore germination; however,exposure to temperatures of 55 ℃ for 20 min and 60 ℃ for 10 min and beyond inhibite spore germination.
Key words Lingwuchangzao jujube; Dry rot; Pathogen; Fusarium equise
