儿童急性淋巴细胞白血病第15天微小残留与预后的关系
2024-03-26刘丽丽袁宇婷赖耿良叶中绿
刘丽丽,袁宇婷,赖耿良,田 川,蓝 翔,叶中绿
(广东医科大学附属医院 儿童医学中心,广东 湛江 524000)
白血病是儿童最常见的恶性肿瘤之一,约占未成年人群癌症的25%~30%,其中以急性B淋巴细胞白血病(acute B-lymphoblastic leukemia, B-ALL)为主。在过去的几十年中,随着多药化疗和支持治疗的进步,白血病患儿总生存率显著提高。有研究显示,急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)儿童的总生存率近90%[1-2]。微小残留病变(minimal residual disease, MRD)检测已成为指导ALL治疗的基本工具,被作为评估肿瘤治疗早期反应的指标[3]。通过在不同时间点测量患者样本中的MRD水平来确定预后[4]。然而,并不是所有MRD阳性的患儿都出现临床复发,部分检测阴性患儿仍有复发风险。因此,MRD临界值的确定尤为重要,它决定着患儿的危险分层以及化疗强度。为此,本研究旨在探讨儿童ALL第15天MRD与预后的关系,并通过建立模型评估当第15天MRD分别以0.01%、0.1%、1%这3个数值为临界值时的预测价值。
1 资料与方法
1.1病例选择 收集2016年1月至2020年10月在我院采用华南地区儿童ALL治疗协作组2016方案[5](SCCLG-ALL-2016方案)并规范治疗的90例ALL儿童。以MRD≥0.01%为阳性参考值,阳性患儿有60例(66.7%),阴性患儿有30例(33.3%);以MRD ≥ 0.1%为阳性参考值,阳性患儿有59例(65.6%),阴性患儿有31例(34.4%);以MRD≥1%为阳性参考值,阳性患儿有39例(43.3%),阴性患儿有51例(56.6%)。所有研究对象的法定监护人均知情同意并签署知情同意书。对MRD“阳性值”患儿未采取额外特殊干预治疗。纳入标准:①年龄≤14岁;②根据《血液病诊断及疗效标准》第3版[6]ALL诊断标准,符合儿童ALL诊断;③为我院首诊并在我院严格按照SCCLG-ALL-2016方案治疗的ALL患儿。排除标准:①治疗第15天前死亡;②未严格按照化疗计划且未出现随访结局(死亡、随访截止时间)时自行终止化疗;③因各种因素未能行第15天MRD检查;④成熟B-ALL、混合表型白血病;⑤为第二肿瘤者、明确的慢性粒细胞白血病急变;⑥继发于免疫缺陷病者;⑦入组前1个月期间使用过糖皮质激素,或者有任何化疗、放疗史者;⑧患有唐氏综合征。
1.2方法
1.2.1治疗方法 按照SCCLG-ALL-2016方案,根据初诊年龄、初诊白细胞计数(white blood cell count,WBC)、免疫分型、化疗后骨髓缓解状态、MRD、融合基因、异常核型等把ALL患儿分为低危、中危、高危三个危险度,按不同危险度进行分层治疗,治疗过程中根据第15、33天骨髓MRD(D15、D33 MRD)进行危险度动态调整,疗程依次为诱导缓解、巩固、 再诱导和维持治疗,总疗程 2.0~2.5年。
1.2.2微小残留病检测 免疫表型及MRD监测采用流式细胞术免疫表型标志组合。MRD标记的确定是根据患儿初诊时的白血病免疫表型个体化选择,采用“全或无”的策略,一般选择强表达(阳性率90%以上,平均荧光强度指数在100以上)或不表达(阳性率20%以下,平均荧光强度指数10以下)的标记,每份样本至少获取105细胞,细胞经流式细胞仪搜集后,采用CellQuest软件进行分析。
1.3观察指标及评价标准 所有患者均随访至2021年02月01日,比较当第15天MRD以不同数值为临界值时两组患儿的泼尼松试验反应结果、诱导化疗第15天骨髓形态及MRD、预后等。其中泼尼松试验不良指化疗第8天外周血幼稚细胞计数>1×109/L;M1是指骨髓原始细胞+幼稚细胞<5%;M2是指5%≤骨髓原始细胞+幼稚细胞<25%;M3是指骨髓原始细胞+幼稚细胞≥25%;诱导治疗15d MRD<0.1%为早期治疗反应良好。
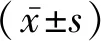
2 结 果
2.1临床特征 纳入分析的90例ALL中,男性54例(60%), 女性36例(40%);初诊年龄从7个月到14岁,中位年龄为6岁;免疫分型B系79例(87.8%),T系11例(12.2%);E2A/PBX1阳性4例(4.8%), TEL/AML1阳性16例(19.3%), BCR/ABL阳性5例(6.0%),MLL基因重排3例(3.6%)。90例ALL患儿的5年总生存率为(69.1±5.6)%,截至随访截止日期,统计共死亡23例,总体死亡率为25.6%,治疗相关死亡的患儿有20例,复发3例,复发率为3.33%,复发的3例患儿均死亡。见表1。

表1 90例ALL患儿临床特征及实验室检查[例(%)]
2.2影响预后的危险因素分析 对性别、年龄、初诊WBC计数、MRD等因素对预后的影响进行单因素分析,显示P<0.2的因素有:性别(P=0.169)、危险度分级(P=0.188)、初诊时WBC(P=0.181)、第8天泼尼松试验(P=0.029)、以0.01%或0.1%为阳性参考值的第15天MRD,将这些因素纳入多因素Cox回归分析, 显示第15天MRD以0.01%为阳性参考值(RR=0.07,95%CI0.006~0.871,P=0.039)和以0.1%为阳性参考值(RR=40.612, 95%CI2.490~662.340,P=0.009)是影响儿童ALL预后的独立风险因素。见表2。
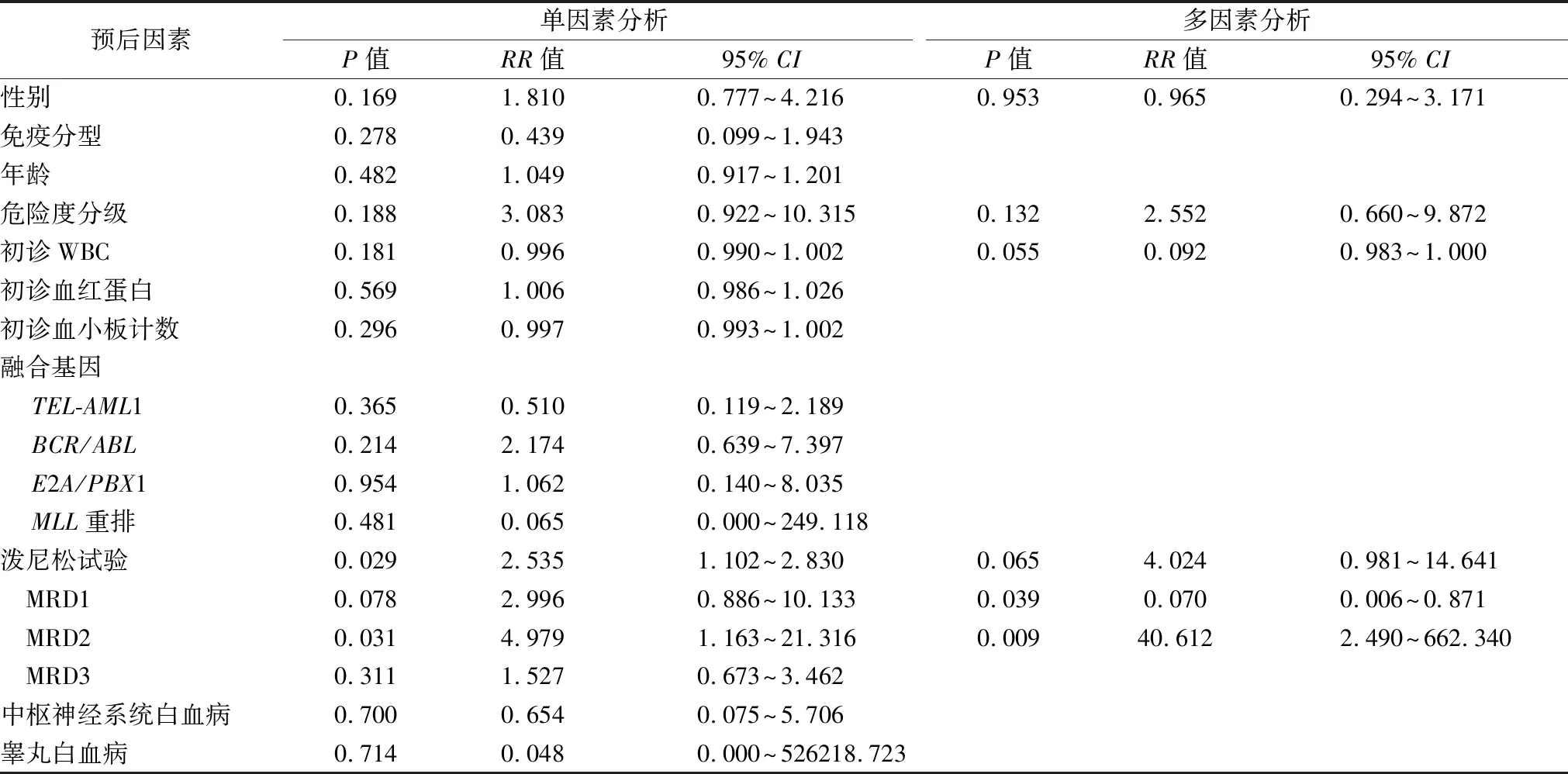
表2 90例ALL儿童临床预后因素分析
2.3评估MRD分别以0.01%、0.1%、1%为临界值的预测价值 分别用0.01%、0.1%、1%作为临界值,形成3个Cox回归模型(model 1, model 2, model 3), 用似然比检验评估此3个预后模型对数据的拟合效果(P<0.05提示模型有意义);结果显示model 1, model 2, model 3的P值分别为0.0455,0.0074,0.6139,提示model 3没有意义。模型之间差异比较的P值均<0.05,提示模型间差异有统计学意义。model 2拟合得更好,更能验证目前收集的数据。见表3。
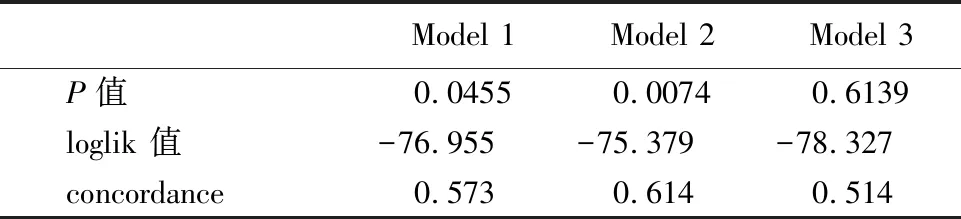
表3 临床预测模型分析
2.4不同临界值分组间临床特征分析 以0.01%定为第15天MRD的临界值,两组间的危险度分级、第8天强的松试验组间比较,差异具有统计学意义(P<0.05);以同样的方法把0.1%作为临界值进行分组分析,结果显示两组间的危险度分级、TEL-AML1融合基因、第8天强的松试验组间比较,差异具有统计学意义(P<0.05);把1%作为临界值进行分组分析,结果显示两组间的初诊WBC计数、危险度分级、第8天强的松试验、D15骨髓缓解状态组间比较,差异具有统计学意义(P<0.05)。见表4。
表4 不同临界值分组间临床特征比较
3 讨 论
儿童急性ALL目前在许多发达国家5年生存率超过90%[7],10年的总生存率为85%~88%[8],一项国内多中心研究报告的长期无事件生存率达到70%~80%[9]。本研究纳入90例ALL患儿总生存率为(69.1±5.6)%,低于国际先进水平,但与国内报道相似,说明我院ALL患儿治疗效果基本上已经达到国内先进水平,但相较于国际先进水平,仍有进步的空间。文献报告显示,白血病患儿的死亡原因中感染为最常见也是最重要的治疗相关性死亡原因之一[10-11]。本研究感染因素占治疗相关死亡的比重最大,与国内外文献报道一致。
据相关研究显示,婴儿或青少年(<1或≥10岁)或诊断时WBC计数高(≥50×109/L)的总体治疗效果及预后相对较差[12-13]。同时国内外多项研究表明泼尼松试验是ALL儿童预后的独立影响因素[14-15]。本研究未能得出以上结论,可能是本研究中第15天MRD对预后的影响价值较年龄、初诊白细胞、强的松试验等因素更加显著。另一方面与预后不良相关的2种比较常见的染色体结构重排是:t(9;22)易位(即费城染色体或Ph) 、KMT2A基因(MLL)重排,而本研究中尚未得出此结论,可能与本研究为单中心研究,具有样本量不足,不利于减少偏倚,存在脱失等因素有关,可进一步行多中心、大样本研究。也与本文研究预后危险因素时选取P<0.2为差异具有统计学意义相关。
现有的大量临床研究表明,MRD水平已被广泛的用于指导急性白血病的分层治疗,并且多个研究报道MRD是影响ALL患儿预后的重要预测因子[16-18]。但是定义MRD状态的异常细胞数量(临界值)应是多少尚未明确。国外相关[19-20]研究发现,在诱导缓解期和巩固期以10-4、10-3或10-2这3个检测阈值来定义MRD, 以10-3作为MRD临界点可更好地预测ALL患者无病生存的概率。本中心使用的SCCLG-ALL-2016方案是吸取多个国内外协作组的成功经验,结合本地区实际情况制定的,将诱导化疗阶段第15天骨髓MRD定为早期治疗反应中的一个重要指标,本研究得出以0.1%为临界值的模型对临床结局的预测效果更好,与国外相关文献报道一致。
综上所述,在本研究中,MRD是影响预后的独立危险因素。然而目前关于MRD的阳性参考值尚未明确,临床试验仍在进行这方面研究。因此,利用目前已知的预后指标如何找到一个平衡点,既能增加高危患儿的化疗强度从而改善预后,又能减少低危患儿的过度治疗而减少毒副作用,一直是我们探索的目标。
