犀角地黄汤预防小鼠中暑效果及血液指标的变化
2024-03-25刘红梅孙传伯
刘红梅,孙传伯
(1.六安市人民医院心血管内科,安徽,六安 237000;2.皖西学院生物与制药工程学院,安徽,六安 237000)
近年来,由于全球气候的变化,高温天气频出而导致中暑患者的收治率逐年增加;中暑是一种人处于高温高湿环境中,由于水和电解质大量丢失,机体体温调节功能障碍,引起以心血管功能障碍为主的热损伤性疾病,重症患者可能出现多器官功能衰竭[1-3]。已有研究表明,在出现中暑情况下,血液中白细胞释放出肿瘤坏死因子(TNF-α)和白细胞介素(ⅠL-1β、ⅠL-6)等炎性因子刺激下丘脑的体温调节中枢,使机体的产热增加,散热减少,导致体温调节功能障碍[4-6]。热休克蛋白70(HSP-70)的表达水平与中暑呈负相关,其具有修复生物体抗应急状态的能力,并保护生物体免受热应激等的损害[6-7]。此外,在中暑过程中机体抗氧化功能遭到破坏,使机体产生氧化损伤[8]。
犀角地黄汤载于《备急千金要方》,具有清热解毒、凉血散瘀之功效,主治热入血分证、热扰心神、热伤血络等症;在解热、抗炎、改善微循环等方面具有确切的疗效[9-11]。然而,其对中暑的防治作用及其机制未见报道。因此,本研究拟采用犀角地黄汤预防小鼠中暑,并对其血液学指标进行分析,初步探究犀角地黄汤预防小鼠中暑的机制,为犀角地黄汤的临床应用提供参考。
1 材料和方法
1.1 材料
1.1.1 实验动物
雌性SPF 级ⅠCR 小鼠30 只,18 ~20 g,均购自河南斯克贝斯生物科技股份有限公司,许可证号:SYXK(豫)2020-0005,将小鼠置于55%~65%的湿度和(22±1)℃环境中饲养,整个实验过程中所有小鼠自由采食和饮水,光照/黑暗时均设定为12 h/12 h。
1.1.2 药品与试剂
水牛角(批号:200601)和芍药(批号:210501),购自广东天诚中药饮片有限公司;生地黄(批号:210701),购自普宁市泽群中药饮片有限公司;牡丹皮(批号:20210801),购自广东汇群中药饮片股份有限公司;总超氧化物歧化酶(SOD)测定试剂盒(货号:A001-3-2)、丙二醛(MDA)测定试剂盒(货号:A003-1-2)、谷胱甘肽过氧化物酶(GSH-PX)测定试剂盒(货号:A005-1-2)、天门冬氨酸氨基转移酶(AST)测试盒(货号:C010-2-1)、丙氨酸氨基转移酶(ALT)测试盒(货号:C009-2-1)、肌酐(CREA)测定试剂盒(货号:C011-2-1)、尿素氮(BUN)测试盒(货号:C013-2-1)、肌酸激酶(CK)测定试剂盒(货号:A032-1-1),均购自南京建成生物工程研究所有限公司;小鼠热休克蛋白70(HSP-70)ELⅠSA 试剂盒(货号:F2458-A)、小鼠肿瘤坏死因子α(TNF-α)ELⅠSA 试剂盒(货号:F2132-A)、小鼠白细胞介素6(ⅠL-6)ELⅠSA试剂盒(货号:F2163-B)、小鼠白细胞介素1β(ⅠL-1β)ELⅠSA 试剂盒(货号:F2040-A),均购自上海泛柯实业有限公司。
1.1.3 仪器与试剂
动物专用血细胞分析仪(BC-2600VET,深圳迈瑞动物医疗科技股份有限公司),紫外可见光分光光度计(UV-2600,日本岛津公司),酶标仪(Multiskan FC,Thermo Fisher)。
1.2 方法
1.2.1 犀角地黄汤提取液的制备
分别取水牛角30 g,生地黄24 g,芍药9 g,牡丹皮12 g,加入10 倍体积的蒸馏水1 h 后,100℃条件下冷凝回流提取1 h,过滤,滤液旋转蒸发至0.5 g/mL,-20℃保存备用。
1.2.2 动物实验
将适应性饲养一周的小鼠随机分成对照组(CT)、中暑组(HT)和干预组(ⅠT),每组10 只,干预组小鼠每天使用犀角地黄汤提取液进行灌胃,灌胃剂量为11.375 g/kg 体重(按照60 kg/人的用药剂量换算),连续用药5 d,在造模前2 h,给予小鼠11.375 g/kg 体重剂量的犀角地黄汤提取液进行灌胃,对照组和中暑组小鼠灌胃等量的生理盐水。将中暑组和干预组小鼠置于40℃的恒温环境中持续60 min,对照组小鼠置于室温环境中,对比各组小鼠的抗中暑效果。试验结束后,小鼠眼眶分别采集抗凝血和非抗凝血。抗凝血用于血常规检测,非抗凝血3000 rpm 离心10 min 后取血清用于血清生化和ELⅠSA 检测。
1.2.3 血常规检测
使用动物专用的三分类血细胞分析仪测定各组小鼠白细胞、红细胞和血小板的变化。
1.2.4 血清生化检测
按照南京建成生物工程研究所有限公司生化试剂盒的要求,检测小鼠血清中SOD、MDA、GSH-PX、AST、ALT、CREA、BUN、CK 的含量。
1.2.5 血清ELISA 检测
按照上海泛柯实业有限公司ELⅠSA 试剂盒检测要求,检测小鼠血清中HSP-70、TNF-α、ⅠL-6、ⅠL-1β的含量。
1.2.6 统计学分析
所有实验数据均采用SPASS 19.0 进行单因素方差分析,实验结果均以平均值土标准差的形式表示,P<0.05 表示差异具有统计学意义。
2 结果与分析
2.1 犀角地黄汤对中暑小鼠体温影响
与对照组相比,中暑组小鼠的肛温显著升高(P<0.05),犀角地黄汤干预后,干预组小鼠的肛温显著下降(P<0.05),结果见图1。
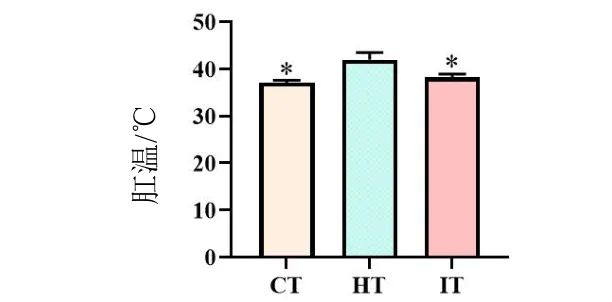
图1 各分组小鼠治疗前后体温变化Fig.1 Changes in body temperature before and after treatment in each group of mice
2.2 犀角地黄汤对中暑小鼠血常规的影响
表1 血常规指标中英文对照表
结果显示,与对照组相比,中暑组小鼠白细胞总数(WBC)、中性粒细胞总数(Gran#)、淋巴细胞总数(Lymph#)、单核细胞总数(Mon#)、红细胞总数(RBC)、血红蛋白含量(HGB)、红细胞压积(HCT)、平均红细胞体积(MCV)、红细胞分布宽度(RDW)、血小板平均容积(MPV)、血小板分布宽度(PDW)显著升高(P<0.05),血小板总数(PLT)和血小板压积(PCT)显著下降(P<0.05);与中暑组相比,干预组小鼠WBC、Gran#、Lymph#、Mon#、RBC、HGB、HCT、MCV、MPV、PDW 明显下降(P<0.05),PLT 和PCT 显著升高(P<0.05),结果见图2。

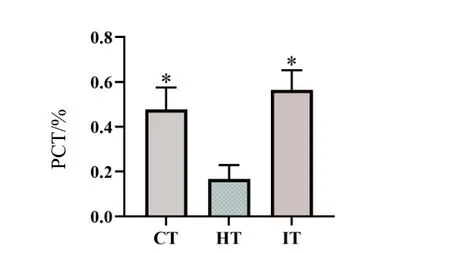
图2 犀角地黄汤对中暑小鼠血常规的影响Fig.2 Effect of Xijiao Dihuang decoction on blood routine of mice with heatstroke
2.3 犀角地黄汤对中暑小鼠生化指标的影响
结果显示,与对照组相比,中暑组小鼠的AST、ALT、BUN、CREA 和CK 含量显著升高(P<0.05);与中暑组相比,干预组小鼠AST、ALT、BUN、CREA 和CK 含量显著下降(P<0.05),结果见图3。

图3 犀角地黄汤对中暑小鼠生化指标的影响Fig.3 Effect of Xijiao Dihuang decoction on biochemical indicator of mice with heatstroke
2.4 犀角地黄汤对中暑小鼠血清抗氧化的影响
结果显示,与对照组相比,中暑组小鼠SOD和GSH-PX 含量显著下降(P<0.05),MDA 含量显著升高(P<0.05);与中暑组相比,干预组小鼠SOD 和GSH-PX 含量显著升高(P<0.05),MDA含量显著下降(P<0.05),结果见图4。
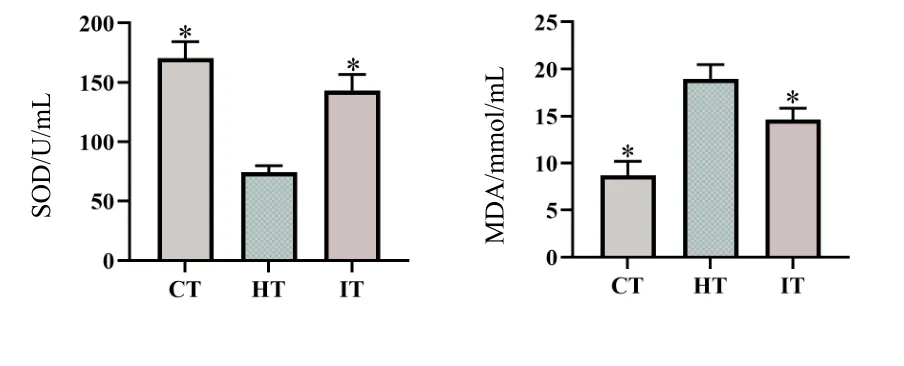
图4 犀角地黄汤对中暑小鼠血清抗氧化的影响Fig.4 Effect of Xijiao Dihuang decoction on serum antioxidants of mice with heatstroke
2.5 犀角地黄汤对中暑小鼠炎性因子和热休克蛋白的影响
实验结果显示,与对照组相比,中暑组小鼠血 清TNF-α、ⅠL-6、ⅠL-1β 含 量 显 著 升 高(P<0.05),HSP70 含量显著降低(P<0.05);与中暑组相比,干预组血清TNF-α、ⅠL-6、ⅠL-1β显著下降(P<0.05),HSP70 含量显著升高(P<0.05),结果见图5。
3 讨论
中暑是以水和电解质丢失过多、散热功能衰竭、中枢神经系统和心血管功能障碍为特征的热损伤性疾病[12]。董翔等[13]研究表明,中暑大鼠的白细胞数量较未中暑大鼠显著升高,同时中暑大鼠血清TNF-α、ⅠL-1β、ⅠL-6 含量较未中暑组显著增加[14]。实验表明在出现中暑情况下,会激活和募集大量的白细胞,这些白细胞会释放出TNF-α、ⅠL-1β、ⅠL-6 等内生性致热因子或炎性因子,这些内生性致热因子能够使下丘脑体温调节中枢的调定点升高而使机体的产热增加和散热减少,加重小鼠中暑的发热症状[4-6]。本研究结果表明,中暑后小鼠的体温迅速升高,中暑组小鼠WBC、Gran#、Lymph#、Mon#、TNF-α、ⅠL-6、ⅠL-1β含量较对照组显著升高(P<0.05),与上述研究结果基本一致。在本研究中,中暑组小鼠HGB、HCT、MCV、RDW 较对照组显著升高(P<0.05),中暑组小鼠PLT 和PCT 较对照组显著下降(P<0.05),表明机体脱水导致红细胞数量和体积减少,且激活机体的凝血系统,引起血小板和凝血因子的过度消耗,形成弥漫性血管内凝血,这是导致中暑病主要的发病机制之一[14-16]。高温能够导致机体氧运输障碍,使机体多器官处于氧化损伤的状态[17];研究表明,中暑可以导致机体心、肝、肾等多器官损伤[18-21],AST 和ALT 是肝功能损伤的评价指标,BUN 和CREA 是肾功能损伤的评价指标,而CK 是心肌功能损伤的评价指标,本研究结果显示,与对照组相比,中暑组小鼠的AST、ALT、BUN、CREA 和CK 含量显著升高(P<0.05),表明此时机体心、肝、肾发生损伤。此外,本研究发现,与对照组相比,中暑组小鼠过氧化指标MDA 含量显著升高(P<0.05),抗氧化指标SOD 和GSH-PX 含量显著下降(P<0.05),HSP70 含量显著下降(P<0.05),表明中暑可以导致机体发生氧化损伤。
中医认为,暑为阳邪,暑热侵犯人体,血液过热,血行加速,热迫汗出,大汗伤阴,气随汗脱;致使出现发热口渴、神疲气短、心烦头晕、汗出、小便短黄为主的症状;近年来,有学者认为中暑的发生发展与热毒和血瘀密切相关,并认为清热解毒和凉血活血是治疗中暑的关键[22-23]。犀角地黄汤治疗血热病的代表方剂,具有清热解毒、凉血散瘀之功效。本研究结果表明,犀角地黄汤干预中暑小鼠后,干预组小鼠体温显著低于中暑组小鼠(P<0.05),表明犀角地黄汤能够有效地预防中暑症。犀角地黄汤能够有效抑制机体炎症反应,从而阻止内生性致热因子发挥作用,这是减少机体产热、促进散热的关键,也是犀角地黄汤预防中暑病的主要机制[24-25]。本研究发现,干预组小鼠WBC、Gran#、Lymph#、Mon#、TNF-α、ⅠL-6、ⅠL-1β较中暑组明显下降(P<0.05)。此外,干预组小鼠RBC、HGB、HCT、MCV、MPV、PDW 较中暑组明显下降(P<0.05),PLT和PCT 显著升高(P<0.05),表明犀角地黄汤增强机体抗热能力,并阻止机体脱水和发生凝血。
Hsp70 是一种非特异性保护蛋白,在抗氧化、降低应激损伤及保护细胞中发挥重要作用[26]。董翔等[14]研究表明,姜黄素可以促进中暑大鼠肠道黏膜Hsp70 的表达,发挥其保护肠道黏膜的作用。本研究结果表明,与中暑组相比,干预组血清HSP70 含量显著升高(P<0.05),提示犀角地黄汤可以发挥对抗中暑引起机体器官损伤作用。研究发现,Hsp70 可以调控下游抗氧化基因的表达,抑制机体的脂质过氧化水平,促使机体的脏器免受损伤[27]。蒋华等[28]研究表明犀角地黄汤对盲肠结扎穿孔术脓毒症模型大鼠的肝脏有保护作用,其能够降低脓毒症模型大鼠血清ALT 和AST 含量。李万国等[29]研究表明犀角地黄汤可有效治疗原发性肾小球疾病,治疗后患者的血肌酐、24 h 尿蛋白、尿MA/Cr、肾小球滤过率等指标明显降低。本研究结果表明,干预组小鼠AST、ALT、BUN、CREA 和CK 含量显著下降(P<0.05),表明犀角地黄汤可以有效的预防中暑导致机体的心、肝、肾损伤,与上述的实验结果一致。蒋华等[28]研究认为,犀角地黄汤能够抑制脓毒症大鼠肝脏脂质过氧化水平,提高肝脏一氧化氮(NO)、诱导型一氧化氮合酶(iNOS)、SOD 水平,从而发挥抗氧化损伤作用。本研究表明,与中暑组相比,干预组小鼠血清SOD 和GSH-PX 含量显著升高(P<0.05),MDA 含量显著下降(P<0.05),这表明犀角地黄汤提高机体的抗氧化水平而抑制脂质过氧化水平,从而保护机体的器官。
综上所述,犀角地黄汤可以预防中暑疾病,其机制可能与抑制血液的炎性反应和提高机体的抗氧化水平有关,可为犀角地黄汤用于中暑病的防治提供一定的理论基础。
