肿瘤合并卡氏肺孢子菌肺炎1例
2024-03-25张铁寒
张铁寒, 刘 斌
肺孢子菌肺炎最早在20世纪初被记录,卡氏肺孢子菌肺炎是一种由于卡氏肺孢子菌感染引起的肺部疾病,是一种条件致病性感染,其好发于免疫功能缺陷或者长期接受免疫抑制剂治疗患者,最常见于获得人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染患者[1]。目前随着免疫制剂的应用,肺孢子菌肺炎在接受免疫调节、器官移植、免疫疗法的HIV阴性的肿瘤患者中发生率明显升高[2]。而在疾病发展早期,其临床表现及胸部影像表现可能并不典型,容易误诊、漏诊。本文对我科收治一例乳腺癌化疗合并卡氏肺孢子菌肺炎患者的诊治进行分析,旨在对临床诊治提供依据。
1 病例报告
患者,女,69岁,主因“左乳腺癌术后3个月,拟行第四周期化疗”于2021-06-22收入我院肿瘤科。自诉于2021年3月确诊为左乳浸润性癌,分期为pT1bN0Mx,已行3个周期术后辅助化疗,化疗方案为脂多体多柔比星50 mg D1+环磷酰胺1.0 D1,化疗前予以地塞米松预处理。入院后血常规:白细胞3.01×109/L,中性粒细胞数0.8×109/L,前降钙素0.06 ng/ml,给予人粒细胞集落刺激因子治疗。于入院第2天(6月23日)出现发热,体温最高39.5 ℃,予以解热镇痛药物后可退热,无咳嗽、咳痰、喘憋等症状,听诊双肺呼吸音清,无干湿啰音。于6月24日完善胸部CT,CT表现为双肺多发斑片影(图1A)。6月24日检测C反应蛋白11.5 mg/L,患者化疗引起骨髓抑制,血常规示中性粒细胞减少,考虑存在细菌感染,给予注射用哌拉西林他唑巴坦抗炎治疗。6月25日复查血常规,白细胞5.88×109/L,中性粒细胞数3.62×109/L,前降钙素0.08 ng/ml,C反应蛋白34.4 mg/L,血液1-3-β葡聚糖定量113.4 pg/ml,抗生素治疗3 d后,患者仍高热。6月28日血常规示白细胞3.36×109/L,中性粒细胞数1.57×109/L,前降钙素0.08 ng/ml,C反应蛋白54.6 mg/L,抗感染治疗效果不佳。于6月29日转入感染性疾病科,抗生素给予左氧氟沙星联合注射用美罗培南治疗后3 d,患者体温37.4 ℃。7月2日再次复查血常规,白细胞5.22×109/L,中性粒细胞数3.53×109/L,前降钙素0.08 ng/ml,C反应蛋白48 mg/L,体温未明显下降,炎性指标较前变化不大,抗细菌治疗一周后效果欠佳。于7月2日行支气管镜检查,肺泡灌洗液(bronchoalveolar lavage fluid,BALF)抗酸涂片、细菌、真菌培养均为阴性,1-3-β葡聚糖定量37.7 pg/ml,进行BALF宏基因组二代测序,结果:耶氏肺孢子菌感染。停用抗生素,采用口服复方磺胺甲噁唑片治疗,7月5日复查胸CT:双肺弥漫性磨玻璃影(图1B),体温正常。7月9日复查血常规提示血常规白细胞及中性粒细胞恢复正常,C反应蛋白降至正常,感染控制。治疗后病情好转出院。
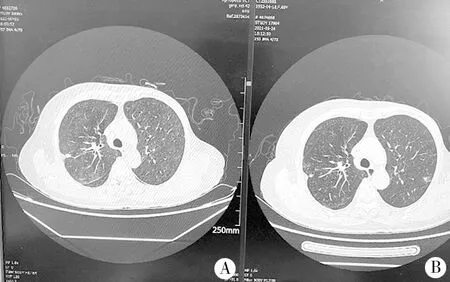
图1 卡氏肺孢子菌肺炎患者治疗期间肺部CT影像
2 讨 论
1988年,通过对肺孢子菌RNA进行分析证实该病原体属于真菌[3],现有5种不同种类肺孢子菌被发现,其中引起人类肺孢子菌肺炎的病原体是耶氏肺孢子菌,肺孢子菌具有宿主特异性,人和动物之间不会产生交叉感染。肺孢子菌存在滋养体、包囊前期、包囊三种形态[4],包囊是其主要致病因素,肺孢子菌包囊通常通过空气飞沫传播进入宿主体内,并附着于肺的上皮细胞表面,呈隐性感染,当各种原因导致宿主免疫力低下时,可大量繁殖,从而发生显性感染[5]。而感染患者及健康带菌者均可作为传染源。HIV患者易感染肺孢子菌肺炎,也是重要死亡原因之一。近年来,研究发现,肺孢子菌肺炎在HIV阴性患者中的发生率增高,肺孢子菌肺炎病例在HIV阳性人群和HIV阴性人群中的比例分别是40%和60%。HIV阴性合并肺孢子菌肺炎患者的死亡风险更高[6]。因HIV阴性患者比HIV阳性患者的免疫系统更具功能性,因此可发生更加严重的肺孢子菌肺炎相关炎症反应[7]。本例患者有乳腺癌病史,三次化疗后出现肺孢子菌肺炎,未应用免疫抑制剂,化疗仍可减弱机体免疫力。
肺孢子菌肺炎的临床表现并无特异性,容易导致漏诊、误诊,HIV阴性合并肺孢子菌肺炎患者较HIV阳性患者,病程进展较快,HIV阴性的肺孢子菌肺炎患者临床特征取决于机体的免疫状况和炎症反应情况。常见的症状为发热、呼吸困难、咳嗽,发热常为低热,也可表现为高热;肺部体征少,听诊无异常呼吸音或仅有双肺呼吸音粗,无异常干湿啰音,体征与症状严重程度不相符是肺孢子菌肺炎的典型特点[8]。大部分肺孢子菌肺炎患者会表现出低氧血症。本例患者开始表现为高热,无其他伴随症状,肺部听诊无异常,且出现白细胞及中性粒细胞减少,不除外存在中性粒细胞减少性发热,或包括细菌、巨细胞病毒和其他呼吸道病毒的感染, 说明本病单纯依靠临床表现不易鉴别,临床应引起高度重视。
胸部CT尤其是高分辨率CT对肺孢子菌肺炎感染的早期识别有重要价值,典型的影像学表现是以双肺肺门为中心的弥漫磨玻璃影,常可出现马赛克征。本例患者在疾病发展早期在胸部X线片表现为双肺纹理增重。Mu等[9]将HIV阴性的免疫功能低下合并肺孢子菌肺炎的影像学表现分为三期:HRCT早期表现为双肺散发的磨玻璃影;HRCT中期表现为双肺弥漫性磨玻璃影伴有实变;HRCT晚期表现为双肺弥漫的实变影。此病例在病情早期胸CT表现为双肺多发的斑片影,随着病情的进展,CT则表现为双肺弥漫性磨玻璃影,基于早期的影像学表现,延误了对于此病的诊断。典型的影像学表现可以帮助快速判定可能的病原菌感染,并可指导患者初始治疗,但其不能作为其病因学诊断。主要血清学检测指标包括1-3-β葡聚糖和乳酸脱氢酶, 1-3-β葡聚糖是肺孢子菌细胞壁的一种成分,血清G试验是协助诊断肺孢子菌肺炎的方法之一[10]。而在其他侵袭性真菌感染及接受免疫球蛋白治疗患者中1-3-β葡聚糖水平也可能升高。本例患者发热初期其1-3-β葡聚糖水平已经升高,但这个化验结果被忽略,延误了其诊断。乳酸脱氢酶(LDH),是与细胞损伤或细胞死亡相关的指标,虽然灵敏度很高,但特异性低,很多疾病如肝病、心肌损伤、肿瘤等都可导致其升高。肺孢子菌肺炎确诊金标准是从呼吸道标本中检测出肺孢子菌。传统的痰涂片因非HIV患者其大多数肺孢子菌负荷量低导致其灵敏度低;PCR技术是诊断的一种可靠方法,但其对操作条件要求高,且难以区分定植及活动性感染;目前肺泡灌洗液的二代基因测序技术在诊断肺孢子菌肺炎有更高的灵敏度和特异性[11]。
临床中,肺孢子菌肺炎常需要与病毒性肺炎,尤其是巨细胞病毒性肺炎相鉴别。巨细胞病毒作为一种疱疹病毒正常情况下,巨细胞病毒处于休眠状态,对宿主生理活动无影响,一旦宿主免疫力下降,病毒被激活并过度增殖,导致宿主感染[12],引起巨细胞病毒性肺炎(cytomegalovirus pneumonia,CMVP),患者发病急促且发展迅速。CMVP的影像学表现为支气管充气征,实变影,小结节影,磨玻璃影,发生在肺实质、肺间质[13]。相对于肺孢子菌肺炎来说,虽然胸部CT也表现为磨玻璃影,但实变及支气管充气征占较大比例;且其1-3-β葡聚糖不升高。所以,对于肺孢子菌肺炎和CMVP,早期诊断均很重要,传统的确诊方法依赖肺泡灌洗液或肺组织发现肺孢子菌包囊或滋养体,但检出率低,宏基因二代测序是一种新的广泛分析样本中微生物的高通量测序方法,具有快速、灵敏度高的特点,对于细菌、真菌、病毒等混合感染的检出率也很高,因此对于免疫低下感染患者诊断价值更高[14]。
目前,甲氧苄啶(trimethoprim,TMP)-磺胺甲恶唑(sulfamethoxazole,SMZ)是治疗肺孢子菌感染的首要药物,TMP是二氢叶酸还原酶抑制剂,而SMZ是二氢叶酸合成酶抑制剂,具有协同作用,可干扰叶酸合成[15]。不论是HIV阳性或阴性的肺孢子菌肺炎患者,其一线治疗选择都是21 d的TMP-SMZ,推荐给药剂量分别为TMP 15~20 mg/(kg·d)和SMZ 75~100 mg/(kg·d),常见的不良反应为皮疹、发热、胃肠道症状、骨髓抑制、高钾血症、肝毒性、肾损害、脑膜炎、过敏等[16]。Nakashima等[17]回顾性分析了24例HIV阴性的肺孢子菌肺炎患者,应用低剂量TMP 4~10 mg/(kg·d)和SMZ 20~50 mg/(kg·d)治疗,生存率达91.0%,表明低剂量TMP-SMZ治疗可能是非HIV 肺孢子菌肺炎患者的一种治疗选择。而对于磺胺过敏,或应用TMP-SMZ出现严重不良反应的患者,可选择二线药物治疗,包括阿托伐醌、甲氧氨苄嘧啶联合氨苯砜及伯氨喹联合克林霉素。目前,卡泊芬净做为一种新的药物正在临床试验中,其是一种棘白菌素,由具有竞争性的抑制肺孢子菌细胞壁成分1-3-β葡聚糖的合成,能减少肺孢子菌包囊的形成,但不能清除滋养体,所以在停药后易复发。现有两项关于卡泊芬净治疗肺孢子菌肺炎的临床试验正在进行,结果发现,卡泊芬净单药或联合TMP-SMZ有显著的疗效[15,18]。在严重的非HIV-肺孢子菌肺炎患者中,糖皮质激素能够降低死亡风险[19]。Pareja等[20]研究发现,与低剂量皮质类固醇治疗方案相比,非HIV的严重肺孢子菌肺炎患者每日口服60 mg或以上的泼尼松疗效较好,证明大剂量的皮质类固醇治疗可能会加速非HIV严重肺孢子菌肺炎患者的康复。
综上,肺孢子菌肺炎是一个重大的公共健康问题。肺孢子菌肺炎患者的症状及体征均无特异性,病情早期未出现典型的影像学表现,容易出现误诊、漏诊,病死率高,提示临床医师应高度重视,及时诊断及治疗。
