五谷虫中蛆激酶分离及其生物活性评价
2024-03-25刘秋荻张凯欣马彤瑶汪文漪马兰青
刘 灿,刘秋荻,张凯欣,马彤瑶,汪文漪,马兰青*
(1.北京农学院农业农村部华北都市农业重点实验室,北京 102206; 2.北京农学院生物与资源环境学院,北京 102206)
血栓栓塞型疾病对心、脑、肺中血管系统造成损害,严重危害人体健康。自然界是获取溶栓药物的天然宝库,研究报道微生物、动植物中均可分离得到具有溶栓活性的物质,如利用溶血性链球菌制备链激酶[1],从人尿液中提取尿激酶[2],枯草芽孢杆菌中分离纳豆激酶[3],利用赤子爱胜蚓制备蚓激酶[4],以江浙蝮蛇蛇毒为原料获取蛇毒溶栓酶[5],从海洋生物单环刺螠中提取单环刺螠溶栓酶[6],以沙蚕、黄粉虫为原料制备沙蚕溶栓酶[7]和黄粉虫溶栓酶[8]。
五谷虫又名蝇蛆,《本草纲目》 记载其可“治小儿诸疳积、疳疮,热病谵妄,毒痢作吐”[9],用于创面感染、臁疮等疾病的治疗[10-12]。蝇蛆中凝集素具有抗菌、抗病毒的作用[13]; 抗菌肽可抑制金黄色葡萄球菌的繁殖[14],预防呼吸道感染[15]; 溶菌酶可促进巨噬细胞的吞噬能力,增强机体免疫[16]; 脂肪酸具有抗肿瘤、抗HIV-1 整合酶活性[17]。基于前期筛选结果,本研究拟从五谷虫中分离蛆激酶并评价其活性,以期为该昆虫纤溶酶的理论研究和临床应用提供参考。
1 材料
1.1 仪器 ChemiDocTM XRS+型凝胶成像仪(美国伯乐公司); 艾本德5430 R 型低温高速离心机(德国艾本德公司); DYY-4C 型电泳仪(北京市六一仪器厂); 赛默飞3111 型二氧化碳恒温培养箱(美国赛默飞公司); SHA-CA型水浴锅(常州荣华仪器制造公司); LC-20A 型高效液相色谱仪(日本岛津公司); FA2004B 型电子天平(上海越平科学仪器制造有限公司); THZ-C 型恒温振荡器(苏州培英实验设备有限公司); JP-Blupadstart 型蛋白纯化系统(上海嘉鹏科技有限公司)。
1.2 试剂与药物 家蝇(合肥大元生物科技有限公司),通过对原料的COⅠ基因克隆、测序比对进行物种鉴定,鉴定结果为家蝇MuscadomesticaL.。CM52 型离子交换树脂(批号C8691)、苯甲脒Sepharose 4FF (批号S9400) (北京索莱宝科技有限公司); 纤维蛋白原(编号140607,18 个酪蛋白单位/瓶)、凝血酶(编号140605)、纤维蛋白溶酶原(纤溶酶,编号140606)、蚓激酶标准品(编号140650,24 000 U/支) (中国食品药品检定研究院);N-α-苯甲酰-DL-精氨酰-4-硝基苯胺盐酸盐(BAPNA,上海阿拉丁生化科技股份有限公司,货号B100879,纯度>98%); 苯甲基磺酰氟(PMSF,编号A100754)、抑肽酶(编号A100429)[生工生物工程(上海) 有限公司]。
2 方法
2.1 蛆激酶提取、分离与纯化
2.1.1 盐析法提取粗酶 取新鲜冷冻家蝇幼虫100 g,用水洗净,加入1 800 mL 蒸馏水匀浆,8 500 r/min 离心10 min 以除去杂质,收集上清液,加入硫酸铵使其饱和度达到30%,在4 ℃下静置2 h,待蛋白沉淀析出后8 500 r/min离心,收集上清液,再补充硫酸铵至饱和度为70%,静置,8 500 r/min 离心,弃上清液,收集沉淀,用纯净水溶解,透析袋除去溶解液中盐离子至电导率为50 μs/cm,即得粗提液。
2.1.2 CM52 离子交换层析 采用阳离子交换树脂CM52,平衡液PBS 缓冲液(pH =8,10 mmol/L); 洗脱液含0.5 mol/L 的NaCl-PBS 缓冲液(pH =8,10 mmol/L); 体积流量1 mL/min,收集有活性的洗脱峰溶液并进行透析,除去溶液中盐离子。
2.1.3 苯甲脒Sepharose 4FF 亲和层析 采用填料苯甲脒琼脂糖凝胶进行亲和层析; 柱床体积10 mL; 平衡液PBS缓冲液 (pH =7.5,100 mmol/L); 甘氨酸盐酸缓冲液(pH=3.0,50 mmol/L) 洗脱,体积流量0.5 mL/min,收集活性洗脱峰并进行透析至电导率<10 μs/cm,冷冻干燥。
2.2 蛆激酶溶纤活性测定 参照《国家食品药品监督管理局国家药典委员会审定国家药品标准WS1- (X-052) -2001Z》,精密量取不同浓度蚓激酶标准品及样品溶液适量,点在纤维蛋白平皿上,加盖,置于37 ℃恒温箱中反应18 h,取出,通过卡尺测量溶纤圈垂直两直径,以蚓激酶单位数的对数为横坐标(X),垂直两直径乘积的对数为纵坐标(Y) 进行回归,将溶纤圈垂直两直径乘积的对数代入其中,计算效价单位数。
2.3 蛆激酶对纤溶酶原的激活作用 纤维蛋白溶酶原加入1.8 mL 水溶解,制成10 酪蛋白单位/mL 的溶液。取1.5 mL 离心管,加入蛆激酶20 μL (比活性5 600 U/mL),再加入纤溶酶原溶液制成含0.1 酪蛋白单位/管的供试品溶液,作为实验组,同时选择生理盐水作为对照组,按“2.2” 项下方法测定溶纤活性,以对照组相对酶活性100%计算实验组相对酶活。
2.4 蛆激酶蛋白分子量测定 采用SDS-PAGE 电泳,胶配方为12%分离胶、5% 浓缩胶,电泳条件为电压调至80 V保持恒压,待溴酚蓝指示剂移动进浓缩胶时电压调至120 V 并保持恒压,以考马斯亮蓝R-250 进行染色,放入脱色液中[冰醋酸-无水乙醇-水(3 ∶10 ∶27) ],置于摇床上,设定转速为55 r/min,待条带清晰可见后倒掉脱色液,拍照。
2.5 蛆激酶对纤维蛋白原(牛血) 的降解作用 取1.5 mL 离心管,加入80 μL 1.5 mg /mL 纤维蛋白原、8 μL 蛆激酶(活性37 000 U/mL),混匀,37 ℃水浴反应(转速110 r/min) 1、3、10、30 min 及1、1.5、24 h 时取出离心管,置于-20 ℃冰箱中终止反应,加入含变性剂的蛋白质Loading Buffer,沸水浴加热5 min,以纤维蛋白原为对照,采用SDS-PAGE 电泳分析蛆激酶对纤维蛋白原各亚基的降解情况。
2.6 蛆激酶作用靶点分析 离心管加入3 mL 底物BAPNA、5 μL 蛆激酶(比活性约13 000 U/mL),混匀,在37 ℃下保温,于0.5、1、3、5、24 h 各取20 μL,乙腈稀释4 倍后0.22 μm 微孔滤膜过滤,采用HPLC 法分析不同时间BAPNA 底物的降解情况,条件为Zorbax SB-C18色谱柱(4.6 mm×150 mm,5 μm); 流动相水(A) -乙腈(B),梯度洗脱(0 ~10 min,20% ~100% B; 11 ~15 min,100%B; 16~20 min,100% ~20%B); 体积流量0.8 mL/min; 柱温25 ℃; 检测波长253 nm; 进样量20 μL。
2.7 蛆激酶酶动力学参数测定 以BAPNA 为底物,配制0.05、0.08、0.1、0.2、0.4、0.6、0.8、1、1.5、2 mmol/L溶液。将3 mL 不同浓度底物溶液、5 μL 蛆激酶(活性14 000 U/mL) 在37 ℃下反应,于410 nm 波长处测定在2 min 内的光密度(OD) 变化,计算酶活性,以每1 min 生成1 mmoL/L 底物所需酶量定义为水解BAPNA 酶活性单位(1 U),采用米氏方程进行计算[18],公式为V=Vmax×[S] /Km+[S],再通过双倒数法将其转化成线性方程式(Lineweaver-Burk 方程式)[19],公式为1/V=Km/Vmax×1/[S] +1/Vmax,其中V为酶促反应速率,Km为米氏常数,[S] 为底物浓度,Vmax为最大反应速率。
2.8 抑制剂对蛆激酶活性的影响 采用丝氨酸蛋白酶专一性抑制剂判定蛆激酶活性中心类型,将PMSF 溶于异丙醇中,质量浓度为5.23 mg/mL (30 mmol/L),使用前加水稀释(由于其在水溶液中易分解,故现用现配),同时抑肽酶用蒸馏水进行溶解(现用现配)。取1.5 mL 离心管,加入蛆激酶(活性4 000 U/mL) 20 μL,再加入PMSF、抑肽酶,使离心管中抑制剂终浓度为1、5 mmol/L,以蒸馏水为对照,按“2.2” 项下方法测定,以对照组相对酶活性100%计算实验组相对酶活。
3 结果
3.1 蛆激酶提取、分离与纯化 盐析后,粗酶比活性为959.84 U/mg (n=3),经羧甲基纤维素CM-52 弱阳离子交换层析分离后升至17 858 U/mg (n=3),苯甲脒琼脂糖凝胶4FF 纯化后进一步升至933 262 U/mg (n=3)。由图1 可知,原料中富含蛋白质,经硫酸铵分级沉淀除去部分无活性的蛋白,再经CM-52 除去大量杂质,最后经亲和层析获得蛆激酶,分子量约为25 kDa。
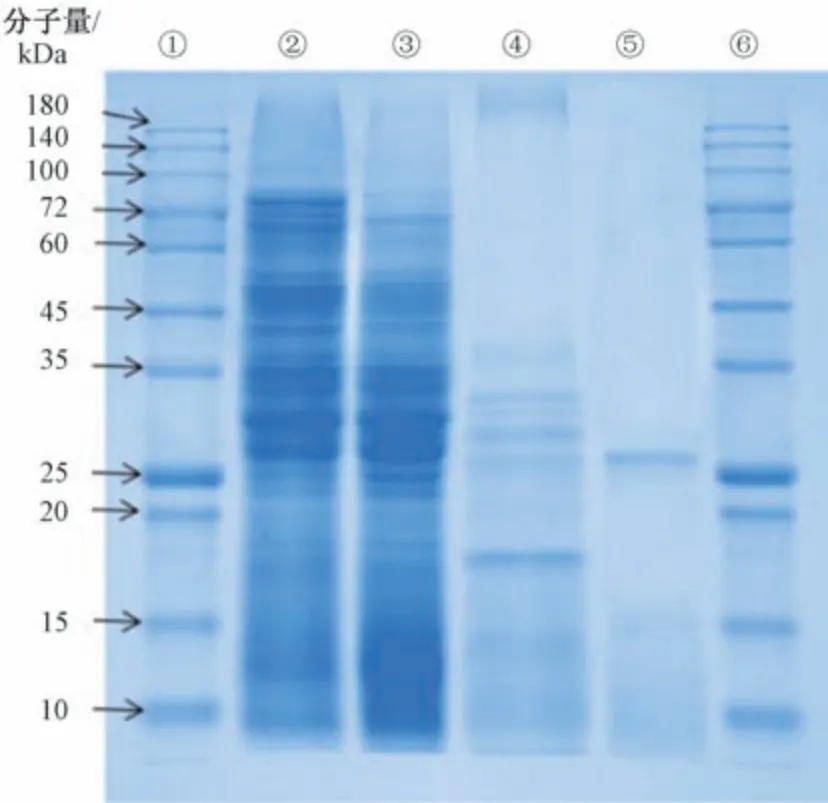
图1 蛆激酶纯化过程中的SDS-PAGE 电泳
3.2 蛆激酶对激活纤溶酶原的激活作用 由图2 可知,蛆激酶、纤溶酶原混合物中纤维蛋白平板上的溶纤圈直径大于蛆激酶,表明前者溶纤活性高于后者,这是因为纤溶酶原自身无溶解纤维蛋白的能力,而蛆激酶具有激活纤溶酶原的作用,可降解平板中纤维蛋白凝块,使得溶纤圈更大。
3.3 蛆激酶降解纤维蛋白原(牛血) 情况 由图3 可知,蛆激酶能有效水解纤维蛋白原的α-亚基、β-亚基、γ-亚基[20],降解次序依次为α 亚基、β 亚基和γ 亚基,即对α亚基的水解作用最快,反应1 min 后即大部分被快速降解,3 min 后被完全降解; 反应10 min 后β 亚基被水解,1 h 内完全降解; γ 亚基在1.5 h 内无明显水解,24 h 后才被完全降解。

图3 蛆激酶对纤维蛋白原的降解情况
3.4 蛆激酶酶切位点 如图4A 所示,BAPNA 保留时间为13.3 min,对硝基苯胺保留时间为8.6 min,苯甲酰精氨酸保留时间为2.1 min; 如图4B 所示,在保留时间2.1、8.6 min 处出现色谱峰,与对硝基苯胺、苯甲酰精氨酸一致,提示BAPNA 已被蛆激酶降解,产生了苯甲酰精氨酸、对硝基苯胺。继续酶解后,随着反应时间延长苯甲酰精氨酸、对硝基苯胺信号值明显升高,BAPNA 响应值逐渐降低,表明其不断被降解,生成了苯甲酰精氨酸、对硝基苯胺,提示激酶具有降解Arg-X 酰胺键(精氨酸酰胺键,“X” 代表其他氨基酸残基) 的能力,过程见图5。

图4 蛆激酶对底物BAPNA 降解的HPLC 色谱图

图5 蛆激酶降解N-α-苯甲酰-DL-精氨酰-4-硝基苯胺盐酸盐(BAPNA) 的过程
3.5 蛆激酶酶动力学研究 由图6A 可知,底物浓度在0.05 ~0.1 mmoL/L 之间时,为一级反应; 在0.1 ~1.5 mmoL/L 之间时,酶促反应速度逐渐加快,为混合级反应;进一步提高底物浓度时,反应速度达到最大值,为零级反应。蛆激酶的酶促反应速度和底物浓度之间的关系符合米氏酶特征,Lineweaver-Burk 方程曲线见图6B,为1/V=12.42× (1/ [S] ) +40.96 (R2=0.998 0),Vmax=0.024 4 U,Km=0.303 mmoL/L,催化常数 (转化数)Kcat=1.627 1/s,Kcat/Km=5.369 L/ (s·mmoL)。
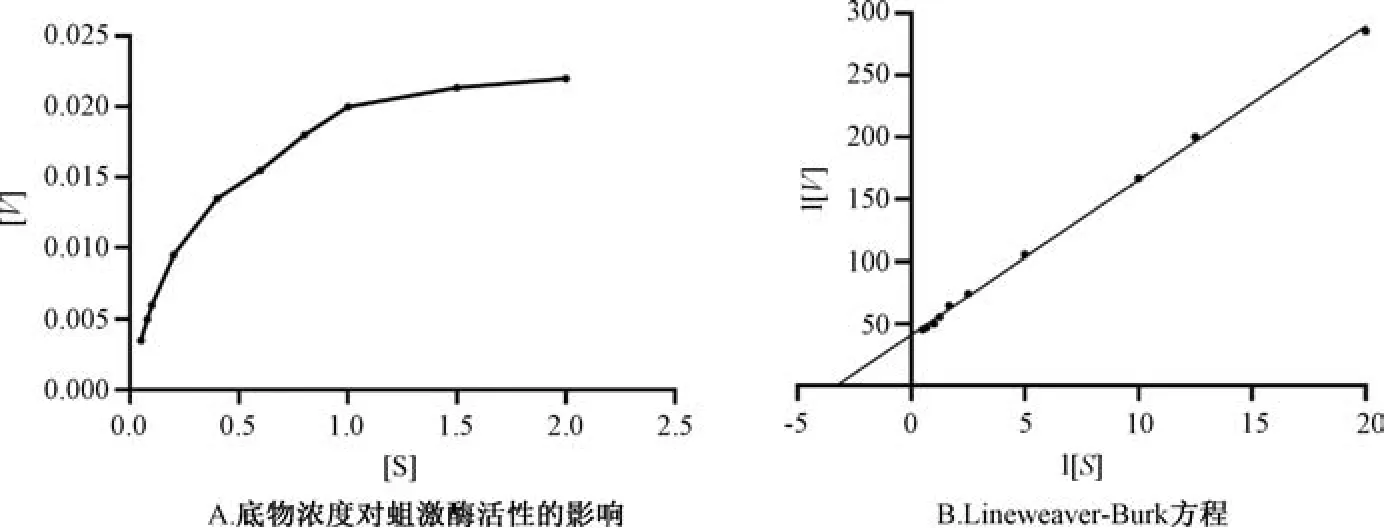
图6 蛆激酶酶动力学研究结果
3.6 抑制剂对酶活性的影响 由表1 可知,PMSF、抑肽酶对酶活有强烈的抑制作用,在1 mmol/L PMSF 作用下蛆激酶残余酶活为24.60%; 1 mmol/L 抑肽酶可完全抑制蛆激酶活性。由于PMSF、抑肽酶为丝氨酸蛋白酶专一性抑制剂[21],对蛆激酶有抑制作用,故推测蛆激酶可能属于丝氨酸蛋白酶家族。
表1 丝氨酸蛋白酶抑制剂对蛆激酶活性的影响(±s,n=3)

表1 丝氨酸蛋白酶抑制剂对蛆激酶活性的影响(±s,n=3)
注: 与对照组比较,*P <0.05; 与1 mmol/L PMSF 组比较,#P<0.05。
组别浓度/(mmol·L-1)溶纤活性/%对照组—100 PMSF 组124.60±0.35*PMSF 组516.98±0.49*#抑肽酶组10*抑肽酶组50*
4 讨论与结论
五谷虫在含有大量腐败物质、病原微生物的环境中生长,可能存在各种用于代谢有毒物质、抵御致病微生物的酶类,目前已报道抗菌肽、蝇蛆凝集素、尿囊素、溶菌酶、酚氧化酶等活性产物。本实验利用盐析、离子交换层析、亲和层析首次对五谷虫中纤溶酶进行分离纯化,制备高活性蛆激酶,该类酶大多为丝氨酸蛋白酶家族,其活性能被丝氨酸特异性抑制剂苯甲基磺酰氟及抑肽酶所抑制,表明其亦为丝氨酸蛋白酶家族。
为了理清蛆激酶作用途径,本实验考察其对纤维蛋白平板的溶纤效果,发现其能将纤维蛋白平板分解,具有溶纤活性。机体纤溶系统与凝血系统维持血液系统平衡,当平衡被病理过程破坏时,过量凝血酶被激活,将纤维蛋白原转化成不溶性纤维蛋白,纤维蛋白沉积形成血栓骨架,与血小板、血细胞共同构成血栓,导致血液凝固[22],引发体内血栓形成,因此,直接降解纤维蛋白是溶栓药物发挥溶栓效果的重要途径,也是蛆激酶的重要活性特征。
纤维蛋白原水平变化在临床诊断中发挥重要作用,研究表明,冠心病等患有心血管疾病人群体内的纤维蛋白原水平升高[23],故在临床上降低血浆中其水平可有效预防血栓形成[24]。本实验以纤维蛋白原为底物,发现蛆激酶可依次降解纤维蛋白原的中α、β、γ 亚基,提示它具有预防血栓形成的潜力。
组织型纤溶酶原激活剂及尿激酶作为传统溶栓药物,可将纤溶酶原激活为纤溶酶,从而发挥溶栓活性,本实验发现,蛆激酶也显示出激活纤溶酶原的特点,能将纤溶酶原转化为有活性的纤溶酶,并且还能将BAPNA 进行降解,提示蛋白中Arg-X 酰胺键可能为蛆激酶作用靶点。
综上所述,五谷虫作为纤溶酶提取的原料,具有价格低廉、来源广泛的优势,本实验开展了蛆激酶制备和评价工作,发现其具有降解纤维蛋白、分解纤维蛋白原、激活纤溶酶原的功能,可为开发多靶点、高效、廉价溶栓药物及治疗高纤维蛋白原血症药物提供一定参考。
