丹参及其相关制剂有效成分稳定性的研究进展
2024-03-25王安琪陆勃帆
佟 煜,张 萌,王安琪,李 铮,陆勃帆,吴 巍,李 慧
(长春中医药大学,吉林省人参科学研究院,吉林 长春 130117)
丹参又名紫丹参、赤参、山参,为唇形科植物鼠尾草丹参SalviamiltiorrhizaBge.的干燥根及根茎[1]。《神农本草经》 记载,丹参“味苦,微寒,主心腹邪气,肠鸣幽幽如走水,寒热积聚,破徵除瘕,止烦满,益气”,现代药理学研究表明,丹参具有抗炎[2]、抗心律失常[3]、抗肿瘤[4-6]等多种药理活性,广泛用于心脑血管病以及其他多种疾病的研究中,是现代中药药理学的热门研究对象[7]。
丹参中的功效成分可分为水溶性和脂溶性,脂溶性成分多为二萜醌类化合物,主要分布在丹参表皮部; 水溶性成分主要为酚酸类,主要包含在丹参根心木质中[8]。这些结构中含有呋喃环、二氢呋喃环、羧基、酯键等基团,易受到光线、高温、pH 值等因素影响。因此,如何有效避免含丹参制剂中有效成分的降解是丹参制品研发的关键。本文通过检索CNKI、PubMed、Web of Science 等中英文文献数据库中2010 年至2021 年关于丹参成分稳定性及其相关制剂研究的相关文献,从丹参中化合物的结构性质出发,综述关于化合物稳定性的影响因素,以及丹参相关的制剂的研究进展,以期为丹参相关产品研究及临床应用提供药效的物质基础和理论依据。
1 丹参脂溶性成分及影响因素
丹参中的二萜类化合物通常含有醌类母核,包括丹参酮ⅡA、隐丹参酮、丹参酮Ⅰ、丹参酮ⅡB、二氢丹参酮等。它们在母核骨架上多具有三元或四元碳环的邻醌或对醌结构,统称为丹参酮类化合物。这类结构都具有邻萘醌发色团。丹参中的二萜化合物多为三环二萜,是丹参的主要活性成分之一[9],其结构易受到pH 值、光照及温度影响发生降解[10]。此外,结构中含有的邻醌或对醌结构电子行为活跃,由于其结构中的不饱和性基团(如环二酮、邻二酚) 极易发生氧化或还原反应而相互转变,可以参与多种氧化还原反应[11]。
1.1 光照 刘梅等[12]研究丹参酮ⅡA的稳定性,发现在自然光照射下,第5 天时开始发生较明显的共轭键断裂的降解反应; 而在紫外光条件下20 d 内保持稳定。说明丹参酮ⅡA紫外光条件下更稳定。
1.2 温度 温度同样对丹参酮类化合物具有较大影响,在60、80 ℃时丹参酮ⅡA的降解比例均在80% 左右; 在100 ℃下12 h 其降解比例能达到60%[12]。赵阳等[13]研究发现,丹参醇提取物中的丹参酮ⅡA在100 ℃加热条件下降解比例增加,在12 h 处其降解比例达到60%,且在100、80、60 ℃条件下均在加热6~8 h 时降解速度处最快。因此在用醇提法提取丹参脂溶性成分的过程中需注意控制加热温度和时间,不要超过6 h 且提取温度应控制在60 ~80 ℃之间,以避免丹参酮类化合物被过多降解,从而减小稳定性因素对提取率的影响。
1.3 pH 值 董川等[14]研究发现,在酸性条件下,丹参中的脂溶性有效成分隐丹参酮与丹参酮ⅡA的荧光光谱蓝移,表明酸性条件下发生开环反应,其共轭体系被破坏; 加碱至中性后荧光强度与位置恢复至实验前相同,说明在强酸条件下共轭双键的开环反应为可逆反应。在强碱条件下同样会发生类似的开环反应,但加酸调至中性后荧光强度与位置未恢复,说明强碱条件下的开环不可逆。丹参酮ⅡA在弱酸条件下最稳定,在强碱条件下会发生不可逆的降解反应,见图1。其结构中的二氢呋喃环结构可看作脱水的半缩酮,在碱性环境下受OH-的亲核进攻而开环,开环产物发生互变异构,在适当条件下脱水环合,形成异隐丹参酮和二氢异丹参酮I[15]。
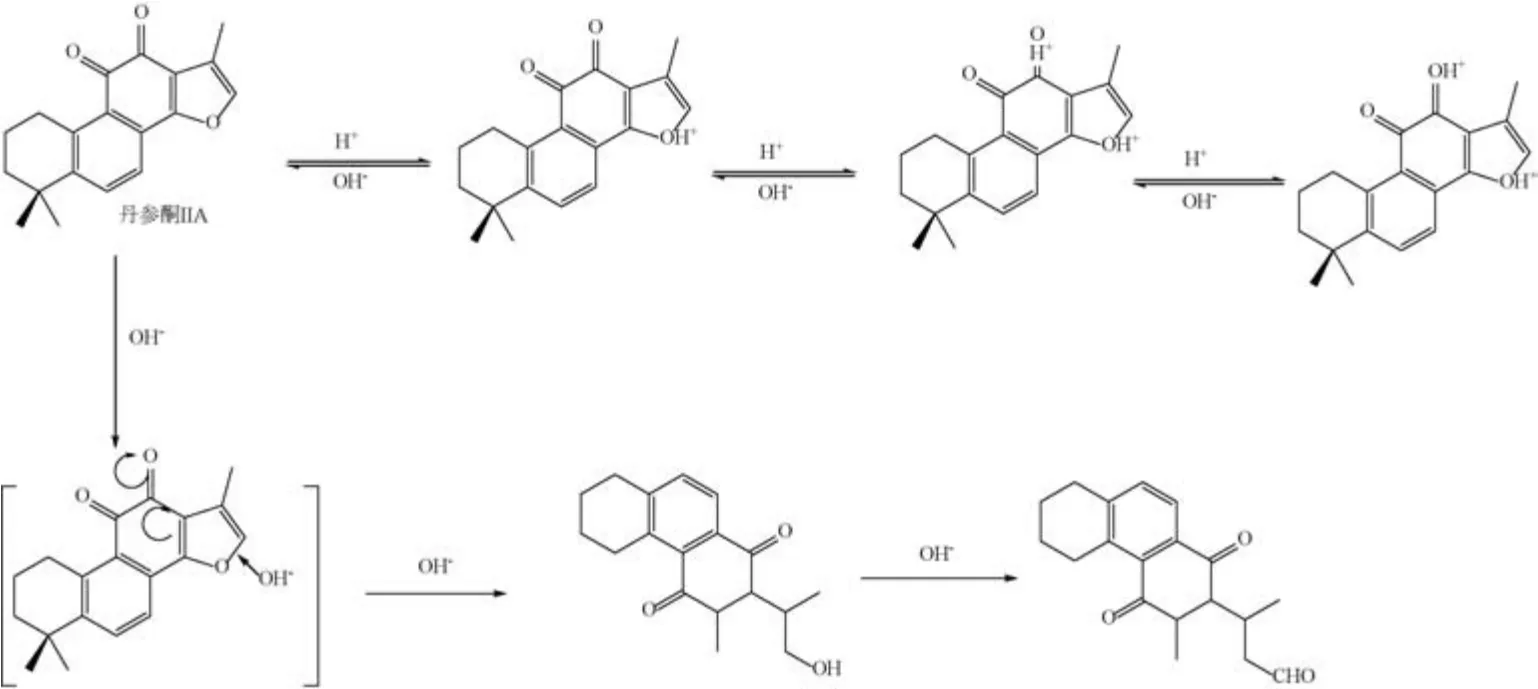
图1 丹参酮ⅡA 在酸/碱介质中的降解转化机制
综上所述,为避免丹参中二萜类化合物的降解,其提取物及制剂等应储存在避光、低温及弱酸性的环境中,同时在提取过程中应注意控制温度,避免成分含量的影响。
2 丹参水溶性成分及影响因素
丹参酚酸化合物也称为咖啡酸衍生物。酚酸类成分按咖啡酸个数为标准来划分,可分为咖啡酸单体化合物,如丹参素、咖啡酸、原儿茶醛; 咖啡酸二聚物,如丹酚酸D、丹酚酸F、迷迭香酸等; 咖啡酸三聚物,如丹酚酸A、紫草酸、丹酚酸C、丹酚酸T/U、丹酚酸H~K 等; 咖啡酸四聚物,如丹酚酸B、丹酚酸E、丹酚酸L、丹酚酸Y 等。
2.1 温度 丹参酚酸类结构中含有不饱和双键、酯键和邻苯二酚,在酸性条件下易受氢离子的影响而发生降解[16-17]。丹酚酸B 的转化主要有2 种途径[18],见图2,一种是经丹参素生成原儿茶醛,另一种是经紫草酸生成丹酚酸A,在正常加热条件下丹酚酸B 一般按照第一种途径进行转化,很少生成丹酚酸A[19],而在高温高压条件下丹酚酸B 则会按照第二种途径转化为丹酚酸A[20]。

图2 丹参酚酸类化合物转化途径
2.2 pH 值 郭永学[21]比较不同pH 条件下丹酚酸B 的稳定性,发现当pH 值为2.0 时稳定性最好,当pH 值小于2.0 时,丹酚酸B 降解反应速率常数随H+浓度升高而升高,表明丹酚酸B 降解反应可能受H+催化; 当pH 值大于6.0时,降解反应的速率常数随OH-浓度升高而升高,表明丹酚酸B 的降解也会受OH-的影响。因此,丹参的水溶性提取物在存放时应在低温环境下储存,且在提取过程中应注意控制pH 为弱酸性。
3 丹参相关制剂及稳定性研究
3.1 汤剂 汤剂是传统中药剂型最常见的剂型,是将中药饮片或粗粉加水煎煮后过滤所得。汤剂可随证进行药物成分和剂量的调整,较为符合中医的“辨证施治” 理论。但中药汤剂的传统煎煮方式操作较为复杂,以水为溶剂,需准确控制时间、次数、剂量、温度及储存条件,耗时长且费力,煎煮所得汤剂保存难度较大。雷凯君等[22]比较3种不同煎煮方法对丹参汤剂的质量影响,结果发现,2 次常压煎煮所得的丹酚酸B 含量较高,高压煎药机煎煮法次之,传统砂锅煎煮法最低。表明分次常压条件下煎煮可以在保证完全提取的情况下减少长时间加热造成的成分降解,从而保证汤剂中丹酚酸B 的含量较高。
3.2 配方颗粒 中药配方颗粒是在中医药理论指导下,将中药材饮片经水提、分离、浓缩、干燥等方式制成颗粒剂[23]。周慧慧等[24]通过对丹参-红花配方颗粒与传统汤剂的主要成分及药效进行比较研究,发现丹参-红花配方颗粒及汤剂的主要成分的种类和对缺血心肌的改善作用基本一致,经测定发现颗粒剂中丹酚酸B 的质量浓度约为汤剂的3 倍,这一方面是由于配方颗粒中的有效成分被浓缩,另一方面是由于丹参的固体制剂中的有效成分的稳定性大于液体制剂。该研究表明丹参的配方颗粒可以在一定程度上替代传统汤剂,为配方颗粒的临床应用提供较好的理论依据。
3.3 固体口服制剂 固体的口服制剂包括片剂、胶囊剂、滴丸剂等,在现代中药制剂研究中,由于其具有便于携带,服用方便的特点,一直是中药现代剂型重点开发的对象[25]。Shao 等[26]发现,冰片可以通过开放血脑屏障,抑制p-糖蛋白(P-gp) 外流的方式,提高药物的生物利用度。药动学研究表明,冰片能提高复方丹参片中丹参酚酸B、丹参酮ⅡA等成分的相对生物利用度。肖晏婴等[27]研究发现,薄膜衣片剂具有较强的抗吸潮、抗氧化能力,可以更好地改善片剂的稳定性。相比于传统的糖衣片,薄膜衣片能够较好地保证成分的稳定性,避免因吸潮、光照等导致的降解现象,增加其稳定性。
3.4 注射剂 徐美玲等[28]对临床上发生的丹参酮ⅡA磺酸钠注射液相关的不良反应进行Logistic 回归分析,发现丹参酮ⅡA磺酸钠注射液通过于磺酸钠的亲水基团结合,降低丹参酮ⅡA活性,提高产品的稳定性[29]。但是由于磺酸基的亲水性太大,注入体内后迅速随尿和粪便排出,而且极性较大难以穿过血脑屏障,所以采用磺化成盐的方式来达到提高丹参酮ⅡA稳定性和生物利用度的目的,在长期储存过程中会有轻微沉淀产生,不溶性的丹参酮ⅡA磺酸析出,产生的微粒进入人体内易导致变态反应[30]。分析结果表明,在临床使用过程中,有部分不良反应来源于有效成分的降解产物,而降解来源于存储条件及温度的影响。表明提高制剂中成分的稳定性,可以适当减少不良反应的发生,这与文献[14] 研究结果一致。
3.5 乳剂 乳剂系指由2 种互不相溶的液体,其中一种液体以小液滴形态分散在另一种液体中所形成的非均相分散体系而制备而成的一类制剂,包括普通乳、复乳、微乳、亚微乳等[31],从而增加易水解药物的稳定性,使药物达到缓释、控释、延长药效的目的,并具有靶向性[32-33]。
王秀丽等[34]发现,将丹参酮ⅡA乳剂冻干后会使其稳定性增加,而后在高温及光照条件下也没有太大程度降解。4 ℃避光条件下,丹参酮ⅡA含量基本稳定; 说明体系中的油相和乳化剂成分能够提高丹参酮ⅡA的稳定性。体系中存在油膜、乳化剂、助乳化剂、等渗调节剂时,丹参酮ⅡA乳剂在4 ℃下避光稳定保存1 年,无分层、沉淀、乳化及丹参酮ⅡA降解等现象发生,表明丹参酮ⅡA乳剂的理化性质稳定且平均粒径均一[35]。
童廷德等[36]在传统乳剂的基础上进行改进,制备SalB-磷脂复合物自乳化药物传递系统,口服后可经过胃肠道蠕动迅速自乳化形成油/水型乳剂。实验发现,丹酚酸B 乳剂在血液中可以减缓药物在胃肠内释放速率,提高生物利用度,降低胃肠道的损伤。综上所述,将丹参酮ⅡA制成乳剂及其衍生物可以提高其稳定性,并且使一些难以透过屏障的药物更好通过,从而提高生物利用度达到更好的治疗效果。
3.6 包合物 包合物是将难溶性药物分子包藏于宜的包合材料内腔中制成包合物,用来防止其氧化、水解或挥发,并且包合物外层亲水表面有较好的溶解性能,能提高疏水药物溶解度和生物利用度的作用[37]。目前常用的包合材料包括α-环糊精(α-CD)、β-环糊精(β-CD)、γ-环糊精(γ-CD) 和2-羟丙基β-环糊精(HP-β-CD)。这些配合物可作为药物载体,提高药物的稳定性、溶解度及生物利用度[38]。
吴妮等[39]研究表明,丹参酮ⅡA的β-CD 包合物不但能够提高丹参酮ⅡA的生物利用度,也能提高丹参酮ⅡA在光照及高温环境下的稳定性[40],同时可减缓丹参酮ⅡA被肠道菌群降解的速率,延长丹参酮ⅡA作用时间,减少药物挥发和氧化,增加其稳定性[41-42]。
李俊芬等[43]采用共沉淀法分别制备隐丹参酮/β-CD 与隐丹参酮/HP-β-CD 固体包合物,经环糊精包合后具有抗光解性,自然光照射2 h 后,隐丹参酮吸光度下降41%,隐丹参酮/β-CD 固体包合物吸光度只下降13.2%,隐丹参酮/HP-β-CD 固体包合物吸光度仅下降3.5%,表明HP-β-CD比β-CD 具有更高的增溶能力且安全性能、物理和化学稳定性及药物的口服生物利用度也得到改善[44-45]。HP-β-CD 可作为适宜的药物载体用于提高隐丹参酮口服制剂的稳定性及胃肠道吸收。
3.7 固体分散体 固体分散体是将药物高度分散在固体载体中形成以固体形式存在的分散系统,从而使液体药物固态化,掩盖药物的不良气味。由于载体的包蔽作用,可延缓药物的水解、挥发以及氧化,用于提高难溶性药物的稳定性、溶出度及口服生物利用度[46-47]。目前,固体分散体使用的几种亲水性载体包括聚乙烯吡咯烷酮[48-49]、聚乙二醇[50-51]和泊洛沙姆[52],均通过减小粒径、增加润湿性和保持药物的非晶态形式来实现提高药物的稳定性。
蒋艳荣等[53]以纳米二氧化硅和泊洛沙姆188 作为二元载体,制备的固体分散体,发现丹参酮ⅡA二元载体固体分散体能显著改善丹参酮ⅡA的溶出,提高丹参酮ⅡA稳定性。经过3 个月稳定性加速试验表明,固体分散体中药物溶出和含量未发生明显变化,工艺稳定。陈百科等[54]发现,储存温度对固体分散体稳定性有较大的影响。60 ℃下储存5 d 后,固体分散体的释放率下降5%; 10 d 时,累积释放率降至83.41%; 40 ℃下10 d 后累积释放率仍有86.07%; 25 ℃下,储存10 d 后累积释放率仍高达90.32%。说明储存温度温度控制在25 ℃以下会使丹参酮IIA的固体分散体的稳定性显著提高。
刘其媛等[55]以壳聚糖为载体,制备丹参酮ⅡA的固体分散体,随着载体比例的增加,当丹参酮ⅡA与壳聚糖比例为1 ∶9 时,丹参酮ⅡA在酸性条件下较为稳定,丹参酮ⅡA溶出度高于90%。通过柠檬酸预处理调节体系的pH 至弱酸性可使丹参酮ⅡA在载体中形成非结晶的无定形物,载体用量的增大可以提高丹参酮ⅡA在载体中的分散程度,使其溶解度和溶出速率均增大,增加丹参酮ⅡA稳定性。
此外,三元固体分散体可以延长非晶态药物的稳定性。Yan 等[56]以纳米CaCO3和泊洛沙姆188 为原料制备三元固体分散体,可提高丹参酮ⅡA稳定性和溶解性,说明将丹参酮ⅡA制备成固体分散体有利于其稳定性的提高和药效的发挥。
3.8 脂质体 脂质体是由脂质双分子层组成的内部为水相闭合囊泡,具有良好的生物相容性、靶向性,可延长药物体内滞留时间和疗效、提高药物稳定性、低清除率和低毒性[57]。根据药物的特性和包封过程,将一种以上的治疗药物包埋在脂质体内部或嵌入到脂质体膜中,可解决其稳定性差、在血液循环中滞留时间短、体内作用时间短等问题[58]。
张丽红等[59]通过以弱酸性甘氨酸-盐酸缓冲液为水合介质制备长循环脂质体并通过冷冻干燥法将其制为冻干品,所制备丹酚酸B 长循环脂质体在4 ℃下放置3 个月后,丹酚酸B 含量、包封率和粒径并无明显变化,表明长循环脂质体的长期稳定性良好。
此外,长循环脂质体能够改变药物的药动学性质,更持久地延长药物在血流中的时间,以获得更充足的时间到达靶向部位,提高药物的生物利用度实现药物的靶向定位[60]。张文丽等[61]采用沉淀溶剂扩散法制备丹参酮ⅡA-固体脂质纳米粒,研究发现,泊洛沙姆188 涂层可降低巨噬细胞摄取,在血液中丹参酮ⅡA-固体脂质纳米粒比丹参酮ⅡA溶液有更长的循环时间,这可能是由于脂质体可以稳定化学键并具有避光作用,从而减少丹参酮ⅡA的降解,并且增加其在体内的生物利用度。
Hu 等[62]通过制备壳聚糖-固体脂质纳米粒使隐丹参酮以热力学稳定的过饱和状态存在,在储存过程中没有药物结晶出分散体,使用表面活性剂如吐温80 和十二烷基硫酸钠等也有助于提高固体脂质纳米粒作为渗透促进剂的稳定性和生物利用度[63]。
3.9 其他 Chen 等[64]通过溶剂共蒸发法制备丹参酮ⅡA-磷脂复合物和有序中孔二氧化硅固体分散体的联合药物传递系统来提高丹参酮ⅡA的吸收渗透性和体外溶出速率,研究发现,联合药物传递系统结合脂质体和固体分散体的优点,能够更好地提高丹参酮ⅡA的稳定性,这对更加稳定的丹参新剂型的开发具有指导意义。Li 等[65]通过使用生物素化的脂质双层涂布介孔二氧化硅纳米粒子作为丹参酮ⅡA的载体材料,使得纳米粒中的丹参酮ⅡA转化为非晶态而稳定存在,从而提高药物的溶出速率。
4 结语与展望
丹参中的主要活性成分丹参酮与丹酚酸类,由于其成分结构的特征,在生产及临床应用中经常出现在生产及储存过程中发生降解的问题,对药品的质量产生较大的影响,也对后续制剂的开发和药理作用的研究产生阻碍。本文总结丹参中有效成分的稳定性及近年来各种剂型的研究进展情况。目前有关丹参有效组分新型递药研究虽然在一定程度上解决有效成分稳定性差导致的生物利用度低、药理活性低等问题,但这一系列研究主要采用体外细胞及动物模型,缺乏丹参新型递药系统的临床试验研究。此外,从剂型与制剂处方工艺的角度来保证丹参成分的稳定性还需要新型的材料来稳定化学结构的晶型及化学键的稳定。这有待进一步研制和开发更有效的临床给药方式,也是以后丹参制剂临床应用研究的方向。
综上所述,后续通过开发新型递药系统,以提高丹参有效成分的稳定性来提高生物利用度,以及减少由于稳定性差导致的药理活性低和相关不良反应的发生。使得丹参有效成分新型制剂有望在今后的临床应用中取得突破性进展,同时也为该类有效成分的新型制剂研发与临床应用提供思路与参考。
