基于IKKβ/NF-κB 通路探讨温胆汤对睡眠障碍小鼠的神经保护作用
2024-03-25李莉,刘茹,何晶,陈云,郭娟,纪可,刘玲
李 莉,刘 茹,何 晶,陈 云,郭 娟,纪 可,刘 玲
(湖北中医药大学,湖北 武汉 430065)
睡眠障碍是常见的身体功能障碍,表现为睡眠-觉醒过程中的各种功能紊乱,其中失眠较为常见[1]。睡眠障碍可导致认知能力下降和神经精神障碍,影响长期记忆形成并伴随焦虑样行为的产生[2]。我国有45.5% 人群存在睡眠问题,其中老年人占比高达56.7%[3]。因此,改善睡眠障碍对我国居民健康尤其是中老年人来说显得尤为重要。
目前临床治疗睡眠障碍的药物多为唑吡坦、艾司佐匹克隆、扎来普隆、褪黑激素等,部分药物会导致嗜睡等不良反应,而中医药具有毒副作用小的特点[4-6]。温胆汤由6 味中药组成[7],研究发现黄连和酸枣仁加味的温胆汤对失眠有较好的疗效[8];温胆汤配合认知-行为疗法对慢性失眠痰热内扰症疗效较好[9]; 温胆汤含药血清可抑制谷氨酸环境下星型胶质细胞凋亡[10]。睡眠障碍将直接导致大脑神经系统和神经元损伤,由此推测温胆汤能够修复睡眠障碍导致的神经损伤。本研究通过构建失眠小鼠模型,给予温胆汤干预,观察小鼠大脑皮层、海马组织CA1 区、下丘脑的病理变化,检测血清和脑组织中细胞因子的变化,并基于IκB 激酶β (IκB kinase-β,IKKβ) /核转录因子-κB (nuclear factor kappa-B,NF-κB) 通路探讨可能的作用机制,以期为温胆汤缓解睡眠障碍提供一定的研究基础。
1 材料
1.1 试剂 伊红、中性树脂、苏木素、DAB 浓缩型试剂盒、封闭山羊血清(货号E8090、G8590、G1140、DA1010、SL038,北京索莱宝科技有限公司); 免疫组化试剂盒(货号KIT-5020,福州迈新生物技术开发有限公司); 尼氏染色液(货号G1036,武汉赛维尔生物科技有限公司); 白细胞介素6(interleukin 6,IL-6)、肿瘤坏死因子(tumor necrosis factor,TNF-α)、白细胞介素1β (interleukin 1β,IL-1β)、神经丝轻链 (neurofilament light chain,NEFL)、神经特异性烯醇化酶 (neuron specific enolase,NSE) 试剂盒、兔抗小鼠胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、GAPDH抗体、山羊抗兔二抗(货号MU30044、MU30030、MU30369、MU30977、MU30617、PAB32097、PAB36269、SAB43714,武汉贝茵莱生物科技有限公司); S100 钙结合蛋白B (S100 calcium binding protein B,S100B) 试剂盒(货号JYM0833M,武汉基因美生物科技有限公司); 戊巴比妥钠(货号P3761,美国Sigma 公司); 兔抗小鼠IKKβ、NFκB、p-IKKβ、p-NF-κB 抗体 ( 货号 ab178872、ab220803、ab38515、ab288751,英 国 Abcam公司)。
1.2 药物 温胆汤所用中药饮片购自湖北省中医院门诊中药房,并经刘玲教授鉴定为正品; 艾司唑仑片(规格1 mg/片,批号H42021522,华中药业股份有限公司),将1 片艾司唑仑片溶于167 mL水,配制成6 μg/mL 的溶液。
1.3 仪器 DM1000 型显微镜、RM2235 型切片机(德国徕卡公司); DHG-9023A 型恒温烘箱(上海一恒科学仪器有限公司); TKD-TK 型摊片烤片机、TKD-TSF 型自动组织脱水机(湖北康强医疗器械有限公司); TB-718L 型包埋机、TB-718D 型生物组织包埋机(湖北泰维科技实业股份有限公司);352 型酶标仪 (芬兰Labsystems Multiskan MS 公司); AC-8 型洗板机(美国Thermo Labsystems 公司); JM-A3002 型电子天平(诸暨市超泽衡器设备有限公司); 旋转型睡眠剥夺仪(自制)。
1.4 动物 30 只雌性昆明小鼠,SPF 级,4 ~5 周龄,体质量20~25 g,购自三峡大学动物实验中心[实验动物生产许可证号SCXK (鄂) 2018-0012]。小鼠饲养条件为温度20 ~26 ℃,相对湿度40% ~70%,自由饮水。本实验经武汉华联科生物技术有限公司动物伦理委员会审查通过(伦理号HLK-20190301-001)。
2 方法
2.1 温胆汤制备 温胆汤由半夏6 g、竹茹6 g、麸炒枳实6 g、陈皮9 g、炙甘草3 g、茯苓4.5 g 组成,每剂含生药34.5 g。第1 次煎煮加8 倍量水,煮沸后煎40 min,过滤取汁,第2 次煎煮加6 倍量水,煮沸后煎30 min,过滤取汁,合并2 次滤液,浓缩,配制成生药量0.5、2 g/mL 的溶液,于4 ℃冰箱保存备用。
2.2 睡眠障碍小鼠模型构建 通过改良版水平转盘睡眠剥夺法构建失眠小鼠模型[11]。使用亚克力塑料板制作睡眠剥夺箱(110 cm×60 cm×40 cm),其底部固定有15 个圆柱形平台(直径6.5 cm,高8 cm),保持10 cm 纵向间距,13 cm 横向间距,注入23~25 ℃水至平台下1 cm 处,保持水温。适应性培养7 d 后,将小鼠放置于睡眠箱平台上进行站立训练,当其即将进入睡眠时,由于肌肉松弛垂头触水或落入水中而惊醒,使其被迫保持清醒站立,早晚各休息1 次,每次30 min,共训练14 d。造模期间,每2 d 记录1 次小鼠行为学改变(精神状态、饮食)、毛发和体质量,给药后每天记录1次小鼠行为学改变。
2.3 分组及给药 24 只小鼠按“2.2” 项下方法构建睡眠剥夺模型,造模成功后随机分为模型组、艾司唑仑片组和温胆汤低、高剂量组,每组6 只,另选6 只正常饲养的小鼠为对照组。艾司唑仑片组灌胃0.15 mg/kg 艾司唑仑片药液,温胆汤低、高剂量组灌胃12.5、50 g/kg 温胆汤药液,对照组小鼠灌胃生理盐水,每天1 次,共7 d,灌胃体积0.5 mL。
2.4 取材 最后1 次给药12 h 后,眼眶采血0.5~1 mL,离心后收集血清。100 mg/kg 戊巴比妥钠过量麻醉处死小鼠,收集小鼠脑组织,一半于4%甲醛中固定,另一半于-80 ℃冰箱中冷冻保存。
2.5 ELISA 法检测血清及脑组织NEFL、NSE、S100B、TNF-α、IL-6、IL-1β 水平 按照ELISA 试剂盒说明书,分别检测小鼠血清和脑组织NEFL、NSE、S100B、TNF-α、IL-6、IL-1β 水平。
2.6 HE 染色观察大脑皮层、海马组织CA1 区、下丘脑病理变化 取固定好的小鼠脑组织,切取适宜大小,浸蜡包埋,制备病理切片,切片脱蜡,经苏木精染色3 ~6 min,促蓝液返蓝5 ~10 s,0.5%伊红染色2~3 min,脱水固封后,于显微镜下拍照并采集图像。
2.7 免疫组化染色观察小鼠脑组织星形胶质细胞损伤情况 取小鼠脑组织切片,二甲苯脱蜡后水化,柠檬酸钠高压修复,30% H2O2孵育消除内源性过氧化物酶活性,血清封闭,加GFAP 一抗孵育过夜,滴加二抗孵育,DAB 染色,苏木素复染细胞核,1%盐酸乙醇分化,脱水,封片,于显微镜下观察GFAP 阳性表达并拍照,使用Image J 软件分析平均光密度。
2.8 尼氏染色观察小鼠脑组织神经元损伤情况 取小鼠脑组织切片,脱蜡,尼氏染液染色2 ~5 min,0.1%冰醋酸稍分化,脱水,透明,树胶封固,于显微镜下观察小鼠脑组织神经元损伤情况。
2.9 Western blot 法检测脑组织GFAP、p-IKKβ、p-NF-κB 蛋白表达 取适量脑组织,剪碎后加入RIPA 裂解液,裂解充分后提取总蛋白,BCA 法进行蛋白质定量。上样进行SDS-PAGE 电泳,将蛋白湿转至PVDF 膜,5%脱脂奶粉溶液封闭1 h,洗膜后加入一抗稀释液,4 ℃孵育过夜,次日洗膜后加入二抗稀释液,室温孵育1 h,ECL 显影,曝光。使用Image J 软件分析条带灰度值,目的蛋白条带灰度值与内参蛋白条带灰度值的比值即为目的蛋白的相对表达量。
2.10 统计学分析 通过SPSS 23.0 软件进行处理,计量资料以(±s) 表示,多组间比较采用单因素方差分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 温胆汤对睡眠障碍小鼠一般情况的影响 如图1A 所示,实验开始第7 ~15 天,随着小鼠睡眠障碍时间的增加,其体质量逐渐降低; 在温胆汤给药后第2 天(实验开始第17 天),温胆汤各剂量组小鼠体质量均高于模型组(P<0.05)。给药7 d后,与模型组比较,温胆汤高剂量组小鼠体质量增加(P<0.01),见图1B。通过观察21 d 各组小鼠精神状态、饮食和毛发,发现睡眠障碍小鼠在给药前精神状态较差、毛发光泽较差、饮食减少; 给药后,温胆汤低、高剂量组小鼠精神状态、毛发和饮食情况都有所改善,结果表明温胆汤能够改善睡眠障碍导致的小鼠状态异常。

图1 温胆汤对睡眠障碍小鼠体质量的影响(±s,n=6)Fig.1 Effects of Wendan Decoction on body weight of sleep disorders mice (±s,n=6)
3.2 温胆汤对睡眠障碍小鼠炎症反应的影响 如图2 所示,与对照组比较,模型组小鼠血清和脑组织TNF-α、IL-6、IL-1β 水平均升高 (P<0.01);与模型组比较,温胆汤各剂量组血清和脑组织TNF-α、IL-6、IL-1β 水平均降低(P<0.01),表明温胆汤具有抑制睡眠障碍小鼠炎症反应的作用。
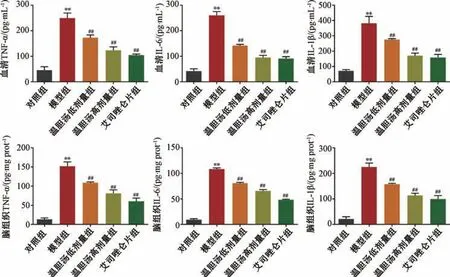
图2 温胆汤对睡眠障碍小鼠血清和脑组织炎症因子水平的影响(±s,n=6)Fig.2 Effects of Wendan Decoction on serum and brain inflammatory factors in sleep disorders mice (±s,n=6)
3.3 温胆汤对睡眠障碍小鼠脑损伤标志物水平的影响 如图3 所示,与对照组比较,模型组小鼠血清和脑组织NEFL、NSE、S100B 水平均升高(P<0.01); 与模型组比较,温胆汤各剂量组小鼠血清和脑组织NEFL、NSE、S100B 水平均降低(P<0.01),表明温胆汤能够缓解睡眠障碍小鼠的神经系统损伤。

图3 温胆汤对睡眠障碍小鼠血清和脑组织脑损伤标志物水平的影响(±s,n=6)Fig.3 Effects of Wendan Decoction on serum and brain brain injury markers in sleep disorders mice (±s,n=6)
3.4 温胆汤对睡眠障碍小鼠脑组织病理变化的影响 如图4 所示,与对照组比较,模型组小鼠大脑皮层组织中神经元细胞核皱缩变形,细胞排列杂乱,核染色加深,核仁消失; 海马CA1 区组织中神经元细胞数目减少,CA1 区细胞排列不紧密,水肿明显; 下丘脑组织神经细胞固缩变形,组织基质疏松、呈网状结构。与模型组比较,随着温胆汤剂量的增加,变形的神经细胞逐渐减少,深染固缩的细胞核形态变少,排列紊乱现象减少; 神经元细胞数量增多,细胞排列整齐,结构逐渐清晰; 下丘脑组织基质网状结构减少。温胆汤高剂量组脑组织病理改善效果接近于艾司唑仑片组。以上结果表明,温胆汤对于睡眠障碍小鼠脑组织病理改善具有良好的效果。

图4 温胆汤对睡眠障碍小鼠脑组织病理变化的影响(×200)Fig.4 Effects of Wendan Decoction on cerebral pathological changes of sleep disorders mice (×200)
3.5 温胆汤对睡眠障碍小鼠脑组织GFAP 表达的影响 如图5 所示,与对照组比较,模型组小鼠脑组织中星形胶质细胞GFAP 表达增多(P<0.01);与模型组比较,温胆汤各剂量组GFAP 表达降低(P<0.01),表明温胆汤具有抑制睡眠障碍小鼠脑组织星形胶质细胞GFAP 活化的作用。

图5 温胆汤对睡眠障碍小鼠脑组织GFAP 表达的影响(±s,n=6)Fig.5 Effects of Wendan Decoction on cerebral GFAP expression in sleep disorders mice (±s,n=6)
3.6 温胆汤对睡眠障碍小鼠脑组织神经元的影响 如图6 所示,与对照组比较,模型组小鼠脑组织尼氏小体数减少; 与模型组比较,温胆汤各剂量组小鼠脑组织尼氏小体数增多。此外,与对照组比较,模型组小鼠脑组织神经元细胞数减少,细胞排列出现混乱,细胞轮廓不清晰; 与模型组比较,温胆汤高剂量组小鼠脑组织神经元细胞数增多,细胞排列整齐,轮廓不清晰的细胞数减少。以上结果表明,温胆汤具有保护脑组织神经元受损的作用。

图6 温胆汤对睡眠障碍小鼠脑组织神经元的影响(×200)Fig.6 Effects of Wendan Decoction on brain neurons in sleep disorders mice (×200)
3.7 温胆汤对睡眠障碍小鼠脑组织IKKβ/NF-κB通路活化的影响 如图7 所示,与对照组比较,模型组小鼠脑组织IKKβ 和NF-κB 蛋白磷酸化水平均升高(P<0.01); 与模型组比较,温胆汤各剂量组小鼠脑组织IKKβ 和NF-κB 蛋白磷酸化水平均降低(P<0.01),表明温胆汤能够抑制睡眠障碍小鼠脑组织中IKKβ/NF-κB 通路的活化。

图7 温胆汤对睡眠障碍小鼠脑组织IKKβ/NF-κB 通路活化的影响(±s,n=6)Fig.7 Effects of Wendan Decoction on activation of cerebral IKKβ/NF-κB pathway in sleep disorders mice (±s,n=6)
4 讨论
本研究结果显示,经温胆汤给药后睡眠障碍小鼠大脑皮层、海马组织CA1 区、下丘脑组织病变均有所改善,提示温胆汤具有改善神经损伤的作用。此外,温胆汤给药后星形胶质细胞GFAP 活化受到抑制。研究表明,星形胶质细胞GFAP 活化与中枢神经系统疾病密切相关[12]。在头针联合中药对缺血性脑卒中失眠大鼠的研究中同样发现,睡眠改善后GFAP 也随之减少[13]。本研究结果显示,睡眠障碍小鼠经温胆汤给药后尼氏小体数量增多,GFAP 表达受到抑制,提示温胆汤能够保护睡眠障碍小鼠的神经元。
研究表明,慢性失眠患者血清NfH、NfL、NSE、S100B 水平升高,这些指标提示存在神经元、星形胶质细胞、神经末梢等脑微结构损伤[14]。本研究结果显示,在睡眠障碍小鼠血清和脑组织中脑组织损伤标志物NEFL、NSE、S100B 水平均升高,此外本研究发现炎症因子的水平也升高,结合两者的变化可以认为睡眠障碍导致了脑组织出现炎症反应,炎症反应又引起了脑组织损伤。经温胆汤给药后,NEFL、NSE、S100B 和炎症因子水平均降低,提示温胆汤可通过降低睡眠障碍导致的炎症反应以及脑组织损伤和神经元信号转导的标志物的过度表达来调缓解脑损伤。
炎症反应受到多种通路的调节,其中NF-κB通路的研究最为深入[15-16]。IκB 的降解介导NF-κB信号通路的激活,IκB 激酶(IKK) 复合物可促进IκB 的磷酸化[17]。NF-κB 一旦被激活,大量炎性因子的释放会加重神经损伤[18]。研究表明,IKKβ/NF-κB 信号通路的激活与神经炎症反应密切相关[19-20]。Douglass 等[21]发现,抑制IKKβ/NF-κB信号通路的激活能够保护小鼠免受下丘脑炎症损伤。Fei 等[22]发现,阻断IKKβ/NF-κB 信号通路能够抑制神经元的凋亡和炎症反应,从而改善脊髓损伤。本研究结果显示,睡眠障碍小鼠脑组织中IKKβ/NF-κB 通路被激活,而经温胆汤给药后,IKKβ/-NF-κB 通路受到抑制,提示温胆汤可能通过抑制IKKβ/NF-κB 通路来抑制炎症反应,减轻神经损伤。
综上所述,本研究发现温胆汤可改善睡眠障碍小鼠脑组织病变,并可能通过抑制IKKβ/NF-κB 通路的激活减少脑组织中炎症的发生,最终发挥修复睡眠障碍小鼠神经损伤的作用。
